解题方法
1 . 硫铁矿(主要成分FeS2)是接触法制硫酸的主要原料,接触法制硫酸的生产原理分三步。
I.4FeS2 +11O2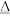 2Fe2O3+8SO2;
2Fe2O3+8SO2;
II.2SO2 +O2 2SO3;
2SO3;
III.SO3+H2O=H2SO4。
回答下列问题:
(1)①基态O原子的核外电子排布式为_______ ;基态Fe原子共有_______ 种运动状态不同的电子。
②Fe2+形成的配合物亚铁氰化钾(K4[Fe(CN)6])又称黄血盐,可用于检验Fe3+。写出两种与CN-互为等电子体的分子的化学式:_______ ;含有12 mol σ键的K4[Fe(CN)6]的物质的量为_______ mol。
③已知Fe2+半径为61 pm,Co2+半径为65 pm, 则在隔绝空气条件下分别加热FeCO3和CoCO3,FeCO3受热分解温度_______ (填“ 低于”或“高于”)CoCO3。
(2)①H2SO4的酸性强于H2SO3的酸性的原因是_______ 。
②SO2中S原子的杂化方式为_______ ;SO3的立体构型为_______ 。第一电离能:S_______ O(填“>”或“<”)。
(3)FeS2晶体的晶胞结构如图所示。

①FeS2晶体中距离Fe2+最近的Fe2+的数目为_______ 。
②FeS2晶体的晶胞参数为a nm,密度为ρg·cm-3,阿伏加德罗常数的值为NA,则FeS2的摩尔质量M=_______ g·mol-1(用含a、ρ、NA的代数式表示)。
I.4FeS2 +11O2
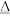 2Fe2O3+8SO2;
2Fe2O3+8SO2;II.2SO2 +O2
 2SO3;
2SO3;III.SO3+H2O=H2SO4。
回答下列问题:
(1)①基态O原子的核外电子排布式为
②Fe2+形成的配合物亚铁氰化钾(K4[Fe(CN)6])又称黄血盐,可用于检验Fe3+。写出两种与CN-互为等电子体的分子的化学式:
③已知Fe2+半径为61 pm,Co2+半径为65 pm, 则在隔绝空气条件下分别加热FeCO3和CoCO3,FeCO3受热分解温度
(2)①H2SO4的酸性强于H2SO3的酸性的原因是
②SO2中S原子的杂化方式为
(3)FeS2晶体的晶胞结构如图所示。

①FeS2晶体中距离Fe2+最近的Fe2+的数目为
②FeS2晶体的晶胞参数为a nm,密度为ρg·cm-3,阿伏加德罗常数的值为NA,则FeS2的摩尔质量M=
您最近一年使用:0次
解题方法
2 . 已知反应2K2Cr2O7+3CH3CH2OH+8H2SO4+13H2O=2[Cr(H2O)6]2(SO4)3+3CH3COOH+2K2SO4是交警检查驾驶员是否酒驾时所用检测仪的工作原理。回答下列问题:
(1)基态铬原子价层电子排布图为___________ ,点燃含钾元素的物质时,钾原子的价电子由___________ (填“激发态”或“基态”)跃迁到另一状态时会产生紫色的火焰。
(2)在[Cr(H2O)6]3+中,提供孤电子对以形成配位键的元素是___________ ,K、S、O三种元素的第一电离能由大到小的顺序为___________ ,与CH3CH2OH相比,CH3COOH中碳原子所含有的不同类型的杂化方式是___________ 。
(3)CH3CH2OH的沸点为78.5℃、CH3COOH的沸点为117.9℃,导致这种差异的主要原因是___________ 。
(4)已知CrO2Cl2与CCl4、CS2等互溶,据此可判断CrO2Cl2分子的空间构型是___________ (填“四面体”或“四边形”);硫的一种氧化物的部分结构片段如图所示,则该氧化物的化学式为___________ 。

(5)已知单质铬的原子的一种堆积方式如图所示,则该堆积方式的名称是___________ ,若铬原子半径为rpm,阿伏加德罗常数的值为NA,则单质铬的密度为___________ g·cm-3(列出计算式即可)。

(1)基态铬原子价层电子排布图为
(2)在[Cr(H2O)6]3+中,提供孤电子对以形成配位键的元素是
(3)CH3CH2OH的沸点为78.5℃、CH3COOH的沸点为117.9℃,导致这种差异的主要原因是
(4)已知CrO2Cl2与CCl4、CS2等互溶,据此可判断CrO2Cl2分子的空间构型是

(5)已知单质铬的原子的一种堆积方式如图所示,则该堆积方式的名称是

您最近一年使用:0次
解题方法
3 . 空气明朝《天工开物》中有世界上最早的“火法”炼锌技术的记载,锌是生命体必需的微量元素,被称为“生命之花”。(已知阿伏加 德罗常数的值为NA)
(1)基态 原子核外的最高能层符号是
原子核外的最高能层符号是________ ,基态 最外层电子排布式为
最外层电子排布式为________ 。
(2)乳酸锌[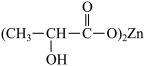 ]是一种很好的食品锌强化剂,其中存在的作用力有
]是一种很好的食品锌强化剂,其中存在的作用力有________ (填编号)。 乳酸锌中含有
乳酸锌中含有________ 个σ键。
A.离子键 B.极性共价键 C.金属键 D.配位键 E.范德华力
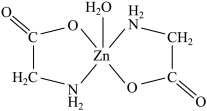
(3)一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图所示。其中所涉及的非金属元素的电负性由大到小的顺序是________ , 分子的空间构型为
分子的空间构型为________ 形, 的配位数为
的配位数为________ 。甘氨酸(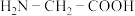 )中N原子的杂化轨道类型为
)中N原子的杂化轨道类型为________ ;甘氨酸易溶于水,试从结构角度解释________ 。
(4)Zn与S形成某种化合物的晶胞如图所示。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。例如图中原子1的坐标为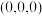 ,则原子2的坐标为
,则原子2的坐标为________ 。
②已知晶体密度为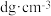 ,
, 半径为
半径为 ,若要使
,若要使 、
、 相切,则
相切,则 半径为
半径为________  (写计算表达式)。
(写计算表达式)。
(1)基态
 原子核外的最高能层符号是
原子核外的最高能层符号是 最外层电子排布式为
最外层电子排布式为(2)乳酸锌[
 ]是一种很好的食品锌强化剂,其中存在的作用力有
]是一种很好的食品锌强化剂,其中存在的作用力有 乳酸锌中含有
乳酸锌中含有A.离子键 B.极性共价键 C.金属键 D.配位键 E.范德华力
(3)一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图所示。其中所涉及的非金属元素的电负性由大到小的顺序是
 分子的空间构型为
分子的空间构型为 的配位数为
的配位数为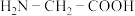 )中N原子的杂化轨道类型为
)中N原子的杂化轨道类型为
(4)Zn与S形成某种化合物的晶胞如图所示。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。例如图中原子1的坐标为
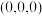 ,则原子2的坐标为
,则原子2的坐标为②已知晶体密度为
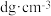 ,
, 半径为
半径为 ,若要使
,若要使 、
、 相切,则
相切,则 半径为
半径为 (写计算表达式)。
(写计算表达式)。
您最近一年使用:0次
2020-07-10更新
|
190次组卷
|
2卷引用:西藏拉萨市2020届高三第二次模拟考试理科综合化学试题
解题方法
4 . 钛是一种性能非常优越的金属,21世纪将是钛的世纪。
(1)TiO2薄膜中掺杂铬能显著提高光催化活性。基态Cr原子的核外电子排布式为____ 。
(2)四乙醇钛能增加橡胶在金属表面的粘附性。其制备原理如下:TiCl4+4CH3CH2OH+4NH3=Ti(OCH2CH3)4+4NH4Cl
①Ti(OCH2CH3)4可溶于有机溶剂,常温下为淡黄色透明液体,其晶体类型为____
②N和O位于同一周期,O的第二电离能大于N的第二电离能的原因是_____ ;
③NH4Cl中存在的作用力有_____ ,NH4Cl熔沸点高于CH3CH2OH的原因是_____ ,Ti(OCH2CH3)4分子中C原子的杂化形式均为 ____ 。
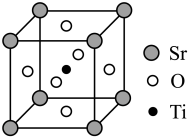
(3)钛酸锶(SrTiO3)可作电子陶瓷材料和人造宝石,其中一种晶胞结构如图所示。若Ti位于顶点位置,O位于____ 位置;已知晶胞参数为a nm,Ti位于O所形成的正八面体的体心,则该八面体的边长为_____ m(列出表达式)。
(1)TiO2薄膜中掺杂铬能显著提高光催化活性。基态Cr原子的核外电子排布式为
(2)四乙醇钛能增加橡胶在金属表面的粘附性。其制备原理如下:TiCl4+4CH3CH2OH+4NH3=Ti(OCH2CH3)4+4NH4Cl
①Ti(OCH2CH3)4可溶于有机溶剂,常温下为淡黄色透明液体,其晶体类型为
②N和O位于同一周期,O的第二电离能大于N的第二电离能的原因是
③NH4Cl中存在的作用力有
(3)钛酸锶(SrTiO3)可作电子陶瓷材料和人造宝石,其中一种晶胞结构如图所示。若Ti位于顶点位置,O位于

您最近一年使用:0次
2020-04-10更新
|
471次组卷
|
5卷引用:西藏自治区昌都市第一高级中学2020届高三下学期第二次模拟考试理综化学试题
名校
解题方法
5 . 数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为___________________ ,第一电离能最小的元素是__________ (填元素符号)。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是___________ (填化学式)。
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为__________ ;另一种的晶胞如图二所示,该晶胞的空间利用率为__________ 。( =1.732)
=1.732)

(4)D元素形成的单质,其晶体的堆积模型为__________ ,D的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是__________ (填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到的现象是______________________________ 。
请写出上述过程的离子方程式:___________________________ ,__________________________ 。
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为
 =1.732)
=1.732)
(4)D元素形成的单质,其晶体的堆积模型为
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到的现象是
请写出上述过程的离子方程式:
您最近一年使用:0次
2019-04-09更新
|
135次组卷
|
3卷引用:西藏自治区拉萨市那曲第二高级中学2020届高三全真模拟联考理综化学试题
名校
6 . N和S是重要的非金属元素,聚氮化硫(SN)x是重要的超导材料,目前已成为全球材料行业研究的热点。回答下列问题:
(1)下列电子排布图能表示氮原子的最低能量状态的是_____ (填字母)。
A.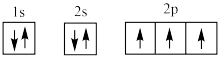 B.
B.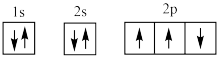
C.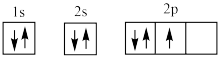 D.
D.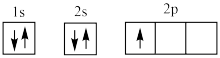
(2)S原子的基态原子核外有____ 个未成对电子,有__________ 种不同形状的电子云。
(3) S、N、O三种元素的第一电离能由大到小的顺序为________ ,列举一种与SCN-互为等电子体的分子为_______ 。
(4) (CH3)3N中N原子杂化方式为_______ ;As与N是同主族元素,AsH3的相对分子质量比NH3大,实验测得AsH3沸点比NH3低,其原因是___________ 。
(5) GaN是一种重要的半导体材料,其晶胞结构和金刚石类似,其晶胞结构如图。
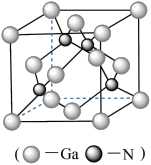
①氮化镓中氮原子与镓原子之间以_______ 键相结合,与同一个Ga原子相连的N原子构成的空间构型为_______ 。
②GaN晶体的晶胞边长为a pm,摩尔质量为M g/mol,阿佛伽德罗常数的值为NA,则GaN晶体的密度为_______ g•cm-3 (只要求列算式,不必计算出结果,1pm=l0-12m)。
(1)下列电子排布图能表示氮原子的最低能量状态的是
A.
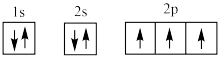 B.
B.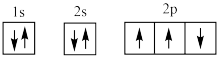
C.
 D.
D.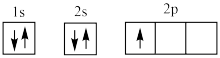
(2)S原子的基态原子核外有
(3) S、N、O三种元素的第一电离能由大到小的顺序为
(4) (CH3)3N中N原子杂化方式为
(5) GaN是一种重要的半导体材料,其晶胞结构和金刚石类似,其晶胞结构如图。

①氮化镓中氮原子与镓原子之间以
②GaN晶体的晶胞边长为a pm,摩尔质量为M g/mol,阿佛伽德罗常数的值为NA,则GaN晶体的密度为
您最近一年使用:0次
2019-04-03更新
|
670次组卷
|
4卷引用:西藏日喀则市上海实验学校2020-2021学年高三下学期第二次模拟考试理综化学试题
名校
解题方法
7 . 太阳能电池可分为:硅太阳能电池,化合物太阳能电池,如砷化镓(GaAs)、铜铟镓硒(CIGS)、硫化镉(CdS),功能高分子太阳能电池等,Al-Ni常作电极。据此回答问题:
(1)镍(Ni)在周期表中的位置为______ ;S原子的价电子排布式为________ ;Ga、As和Se的第一电离能由大到小的顺序是________ 。
(2)Na3As3中As原子的杂化方式为_____ ;AsCl3的空间构型为____ 。
(3)GaAs熔点为1238℃,GaN熔点约为1500°,GaAs熔点低于GaN的原因为__________ 。
(4)写出一种与SO42-互为等电子体的分子_________ 。
(5)GaAs的晶胞结构如图所示,其中As原子形成的空隙类型有正八面体形和正四面体形,该晶胞中Ga原子所处空隙类型为_____ 。已知GaAs的密度为ρg/cm3,Ga和As的摩尔质量分别为 MGa g/mol和MAsg/mol,则GaAs晶胞中Ga之间的最短距离为________ pm。
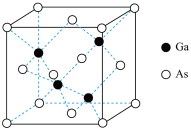
(1)镍(Ni)在周期表中的位置为
(2)Na3As3中As原子的杂化方式为
(3)GaAs熔点为1238℃,GaN熔点约为1500°,GaAs熔点低于GaN的原因为
(4)写出一种与SO42-互为等电子体的分子
(5)GaAs的晶胞结构如图所示,其中As原子形成的空隙类型有正八面体形和正四面体形,该晶胞中Ga原子所处空隙类型为

您最近一年使用:0次
2019-03-16更新
|
975次组卷
|
4卷引用:西藏山南市三校2019届高三5月模拟考试理综化学试题
名校
8 . 铝广泛应用于航空、建筑、汽车等行业,目前工业上采用电解氧化铝和冰晶石混合物的方法制取铝。回答下列问题:
(1)某同学写出了铝原子的4种不同状态的电子排布图:
A.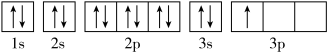
B.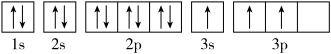
C.
D.
其中能量最低的是____ (填字母),电子由状态C到状态B所得原子光谱为____ 光谱(填“发射”或“吸收”) ,状态D是铝的某种激发态,但该电子排布图有错误,主要是不符合_____ 。
(2)熔融态氯化铝可挥发出二聚分子Al2Cl6,其结构如图所示。
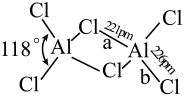
①a键的键能_____ b键的键能(填“>”“<”或“=”),其理由是_______ 。
②Al2Cl6中铝原子的杂化方式为___ ;AlCl3的空间结构为______ 。
(3)冰晶石属于离子化合物,由Na+和AlF63−组成,在冰晶石的晶胞中,AlF63−占据的位置相当于氯化钠晶胞中Cl−的位置。
①冰晶石的化学式为_____ ,一个冰晶石晶胞中Na+的个数为_____ 。
②已知冰晶石的密度为2.95 g/cm3,则冰晶石晶胞的边长a=____ pm(列出算式即可,阿伏伽德罗常数值为6.02×1023)。
(1)某同学写出了铝原子的4种不同状态的电子排布图:
A.

B.

C.

D.

其中能量最低的是
(2)熔融态氯化铝可挥发出二聚分子Al2Cl6,其结构如图所示。

①a键的键能
②Al2Cl6中铝原子的杂化方式为
(3)冰晶石属于离子化合物,由Na+和AlF63−组成,在冰晶石的晶胞中,AlF63−占据的位置相当于氯化钠晶胞中Cl−的位置。
①冰晶石的化学式为
②已知冰晶石的密度为2.95 g/cm3,则冰晶石晶胞的边长a=
您最近一年使用:0次
2019-02-12更新
|
956次组卷
|
6卷引用:西藏自治区昌都市第一高级中学2020届高三下学期第一次模拟考试理综化学试题
名校
9 . 硫和碳及其化合物广泛存在于自然界中,并被人们广泛利用。回答下列问题:
(1)当基态原子的电子吸收能量后,电子会发生____ ,某处于激发态的S原子,其中1个3s电子跃迁到3p轨道中,该激发态S原子的核外电子排布式为__________ 。硫所在周期中,第一电离能最大的元素是___________ 。(填元素符号)
(2)写出一个与CO2具有相同空间结构和键合形式的分子的电子式__________________ 。
(3)H2S中S原子的杂化类型是__________ ;H2S的VSEPR模型名称为_________ ;H2S的键角约为94°,H2O的键角为105°,其原因是___________________________ 。
(4)科学家通过X射线推测胆矾结构示意图1如下:


其中含有________ 个配位键,___________ 个氢键。
(5)已知Zn和Hg同属IIB族元素,火山喷出的岩浆是一种复杂的混合物,冷却时,许多矿物相继析出,其中所含的ZnS矿物先于HgS矿物析出,原因是_________________________________ 。
(6)碳的另一种同素异形体—石墨,其晶体结构如上图2所示,虚线勾勒出的是其晶胞。则石墨晶胞含碳原子个数为____ 个,已知石墨的密度为pg·cm-1,C-C键长为rcm,阿伏伽德罗常数的值为NA,计算石墨晶体的层间距为____ cm。
(1)当基态原子的电子吸收能量后,电子会发生
(2)写出一个与CO2具有相同空间结构和键合形式的分子的电子式
(3)H2S中S原子的杂化类型是
(4)科学家通过X射线推测胆矾结构示意图1如下:


其中含有
(5)已知Zn和Hg同属IIB族元素,火山喷出的岩浆是一种复杂的混合物,冷却时,许多矿物相继析出,其中所含的ZnS矿物先于HgS矿物析出,原因是
(6)碳的另一种同素异形体—石墨,其晶体结构如上图2所示,虚线勾勒出的是其晶胞。则石墨晶胞含碳原子个数为
您最近一年使用:0次
2017-05-10更新
|
1410次组卷
|
3卷引用:西藏山南地区第二高级中学2017届高三第三次模拟考试理综化学试题



