解题方法
1 . 碳(C)、氮(N)、氧(O)、硫(S)等是常见的非金属元素,钴(Co)是一种重要的金属元素,回答下列问题:
(1)一种由含钴的配合物形成的新型高能材料的结构如图所示。

①阴离子 是该材料的组成部分,则1mol该阴离子中含σ键的数目为
是该材料的组成部分,则1mol该阴离子中含σ键的数目为_______ (NA为阿伏加德罗常数的值),已知该离子是平面结构,则图中标记*的N和O原子之间的σ键是由N原子的_______ 杂化轨道与O原子的_______ 轨道重叠形成。
②写出一种与 互为等电子体的分子:
互为等电子体的分子:_______ (填化学式)。
③实验证明NH3的极性比NCl3大,其原因是_______ 。
(2)一种新型环烯类储氢材料分子式为C16S8,分子中的原子都处于同平面上(结构如图所示),每个平面上下两侧最多可储存10个H2分子。

①有关键长数据如下:
从表中数据可以推测C16S8中碳硫键的性质为_______ (填字母)。
A.类似于C-S单键的性质
B.类似于C=S双键的性质
C.兼有C-S单键和C=S双键的性质
②储氢时,C16S8与H2间的作用力是_______ 。
(3) 和NH3是配合物
和NH3是配合物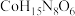 的配体,若该配合物的中心离子的价电子层有4个未成对电子,则其配位数为6的正二价配离子化学式为
的配体,若该配合物的中心离子的价电子层有4个未成对电子,则其配位数为6的正二价配离子化学式为_______ 。
(4)CoO2是一种磁性材料,其晶胞结构如图甲所示,俯视图如图乙所示。

①原子坐标参数:A为(0,0,0);B为(0.31,0.31,0),则C原子的坐标参数为_______ 。
②若阿伏加德罗常数的值为NA,则该晶体密度为_______  (列出计算表达式)。
(列出计算表达式)。
(1)一种由含钴的配合物形成的新型高能材料的结构如图所示。

①阴离子
 是该材料的组成部分,则1mol该阴离子中含σ键的数目为
是该材料的组成部分,则1mol该阴离子中含σ键的数目为②写出一种与
 互为等电子体的分子:
互为等电子体的分子:③实验证明NH3的极性比NCl3大,其原因是
(2)一种新型环烯类储氢材料分子式为C16S8,分子中的原子都处于同平面上(结构如图所示),每个平面上下两侧最多可储存10个H2分子。

①有关键长数据如下:
| 化学键 | C-S | C=S | C16S8 |
| 键长/pm | 181 | 155 | 176 |
从表中数据可以推测C16S8中碳硫键的性质为
A.类似于C-S单键的性质
B.类似于C=S双键的性质
C.兼有C-S单键和C=S双键的性质
②储氢时,C16S8与H2间的作用力是
(3)
 和NH3是配合物
和NH3是配合物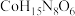 的配体,若该配合物的中心离子的价电子层有4个未成对电子,则其配位数为6的正二价配离子化学式为
的配体,若该配合物的中心离子的价电子层有4个未成对电子,则其配位数为6的正二价配离子化学式为(4)CoO2是一种磁性材料,其晶胞结构如图甲所示,俯视图如图乙所示。

①原子坐标参数:A为(0,0,0);B为(0.31,0.31,0),则C原子的坐标参数为
②若阿伏加德罗常数的值为NA,则该晶体密度为
 (列出计算表达式)。
(列出计算表达式)。
您最近一年使用:0次
2 . 如表为四种短周期元素的相关信息
回答下列问题(注:涉及元素的均要用对应元素的元素符号书写作答)
(1)Y元素的最简单氢化物的空间构型是___ 。
(2)Z、Q、R相比,其原子半径由大到小的顺序是___ 。
(3)最高价的R与Z元素组成的化合物中R原子的杂化方式为___ ,其中R在周期表中的位置是__ ,R的基态原子电子排布式为___ 。
(4)与O3分子互为等电子体的一种分子为___ ,阴离子为__ 。
(5)Y与R相比,非金属性较强的是___ ,能证明这一结论的事实是___ 。(用化学方程式表示)
| 元素 | 元素的相关信息 |
| Y | 原子最外层电子数是次外层电子数的2倍 |
| Z | 地壳中含量最多的元素 |
| Q | 短周期中金属性最强 |
| R | 常温下,R的单质是淡黄色固体,常在火山喷口附近沉积 |
(1)Y元素的最简单氢化物的空间构型是
(2)Z、Q、R相比,其原子半径由大到小的顺序是
(3)最高价的R与Z元素组成的化合物中R原子的杂化方式为
(4)与O3分子互为等电子体的一种分子为
(5)Y与R相比,非金属性较强的是
您最近一年使用:0次
名校
3 . 请回答下列问题:
(1)非金属氟化物在生产、生活和科研中应用广泛。OF2分子的空间结构为___________ ;OF2的熔、沸点___________ (填“高于”或“低于”)Cl2O,原因是___________ 。
(2)很多含巯基(—SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物II。___________ 。
②化合物III也是一种汞解毒剂。化合物IV是一种强酸。下列说法正确的有___________ 。
A.在I中S原子采取sp3杂化
B.在II中S元素的电负性最大
C.在III中C—C—C键角是180°
D.在III中存在离子键与共价键
E.在IV中硫氧键的键能均相等
(3)硅和卤素单质反应可以得到SiX4.SiX4的熔、沸点如下表:
①0℃时,SiF4、SiCl4、SiBr4、SiI4呈液态的是___________ (填化学式),气态SiX4分子的空间结构是___________ 。___________ ,H、C、N的电负性由大到小的顺序为___________ ,1个M2+中含有___________ 个σ键。
(1)非金属氟化物在生产、生活和科研中应用广泛。OF2分子的空间结构为
(2)很多含巯基(—SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物II。
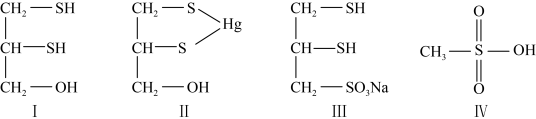
②化合物III也是一种汞解毒剂。化合物IV是一种强酸。下列说法正确的有
A.在I中S原子采取sp3杂化
B.在II中S元素的电负性最大
C.在III中C—C—C键角是180°
D.在III中存在离子键与共价键
E.在IV中硫氧键的键能均相等
(3)硅和卤素单质反应可以得到SiX4.SiX4的熔、沸点如下表:
| SiF4 | SiCl4 | SiBr4 | SiI4 | |
| 熔点/K | 183.0 | 203.2 | 278.6 | 393.7 |
| 沸点/K | 187.2 | 330.8 | 427.2 | 560.7 |
②SiCl4与N甲基咪唑(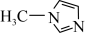 )反应可以得到M2+,其结构如图所示:
)反应可以得到M2+,其结构如图所示:
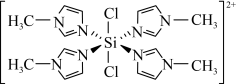
您最近一年使用:0次
名校
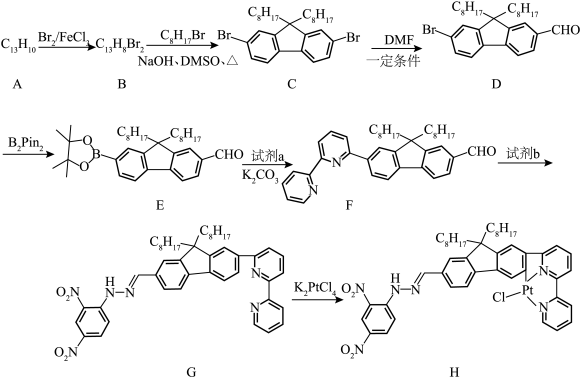
4 . 二联吡啶铂(Ⅱ)配合物(H)在传感器中有重要应用,一种合成路线如图。回答下列问题: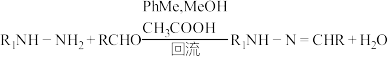
(1)有机物 的官能团的名称为
的官能团的名称为__________ 。
(2)写出 的反应方程式:
的反应方程式:______________ ,该反应的反应类型为__________ 。
(3)试剂 的结构简式为
的结构简式为__________ 。
(4)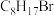 的同分异构体有多种,其中含有两个甲基的结构有
的同分异构体有多种,其中含有两个甲基的结构有__________ 种。
(5)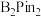 的结构为
的结构为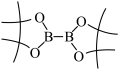 ,可由频哪醇(
,可由频哪醇(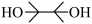 )和四(二甲氨基)二硼合成制得,频哪醇在浓硫酸作用下,加热,可制得分子式为
)和四(二甲氨基)二硼合成制得,频哪醇在浓硫酸作用下,加热,可制得分子式为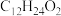 的物质,写出其结构:
的物质,写出其结构:__________ 。
(6)请从物质结构角度分析有机物 能与
能与 反应的原因:
反应的原因:______________ 。
(7)下列关于有机物 的说法错误的是__________(填标号)。
的说法错误的是__________(填标号)。
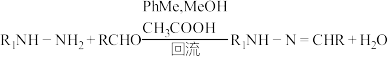
(1)有机物
 的官能团的名称为
的官能团的名称为(2)写出
 的反应方程式:
的反应方程式:(3)试剂
 的结构简式为
的结构简式为(4)
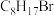 的同分异构体有多种,其中含有两个甲基的结构有
的同分异构体有多种,其中含有两个甲基的结构有(5)
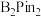 的结构为
的结构为 ,可由频哪醇(
,可由频哪醇( )和四(二甲氨基)二硼合成制得,频哪醇在浓硫酸作用下,加热,可制得分子式为
)和四(二甲氨基)二硼合成制得,频哪醇在浓硫酸作用下,加热,可制得分子式为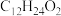 的物质,写出其结构:
的物质,写出其结构:(6)请从物质结构角度分析有机物
 能与
能与 反应的原因:
反应的原因:(7)下列关于有机物
 的说法错误的是__________(填标号)。
的说法错误的是__________(填标号)。A. 的配位数为4 的配位数为4 | B.含有手性碳原子 |
C. 原子的杂化方式为 原子的杂化方式为 | D.存在由 轨道“头碰头”形成的 轨道“头碰头”形成的 键 键 |
您最近一年使用:0次
2024-05-30更新
|
176次组卷
|
4卷引用:河北省保定市九校2024届高三下学期二模化学试题
名校
5 . 2023年8月1日起,我国对镓(Ga)等相关物项实施出口管制。Ga与B、A1位于同一主族。回答下列问题:
(1)写出基态Ga原子的价电子排布图:_______ 。
(2)硼的氢化物叫硼烷 ,如
,如 (乙硼烷-6)、
(乙硼烷-6)、 (丁硼烷-10)等。
(丁硼烷-10)等。
①下列说法错误的是_______ 。
A.B原子由 需吸收能量
需吸收能量
B. 的结构式:
的结构式:
C.同周期相邻元素的电负性大小:
D. 与
与 反应生成
反应生成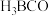 ,
,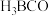 分子中
分子中 键与
键与 键数目之比为
键数目之比为
② 极易发生水解生成
极易发生水解生成 和
和 ,请写出反应的化学方程式:
,请写出反应的化学方程式:_______ 。
(3)氮和硼形成的化合物 ,通常存在石墨型与金刚石型两种结构,可发生转化:
,通常存在石墨型与金刚石型两种结构,可发生转化: (石墨型)
(石墨型) (金刚石型)。石墨型与金刚石型两类化合物中B原子的杂化方式依次为
(金刚石型)。石墨型与金刚石型两类化合物中B原子的杂化方式依次为_______ ;金刚石型的 的硬度大于金刚石,原因是
的硬度大于金刚石,原因是_______ 。
(4)近年来,人们发现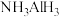 可与多种小分子氢化物形成双氢键。双氢键是指带正电的H原子与带负电的H原子之间的一种弱电性相互作用,其结构可用如图表示。
可与多种小分子氢化物形成双氢键。双氢键是指带正电的H原子与带负电的H原子之间的一种弱电性相互作用,其结构可用如图表示。
根据上述信息,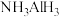 与
与 形成的双氢键可表示为
形成的双氢键可表示为_______ 。
(5)广义酸碱理论认为,中心原子可以接受电子对的分子为酸,可以提供电子对的分子为碱。按照该理论, 属于
属于_______ (填“酸”或“碱”)。下列物质均能与 发生配位反应,其中形成
发生配位反应,其中形成 键最强的是
键最强的是_______ (填字母)。
A.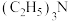 B.
B. C.
C.
(6)太阳能材料 晶体为四方晶系,其晶胞参数及结构如图所示,晶胞棱边夹角均为90°。已知:A处In原子坐标为
晶体为四方晶系,其晶胞参数及结构如图所示,晶胞棱边夹角均为90°。已知:A处In原子坐标为 ,B处Cu原子坐标为
,B处Cu原子坐标为 。
。

设阿伏加德罗常数的值为 ,则该晶体密度为
,则该晶体密度为_______  。
。
(1)写出基态Ga原子的价电子排布图:
(2)硼的氢化物叫硼烷
 ,如
,如 (乙硼烷-6)、
(乙硼烷-6)、 (丁硼烷-10)等。
(丁硼烷-10)等。①下列说法错误的是
A.B原子由
 需吸收能量
需吸收能量B.
 的结构式:
的结构式:
C.同周期相邻元素的电负性大小:

D.
 与
与 反应生成
反应生成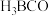 ,
,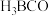 分子中
分子中 键与
键与 键数目之比为
键数目之比为
②
 极易发生水解生成
极易发生水解生成 和
和 ,请写出反应的化学方程式:
,请写出反应的化学方程式:(3)氮和硼形成的化合物
 ,通常存在石墨型与金刚石型两种结构,可发生转化:
,通常存在石墨型与金刚石型两种结构,可发生转化: (石墨型)
(石墨型) (金刚石型)。石墨型与金刚石型两类化合物中B原子的杂化方式依次为
(金刚石型)。石墨型与金刚石型两类化合物中B原子的杂化方式依次为 的硬度大于金刚石,原因是
的硬度大于金刚石,原因是(4)近年来,人们发现
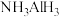 可与多种小分子氢化物形成双氢键。双氢键是指带正电的H原子与带负电的H原子之间的一种弱电性相互作用,其结构可用如图表示。
可与多种小分子氢化物形成双氢键。双氢键是指带正电的H原子与带负电的H原子之间的一种弱电性相互作用,其结构可用如图表示。 (“—”表示共价键,“…”表示形成的双氢键) (“—”表示共价键,“…”表示形成的双氢键) |
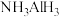 与
与 形成的双氢键可表示为
形成的双氢键可表示为(5)广义酸碱理论认为,中心原子可以接受电子对的分子为酸,可以提供电子对的分子为碱。按照该理论,
 属于
属于 发生配位反应,其中形成
发生配位反应,其中形成 键最强的是
键最强的是A.
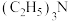 B.
B. C.
C.
(6)太阳能材料
 晶体为四方晶系,其晶胞参数及结构如图所示,晶胞棱边夹角均为90°。已知:A处In原子坐标为
晶体为四方晶系,其晶胞参数及结构如图所示,晶胞棱边夹角均为90°。已知:A处In原子坐标为 ,B处Cu原子坐标为
,B处Cu原子坐标为 。
。
设阿伏加德罗常数的值为
 ,则该晶体密度为
,则该晶体密度为 。
。
您最近一年使用:0次
名校
解题方法
6 . Ⅰ、由CO2、甲醇为原料合成绿色化学品碳酸二甲酯(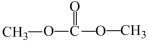 )的过程如图,请回答下列问题:
)的过程如图,请回答下列问题:
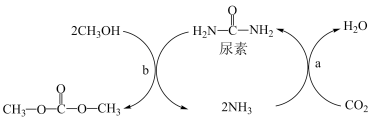
(1)下列说法不正确的是___________ (填字母)。
A.上述过程a中,从反应物到产物,C和N元素的杂化方式均保持不变
B.NH3极易溶解在水中,只因氨分子与水分子间形成了氢键
C.尿素的沸点比碳酸二甲酯的高,主要原因为前者能形成分子间氢键,而后者不能形成分子间氢键
Ⅱ、硫元素在化合物中常表现出多种化合价,它的许多化合物在研究和生产中有许多重要用途。回答下列问题:
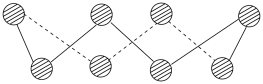
(2)S单质的常见形式为S8,其环状结构如图所示,S原子的杂化轨道类型是___________ 。
(3) 的电子式是
的电子式是___________ ,依据 理论推测
理论推测 的空间构型为
的空间构型为___________ ,常温下 是气体而
是气体而 是液体的原因是
是液体的原因是___________ 。
(4) 的键角
的键角___________  的键角(填“大于”或“小于”),理由是
的键角(填“大于”或“小于”),理由是___________ 。
(5) 在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方
在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方 晶体结构如图所示。
晶体结构如图所示。
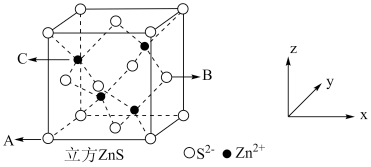
①已知A、B点的原子坐标分别为 和
和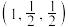 ,则C点的原子坐标为
,则C点的原子坐标为___________ ;
②若晶胞棱长为 ,密度为
,密度为___________  (
( 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
 )的过程如图,请回答下列问题:
)的过程如图,请回答下列问题:
(1)下列说法不正确的是
A.上述过程a中,从反应物到产物,C和N元素的杂化方式均保持不变
B.NH3极易溶解在水中,只因氨分子与水分子间形成了氢键
C.尿素的沸点比碳酸二甲酯的高,主要原因为前者能形成分子间氢键,而后者不能形成分子间氢键
Ⅱ、硫元素在化合物中常表现出多种化合价,它的许多化合物在研究和生产中有许多重要用途。回答下列问题:
(2)S单质的常见形式为S8,其环状结构如图所示,S原子的杂化轨道类型是

(3)
 的电子式是
的电子式是 理论推测
理论推测 的空间构型为
的空间构型为 是气体而
是气体而 是液体的原因是
是液体的原因是(4)
 的键角
的键角 的键角(填“大于”或“小于”),理由是
的键角(填“大于”或“小于”),理由是(5)
 在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方
在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方 晶体结构如图所示。
晶体结构如图所示。
①已知A、B点的原子坐标分别为
 和
和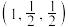 ,则C点的原子坐标为
,则C点的原子坐标为②若晶胞棱长为
 ,密度为
,密度为 (
( 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
您最近一年使用:0次
2022-09-05更新
|
351次组卷
|
6卷引用:河北省昌黎第一中学2023届高三下学期第五次调研考试化学试题
解题方法
7 . 氧化锌在液晶显示器、薄膜晶体管、发光二极管等产品中均有应用,常用下列三种锌盐为原料经高温分解制备。

回答下列问题:
(1)Zn位于元素周期表_______ 区,下列状态的Zn能产生发射光谱的是_______ 。
A.[Ar]3d104s2 B.[Ar]3d104s14p1 C.[Ar]3d104s1 D.[Ar]3d10
(2)原料Ⅰ中阴离子空间结构为_______ ,其等电子体为 _______ (写出1种即可)。
(3)原料Ⅱ、Ⅲ阴离子对应的酸沸点较高的是_______ (写结构简式),原因是 _______ 。
(4)关于以上几种锌盐说法正确的是 _______。
(5)ZnO存在多种晶体结构,其中纤锌矿型和闪锌矿型是最常见的晶体结构,下图为这两种晶体的局部结构。

①图a是否为纤锌矿型ZnO的晶胞单元,_______ (填“是”或者“否”)。
②图b闪锌矿型属于立方晶胞,原子1的坐标为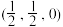 ,则原子2的坐标为
,则原子2的坐标为 _______ 。
③图b的闪锌矿型晶胞参数为anm,阿伏加德罗常数的值为NA,则晶体密度为_______ g/cm3(列出计算式)。

回答下列问题:
(1)Zn位于元素周期表
A.[Ar]3d104s2 B.[Ar]3d104s14p1 C.[Ar]3d104s1 D.[Ar]3d10
(2)原料Ⅰ中阴离子空间结构为
(3)原料Ⅱ、Ⅲ阴离子对应的酸沸点较高的是
(4)关于以上几种锌盐说法正确的是 _______。
| A.化合物Ⅱ中电负性最大的元素是O | B.化合物Ⅱ中所有C原子的杂化形式均为sp3 |
| C.化合物Ⅲ中只存在离子键和极性共价键 | D.化合物I阴离子中存在大 键 键 |

①图a是否为纤锌矿型ZnO的晶胞单元,
②图b闪锌矿型属于立方晶胞,原子1的坐标为
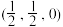 ,则原子2的坐标为
,则原子2的坐标为 ③图b的闪锌矿型晶胞参数为anm,阿伏加德罗常数的值为NA,则晶体密度为
您最近一年使用:0次
名校
解题方法
8 . 磷及其化合物在电池、催化等领域有重要应用。黑磷与石墨类似,也具有层状结构(图1)。 为大幅度提高锂电池的充电速率,科学家最近研发了黑磷-石墨复合负极材料,其单层结构俯视图如图2所示。
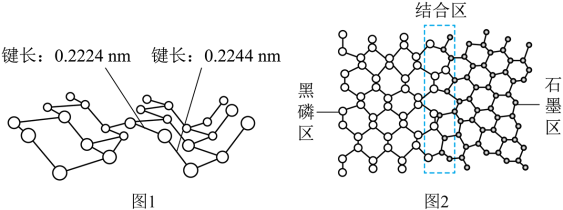
回答下列问题:
(1)Li、C、P三种元素中,电负性最小的是_________________ (用元素符号作答)。
(2)基态磷原子价电子排布式为________________ 。
(3)图2黑磷区中P原子的杂化方式为_________________ ,石墨区中C原子的杂化方式为____________ 。
(4)氢化物PH3、CH4、NH3的沸点由高到低顺序为________________ 。
(5)根据图1和图2的信息,下列说法正确的有________ (填字母)。
A. 黑磷区中P-P键的键能不完全相同
B. 黑磷与石墨都属于混合型晶体
C. 由石墨与黑磷制备该复合材料的过程,发生了化学反应
D. 石墨与黑磷的交界结合区域中,P原子与C原子共平面
E. 复合材料单层中,P原子与C原子之间的作用力属范德华力
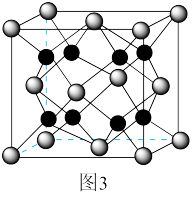
(6)贵金属磷化物Rh2P (化学式量为237)可用作电解水的高效催化剂,其立方晶胞如图3所示。已知晶胞参数为anm,晶体中与P距离最近的Rh的数目为___________________ , 晶体的密度为__________ g·cm-3(列出计算式)。

回答下列问题:
(1)Li、C、P三种元素中,电负性最小的是
(2)基态磷原子价电子排布式为
(3)图2黑磷区中P原子的杂化方式为
(4)氢化物PH3、CH4、NH3的沸点由高到低顺序为
(5)根据图1和图2的信息,下列说法正确的有
A. 黑磷区中P-P键的键能不完全相同
B. 黑磷与石墨都属于混合型晶体
C. 由石墨与黑磷制备该复合材料的过程,发生了化学反应
D. 石墨与黑磷的交界结合区域中,P原子与C原子共平面
E. 复合材料单层中,P原子与C原子之间的作用力属范德华力
(6)贵金属磷化物Rh2P (化学式量为237)可用作电解水的高效催化剂,其立方晶胞如图3所示。已知晶胞参数为anm,晶体中与P距离最近的Rh的数目为

您最近一年使用:0次
2021-05-28更新
|
735次组卷
|
9卷引用:河北省石家庄市第二十四中学2020-2021学年高二第二学期期中考试化学试题
河北省石家庄市第二十四中学2020-2021学年高二第二学期期中考试化学试题广东省2021年普通高中学业水平选择考适应性测试化学试题(已下线)难点10 物质结构与性质综合题-2021年高考化学【热点·重点·难点】专练(新高考)湖南省长沙市第一中学2021-2022学年高三上学期月考化学试题(已下线)3.3.2 过渡晶体和混合型晶体-2021-2022学年高二化学课后培优练(人教版2019选择性必修2)广东省深圳外国语学校2021-2022学年下学期高三第二次检测考试化学试题(已下线)专题19 物质结构与性质-2022年高考化学二轮复习重点专题常考点突破练湖南省株洲市攸县第一中学2022届高三下学期四月月考化学试题广东省惠州市惠州中学2022-2023学年高二下学期化学考试题
解题方法
9 . 碳、氮及其化合物广泛存在于自然界中,回答下列问题:
(1)科学家已证实,存在一种空心且类似于足球结构的物质N60,它可能成为一种很好的火箭燃料。固态N60的晶体类型为_______ 。
(2)氰酸是一种无机物,化学式为HCNO,是一种具有挥发性和腐蚀性的液体,高毒。HCNO的组成元素中第一电离能最小的是_______ (填元素符号,下同),电负性最大的是_______ 。
(3)镍能形成多种配合物,如正四面体形的Ni(CO)4,、正方形的 和正八面体形的
和正八面体形的 。下列说法不正确的是
。下列说法不正确的是_______ (填标号)。
A. CO分子内σ键和π键的数目之比为1:2
B. NH3的空间构型为平面三角形
C. Ni2+在形成配合物时,其配位数可能为4或6
D. Ni(CO)4和 中,镍元素均是sp3杂化
中,镍元素均是sp3杂化
(4)化合物(CH3)3N能溶于水,其原因是_______ ,(CH3)3N与盐酸反应生成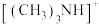 ,
,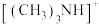 中新生成的化学键的类型为
中新生成的化学键的类型为_______ 。
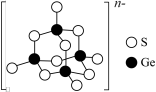
(5)阳离子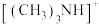 和阴离子A按个数比4:1组成化合物,阴离子A的结构如图所示,则S原子的杂化轨道类型是
和阴离子A按个数比4:1组成化合物,阴离子A的结构如图所示,则S原子的杂化轨道类型是_______ ,阴离子A的化学式为_______ 。
(6)某碳单质的晶胞结构如图所示,回答下列问题:

①该晶胞中含_______ 个C原子。
②将每个C原子视为一个球,若C原子的半径为R,1个C原子的体积为V,1个晶胞的体积为V0,堆积系数 ,则该晶体的堆积系数
,则该晶体的堆积系数
_______ (保留1位有效数字,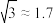 ,
, )。(提示:图中箭头标记的两个原子是相切的,两个原子球心分别位于立方体晶胞顶点和立方体晶胞体对角线的四等分点)
)。(提示:图中箭头标记的两个原子是相切的,两个原子球心分别位于立方体晶胞顶点和立方体晶胞体对角线的四等分点)
(1)科学家已证实,存在一种空心且类似于足球结构的物质N60,它可能成为一种很好的火箭燃料。固态N60的晶体类型为
(2)氰酸是一种无机物,化学式为HCNO,是一种具有挥发性和腐蚀性的液体,高毒。HCNO的组成元素中第一电离能最小的是
(3)镍能形成多种配合物,如正四面体形的Ni(CO)4,、正方形的
 和正八面体形的
和正八面体形的 。下列说法不正确的是
。下列说法不正确的是A. CO分子内σ键和π键的数目之比为1:2
B. NH3的空间构型为平面三角形
C. Ni2+在形成配合物时,其配位数可能为4或6
D. Ni(CO)4和
 中,镍元素均是sp3杂化
中,镍元素均是sp3杂化(4)化合物(CH3)3N能溶于水,其原因是
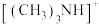 ,
,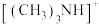 中新生成的化学键的类型为
中新生成的化学键的类型为(5)阳离子
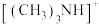 和阴离子A按个数比4:1组成化合物,阴离子A的结构如图所示,则S原子的杂化轨道类型是
和阴离子A按个数比4:1组成化合物,阴离子A的结构如图所示,则S原子的杂化轨道类型是
(6)某碳单质的晶胞结构如图所示,回答下列问题:

①该晶胞中含
②将每个C原子视为一个球,若C原子的半径为R,1个C原子的体积为V,1个晶胞的体积为V0,堆积系数
 ,则该晶体的堆积系数
,则该晶体的堆积系数
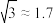 ,
, )。(提示:图中箭头标记的两个原子是相切的,两个原子球心分别位于立方体晶胞顶点和立方体晶胞体对角线的四等分点)
)。(提示:图中箭头标记的两个原子是相切的,两个原子球心分别位于立方体晶胞顶点和立方体晶胞体对角线的四等分点)
您最近一年使用:0次
2021-07-15更新
|
150次组卷
|
2卷引用:河北省部分名校2020-2021学年高二下学期期末联考化学试题
名校
10 . 世上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用M代表)是我国研制出来的。
(1)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量为第一电子亲和能(E1),下列说法错误的是___________ 。(填标号)
A.E1:C<O<F
B.沸点: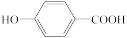 <
< 
C.甲醛中碳氢键间夹角小于苯中的键角
D.尿素CO(NH2)2中碳原子和氮原子均为sp2杂化
(2)M晶体的部分结构如下图。

①关于M中两阳离子的叙述正确的为___________ 。(填标号)
A.中心原子的杂化类型不同 B.中心原子的价层电子对数不同
C.立体结构相同 D.化学键类型相同
E.键角H3O+更大 F.H3O+中键的极性更大
②分子(或离子)中大π键可表示为π ,右下角m为参与形成大π键的原子数,右上角n为参与形成大π键的电子数(如苯中m=6,n=6),将M中阴离子N
,右下角m为参与形成大π键的原子数,右上角n为参与形成大π键的电子数(如苯中m=6,n=6),将M中阴离子N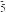 的大π键表示成π
的大π键表示成π ,则m+n的数值为
,则m+n的数值为___________ 。
(3)SO 的空间构型是
的空间构型是___________ ,请写出一种与它互为等电子体的分子___________ 。
(4)(CN)2分子为对称拟卤素,某些化学性质与卤素相似,其电子式为___________ ,中心原子的杂化方式为___________ 。
(5)氨水中存在氢键,请写出一水合氨分子最有可能的结构式:___________ 。
(6)1 mol 1,4-环己二烯 中σ键的个数为
中σ键的个数为___________ 。
(1)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量为第一电子亲和能(E1),下列说法错误的是
A.E1:C<O<F
B.沸点:
 <
< 
C.甲醛中碳氢键间夹角小于苯中的键角
D.尿素CO(NH2)2中碳原子和氮原子均为sp2杂化
(2)M晶体的部分结构如下图。

①关于M中两阳离子的叙述正确的为
A.中心原子的杂化类型不同 B.中心原子的价层电子对数不同
C.立体结构相同 D.化学键类型相同
E.键角H3O+更大 F.H3O+中键的极性更大
②分子(或离子)中大π键可表示为π
 ,右下角m为参与形成大π键的原子数,右上角n为参与形成大π键的电子数(如苯中m=6,n=6),将M中阴离子N
,右下角m为参与形成大π键的原子数,右上角n为参与形成大π键的电子数(如苯中m=6,n=6),将M中阴离子N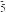 的大π键表示成π
的大π键表示成π ,则m+n的数值为
,则m+n的数值为(3)SO
 的空间构型是
的空间构型是(4)(CN)2分子为对称拟卤素,某些化学性质与卤素相似,其电子式为
(5)氨水中存在氢键,请写出一水合氨分子最有可能的结构式:
(6)1 mol 1,4-环己二烯
 中σ键的个数为
中σ键的个数为
您最近一年使用:0次



