名校
1 . 苯、甲苯,乙苯、二甲苯等均是重要的芳香族化合物。回答下列问题:
(1)苯的实验式为___________ 。
(2)1mol苯与3molH2发生加成反应,碳的杂化类型由___________ ,转化为___________ 。
(3)甲苯的一氯代物有___________ 种,由甲苯制备2,4,6-三硝基甲苯(TNT)的化学方程式为___________ 。
(4)向对二甲苯中加入足量酸性高锰酸钾溶液,生成的有机物中的官能团名称___________ 。
(5)如图是某同学设计的制取少量溴苯(熔点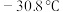 ,沸点
,沸点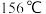 )的装置。实验时,打开K,向圆底烧瓶中滴加苯和溴的混合液,发现a中有微沸现象,b中的液体逐渐变为浅红色,c中有少量气泡产生,反应结束后,对a中的液体进行后续处理即可获得溴苯。
)的装置。实验时,打开K,向圆底烧瓶中滴加苯和溴的混合液,发现a中有微沸现象,b中的液体逐渐变为浅红色,c中有少量气泡产生,反应结束后,对a中的液体进行后续处理即可获得溴苯。___________ 。
②该实验___________ (填“放热”或“吸热”)。
③c中看到的现象证明___________ 。
④得到粗溴苯后,用如下操作进行精制:
①水洗 ②蒸馏 ③用干燥剂干燥 ④10%NaOH溶液洗
正确的操作顺序是___________ (填序号)。
A.①②③④② B.②④②③① C.④①③①② D.①④①③②
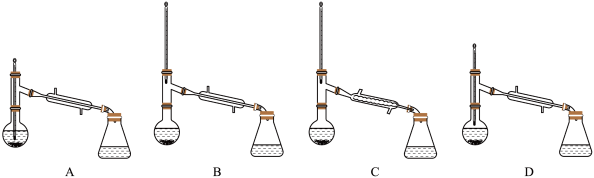
⑤进行蒸馏操作中,仪器选择及安装(夹持及加热装置已省略)均正确的是___________ (填字母)。
(1)苯的实验式为
(2)1mol苯与3molH2发生加成反应,碳的杂化类型由
(3)甲苯的一氯代物有
(4)向对二甲苯中加入足量酸性高锰酸钾溶液,生成的有机物中的官能团名称
(5)如图是某同学设计的制取少量溴苯(熔点
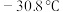 ,沸点
,沸点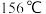 )的装置。实验时,打开K,向圆底烧瓶中滴加苯和溴的混合液,发现a中有微沸现象,b中的液体逐渐变为浅红色,c中有少量气泡产生,反应结束后,对a中的液体进行后续处理即可获得溴苯。
)的装置。实验时,打开K,向圆底烧瓶中滴加苯和溴的混合液,发现a中有微沸现象,b中的液体逐渐变为浅红色,c中有少量气泡产生,反应结束后,对a中的液体进行后续处理即可获得溴苯。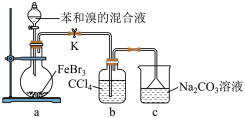
②该实验
③c中看到的现象证明
④得到粗溴苯后,用如下操作进行精制:
①水洗 ②蒸馏 ③用干燥剂干燥 ④10%NaOH溶液洗
正确的操作顺序是
A.①②③④② B.②④②③① C.④①③①② D.①④①③②
⑤进行蒸馏操作中,仪器选择及安装(夹持及加热装置已省略)均正确的是
您最近一年使用:0次
2024-05-21更新
|
209次组卷
|
2卷引用:山西省运城市三晋卓越联盟2023-2024学年高二下学期期中考试化学试题
名校
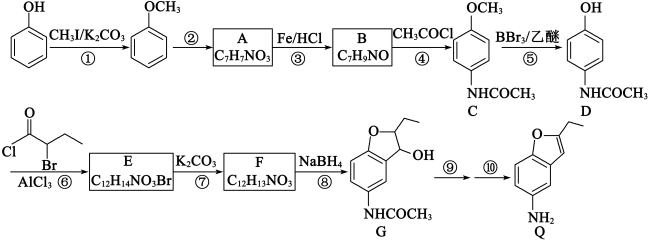
2 . 化合物Q是一种药物的中间体,可利用如下合成路线制备化合物Q;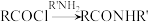
(1)有机物A的化学名称为__________ ;有机物C中官能团的名称为__________ 。
(2)反应①中加入 的作用是
的作用是____________________ ;合成路线中设计反应①和⑤目的是____________________ 。反应⑦的化学方程式为______________________________ 。下列关于反应③的说法,错误的是__________ (填标号)。
A.反应前后N原子的杂化方式未发生变化
B.反应类型为还原反应,当生成1molB时转移6mol电子
C.可以利用酸性 溶液鉴别物质A和B
溶液鉴别物质A和B
(3)有机物D的同分异构体中,同时含有苯环和硝基的共__________ 种(考虑立体异构);其中核磁共振氢谱显示含3组吸收峰,且吸收峰面积比为6:2:1的同分异构体的结构简式为__________ 。
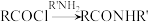
Ⅱ.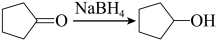
(1)有机物A的化学名称为
(2)反应①中加入
 的作用是
的作用是A.反应前后N原子的杂化方式未发生变化
B.反应类型为还原反应,当生成1molB时转移6mol电子
C.可以利用酸性
 溶液鉴别物质A和B
溶液鉴别物质A和B(3)有机物D的同分异构体中,同时含有苯环和硝基的共
您最近一年使用:0次
2024-03-29更新
|
550次组卷
|
3卷引用:2024届山西省朔州市怀仁市第一中学校高三下学期四模理科综合试题-高中化学
名校
3 . 二联吡啶铂(Ⅱ)配合物(H)在传感器中有重要应用,一种合成路线如图。回答下列问题: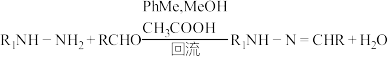
(1)有机物 的官能团的名称为
的官能团的名称为__________ 。
(2)写出 的反应方程式:
的反应方程式:______________ ,该反应的反应类型为__________ 。
(3)试剂 的结构简式为
的结构简式为__________ 。
(4)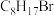 的同分异构体有多种,其中含有两个甲基的结构有
的同分异构体有多种,其中含有两个甲基的结构有__________ 种。
(5)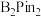 的结构为
的结构为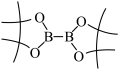 ,可由频哪醇(
,可由频哪醇(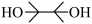 )和四(二甲氨基)二硼合成制得,频哪醇在浓硫酸作用下,加热,可制得分子式为
)和四(二甲氨基)二硼合成制得,频哪醇在浓硫酸作用下,加热,可制得分子式为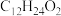 的物质,写出其结构:
的物质,写出其结构:__________ 。
(6)请从物质结构角度分析有机物 能与
能与 反应的原因:
反应的原因:______________ 。
(7)下列关于有机物 的说法错误的是__________(填标号)。
的说法错误的是__________(填标号)。
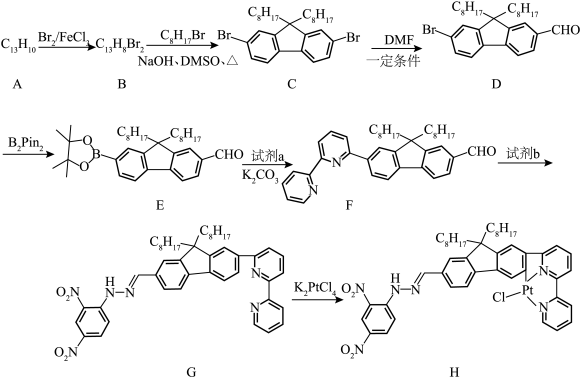
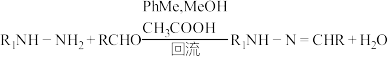
(1)有机物
 的官能团的名称为
的官能团的名称为(2)写出
 的反应方程式:
的反应方程式:(3)试剂
 的结构简式为
的结构简式为(4)
 的同分异构体有多种,其中含有两个甲基的结构有
的同分异构体有多种,其中含有两个甲基的结构有(5)
 的结构为
的结构为 ,可由频哪醇(
,可由频哪醇( )和四(二甲氨基)二硼合成制得,频哪醇在浓硫酸作用下,加热,可制得分子式为
)和四(二甲氨基)二硼合成制得,频哪醇在浓硫酸作用下,加热,可制得分子式为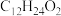 的物质,写出其结构:
的物质,写出其结构:(6)请从物质结构角度分析有机物
 能与
能与 反应的原因:
反应的原因:(7)下列关于有机物
 的说法错误的是__________(填标号)。
的说法错误的是__________(填标号)。A. 的配位数为4 的配位数为4 | B.含有手性碳原子 |
C. 原子的杂化方式为 原子的杂化方式为 | D.存在由 轨道“头碰头”形成的 轨道“头碰头”形成的 键 键 |
您最近一年使用:0次
2024-05-30更新
|
176次组卷
|
4卷引用:2024届山西省晋城市高三下学期第三次模拟考试理科综合试题-高中化学
名校
解题方法
4 . 金属镍广泛应用于制造记忆合金、储氢合金以及用作加氢反应的催化剂,是重要的战略物资,但资源匮乏。从某废镍渣(含 、NiO、FeO、
、NiO、FeO、 )中回收金属镍并转化为
)中回收金属镍并转化为 的流程如图所示:
的流程如图所示:
(1)“滤液A”中主要溶质的化学式为________ 。
(2)“焙烧”后金属元素以硫酸盐的形式存在,写出NiO与 反应的化学方程式:
反应的化学方程式:_______ 。
(3)使用95℃热水“溶解”后过滤,所得“滤渣”的主要成分的化学式是______ 。
(4)①“萃取”时发生反应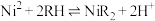 (RH为萃取剂),一定条件下,萃取平衡时,
(RH为萃取剂),一定条件下,萃取平衡时, ,则
,则 的苯取率为
的苯取率为_______ 。
②反萃取获得 ,溶液的实验操作是
,溶液的实验操作是______ 。
(5) 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料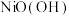 ,该反应的离子方程式为
,该反应的离子方程式为_________ 。
(6)镍能形成多种不同的化合物。图a是镍的一种配合物结构,图b是镍的一种氧化物的结构,下列说法不正确的是_________(填字母)。
 、NiO、FeO、
、NiO、FeO、 )中回收金属镍并转化为
)中回收金属镍并转化为 的流程如图所示:
的流程如图所示:
(1)“滤液A”中主要溶质的化学式为
(2)“焙烧”后金属元素以硫酸盐的形式存在,写出NiO与
 反应的化学方程式:
反应的化学方程式:(3)使用95℃热水“溶解”后过滤,所得“滤渣”的主要成分的化学式是
(4)①“萃取”时发生反应
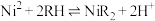 (RH为萃取剂),一定条件下,萃取平衡时,
(RH为萃取剂),一定条件下,萃取平衡时, ,则
,则 的苯取率为
的苯取率为②反萃取获得
 ,溶液的实验操作是
,溶液的实验操作是(5)
 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料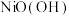 ,该反应的离子方程式为
,该反应的离子方程式为(6)镍能形成多种不同的化合物。图a是镍的一种配合物结构,图b是镍的一种氧化物的结构,下列说法不正确的是_________(填字母)。
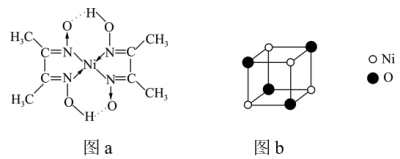
A.图a中,电负性 |
| B.图a分子中存在的化学键有共价键、配位键、氢键 |
| C.图b是氧化镍(NiO)的一个晶胞 |
D.氧化镍中 、 、 的配位数都是6 的配位数都是6 |
您最近一年使用:0次
2024-01-05更新
|
256次组卷
|
5卷引用:山西省运城市新绛县第二中学2023-2024学年高三上学期1月月考理综试题
5 . 氨基吡啶与铜等金属离子所形成的配合物具备良好的磁学性质,某氨基吡啶衍生物铜配合物X的结构简式如图所示。
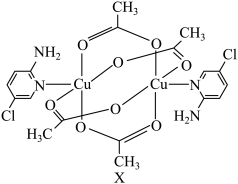
(1)基态氯原子的价层电子排布图为______ ;下列不同状态的氮原子中,能量最高的是______ (填字母)。
A. B.
B.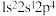 C.
C.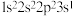 D.
D.
(2)C、N、O元素原子的电负性由大到小的顺序为______ 。
(3)X中 的配位数是
的配位数是______ ;铜元素有不同价态氧化物,高温下稳定性
______ CuO(填“大于”或“小于”),从离子的电子层结构角度分析,主要原因是______ 。
(4)X中N原子的杂化方式为______ 。
(5)下列关于X的说法中不正确的是______(填字母)。

(1)基态氯原子的价层电子排布图为
A.
 B.
B.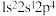 C.
C.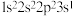 D.
D.
(2)C、N、O元素原子的电负性由大到小的顺序为
(3)X中
 的配位数是
的配位数是
(4)X中N原子的杂化方式为
(5)下列关于X的说法中不正确的是______(填字母)。
A.存在大π键 |
| B.存在氢键、配位键等化学键 |
| C.碳、氧原子间形成的σ键和π键个数比为2∶1 |
| D.铜属于d区元素 |
您最近一年使用:0次
2023-07-06更新
|
80次组卷
|
2卷引用:山西省怀仁市第十一中学校2022-2023学年高二下学期7月期末化学试题
6 . 锂、铁、铬、卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题。
(1)Fe在元素周期表中的位置为_______ ,位于_______ 区,有_______ 个不同运动状态的价电子,最高能层中电子所占据的原子轨道呈_______ 形。
(2)C、N、O、F都是第二周期的典型非金属元素,下列说法不正确的是_______(填标号)。
(3)固态氟化氢中存在 形式,画出
形式,画出 的链状结构
的链状结构_______ 。
(4)下列Li原子轨道表示式表示的状态中,能量最低和最高的分别为_______ 、_______ (填字母)。
A.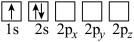 B.
B.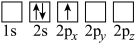
C. D.
D.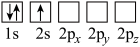
(5)①对于基态Cr原子,下列叙述正确的是_______ (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为
B.4s电子能量较高,一定在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
② 、
、 以及分子
以及分子 的空间结构和相应的键角如下图所示。
的空间结构和相应的键角如下图所示。
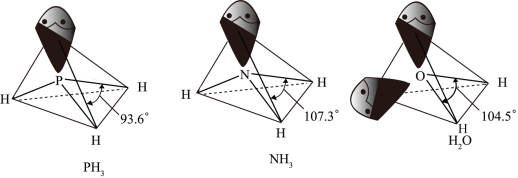
 中P的杂化类型是
中P的杂化类型是_______ , 的键角小于
的键角小于 的分析原因:
的分析原因:_______ 。
(1)Fe在元素周期表中的位置为
(2)C、N、O、F都是第二周期的典型非金属元素,下列说法不正确的是_______(填标号)。
| A.第一电离能:C<N<O<F |
| B.原子半径:C>N>O>F |
| C.最简单气态氢化物的热稳定性:N<O<F |
| D.元素的最高正价:C<N<O |
 形式,画出
形式,画出 的链状结构
的链状结构(4)下列Li原子轨道表示式表示的状态中,能量最低和最高的分别为
A.
 B.
B.
C.
 D.
D.
(5)①对于基态Cr原子,下列叙述正确的是
A.轨道处于半充满时体系总能量低,核外电子排布应为

B.4s电子能量较高,一定在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
②
 、
、 以及分子
以及分子 的空间结构和相应的键角如下图所示。
的空间结构和相应的键角如下图所示。
 中P的杂化类型是
中P的杂化类型是 的键角小于
的键角小于 的分析原因:
的分析原因:
您最近一年使用:0次
解题方法
7 . X、Y、Z、Q、T为前四周期原子序数依次增大的五种元素。X元素基态原子的L电子层的p能级上有一空轨道,Y元素基态原子的L电子层的p能级上只有1对成对电子,Z元素基态原子的M电子层的p能级有2个未成对电子,Q元素基态原子的M电子层的p轨道半充满,T元素基态原子的价层电子排布式为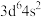 。回答下列问题:
。回答下列问题:
(1)T在周期表中的位置是第___________ 族,___________ 区。
(2)基态Z原子的简化电子排布式为___________ 。
(3)比较第一电离能:Z___________ Q(填“>”“=”或“<”,下同);电负性:X___________ Y。
(4)下列说法不正确的是___________ 。(填字母)
A.键长和键角的数值可以通过晶体的X射线衍射实验获得
B.共价键具有方向性和饱和性
C.键能是衡量化学键稳定性的参数之一
D.X、Y、Z、Q形成的简单氢化物,其中心原子的杂化轨道类型不同
E.Z的氟化物的空间结构为三角锥形
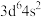 。回答下列问题:
。回答下列问题:(1)T在周期表中的位置是第
(2)基态Z原子的简化电子排布式为
(3)比较第一电离能:Z
(4)下列说法不正确的是
A.键长和键角的数值可以通过晶体的X射线衍射实验获得
B.共价键具有方向性和饱和性
C.键能是衡量化学键稳定性的参数之一
D.X、Y、Z、Q形成的简单氢化物,其中心原子的杂化轨道类型不同
E.Z的氟化物的空间结构为三角锥形
您最近一年使用:0次
8 . 国家航天局计划2020年实施火星探测任务。据了解火星上存在大量的含氮化合物,科学家推测火星生命可能主要以氮、碳、硅、铜为基体构成。
(1)下列氮原子的电子排布图表示的状态中,能量最高的是___________ (填字母标号)。
(2)某种铀氮化物的晶体结构是NaCl型。NaCl的Bom-Haber循环如下图所示。已知:元素的一个气态基态原子获得电子成为气态阴离子时所放出的能量称为电子亲和能。下列有关说法正确的是___________ (填字母标号)。
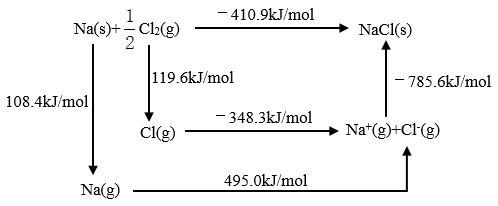
a.Cl-Cl键的键能为119.6kJ/mol
b.Na的第一电离能为603.4kJ/mol
c.NaCl的晶格能为785.6kJ/mol
d.Cl的第一电子亲和能为348.3kJ/mol
(3)乙二胺(H2N—CH2—CH2—NH2)是一种重要的配体,可简写为En。
①乙二胺分子中氮原子的杂化轨道类型为___________ 。
②乙二胺和三甲胺[N(CH3)3]均属于胺,且相对分子质量相近,但乙二胺比三甲胺的沸点高得多,原因是___________ 。
③乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其中与乙二胺形成的化合物稳定性相对较高的是___________ (填“Mg2+”或“Cu2+”)。
(4)K3[Fe(CN)6](铁氰化钾)溶液可以检验铁陨石中铁元素价态。
①铁氰化钾中不存在的作用力有___________ (填字母)。
a.离子键 b.极性键 c.非极性键
d.π键 e.配位键 f.氢键
②1mol[Fe(CN)6]3-中含有的σ键数目为___________ (用NA表示阿伏加德罗常数的值)。
(5)CuF的晶胞结构如下图所示。在CuF晶体中距离Cu+最近的F-有___________ 个。已知CuF的密度为7.5g∙cm-3,则CuF的晶胞参数a=___________ nm(列出计算式)。

(1)下列氮原子的电子排布图表示的状态中,能量最高的是

(2)某种铀氮化物的晶体结构是NaCl型。NaCl的Bom-Haber循环如下图所示。已知:元素的一个气态基态原子获得电子成为气态阴离子时所放出的能量称为电子亲和能。下列有关说法正确的是

a.Cl-Cl键的键能为119.6kJ/mol
b.Na的第一电离能为603.4kJ/mol
c.NaCl的晶格能为785.6kJ/mol
d.Cl的第一电子亲和能为348.3kJ/mol
(3)乙二胺(H2N—CH2—CH2—NH2)是一种重要的配体,可简写为En。
①乙二胺分子中氮原子的杂化轨道类型为
②乙二胺和三甲胺[N(CH3)3]均属于胺,且相对分子质量相近,但乙二胺比三甲胺的沸点高得多,原因是
③乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其中与乙二胺形成的化合物稳定性相对较高的是
(4)K3[Fe(CN)6](铁氰化钾)溶液可以检验铁陨石中铁元素价态。
①铁氰化钾中不存在的作用力有
a.离子键 b.极性键 c.非极性键
d.π键 e.配位键 f.氢键
②1mol[Fe(CN)6]3-中含有的σ键数目为
(5)CuF的晶胞结构如下图所示。在CuF晶体中距离Cu+最近的F-有

您最近一年使用:0次
名校
解题方法
9 . (1)聚四氟乙烯商品名称为“特氟龙”,可做不粘锅涂层。它是一种准晶体,该晶体是一种无平移周期序、但有严格准周期位置序的独特晶体。可通过___ 方法区分晶体、准晶体和非晶体。
(2)下列氮原子的电子排布图表示的状态中,能量由低到高的顺序是___ (填字母代号)。
A. B.
B. 
C. D.
D. 
(3)某种铀氮化物的晶体结构是NaCl型。NaCl的Bom-Haber循环如图所示。已知:元素的一个气态原子获得电子成为气态阴离子时所放出的能量称为电子亲和能。下列有关说法正确的是__ (填标号)。

a.Cl-Cl键的键能为119.6kJ/mol b.Na的第一电离能为603.4kJ/mol
c.NaCl的晶格能为785.6kJ/mol d.Cl的第一电子亲和能为348.3kJ/mol
(4)配合物[Cu(En)2]SO4的名称是硫酸二乙二胺合铜(Ⅱ),是铜的一种重要化合物。其中En 是乙二胺(H2N-CH2-CH2-NH2)的简写。
①该配合物中含有化学键有___ (填字母编号)。
A.离子键 B.极性共价键 C.非极性共价键 D.配位键 E.金属键
②配体乙二胺分子中氮原子、碳原子轨道的杂化类型分别为___ 、___ 。
③乙二胺和三甲胺[N(CH3)3]均属于胺,且相对分子质量相近,但乙二胺比三甲胺的沸点高得多,原因是___ 。
④乙二胺(H2NCH2CH2NH2)是一种有机化合物,乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是___ ,其中与乙二胺形成的化合物稳定性相对较高的是___ (填“Mg2+”或“Cu2+”)。
⑤与氨气互为等电子体的阳离子为___ ,与S位于同一周期,且第一电离能小于S的非金属元素符号为___ 。
(5)①金属钛的原子堆积方式如图1所示,则金属钛晶胞俯视图为____ 。

A. B.
B.  C.
C.  D.
D. 
②某砷镍合金的晶胞如图所示,设阿伏加 德罗常数的值为NA,该晶体的密度ρ=__ g·cm-3。

(2)下列氮原子的电子排布图表示的状态中,能量由低到高的顺序是
A.
 B.
B. 
C.
 D.
D. 
(3)某种铀氮化物的晶体结构是NaCl型。NaCl的Bom-Haber循环如图所示。已知:元素的一个气态原子获得电子成为气态阴离子时所放出的能量称为电子亲和能。下列有关说法正确的是

a.Cl-Cl键的键能为119.6kJ/mol b.Na的第一电离能为603.4kJ/mol
c.NaCl的晶格能为785.6kJ/mol d.Cl的第一电子亲和能为348.3kJ/mol
(4)配合物[Cu(En)2]SO4的名称是硫酸二乙二胺合铜(Ⅱ),是铜的一种重要化合物。其中En 是乙二胺(H2N-CH2-CH2-NH2)的简写。
①该配合物中含有化学键有
A.离子键 B.极性共价键 C.非极性共价键 D.配位键 E.金属键
②配体乙二胺分子中氮原子、碳原子轨道的杂化类型分别为
③乙二胺和三甲胺[N(CH3)3]均属于胺,且相对分子质量相近,但乙二胺比三甲胺的沸点高得多,原因是
④乙二胺(H2NCH2CH2NH2)是一种有机化合物,乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是
⑤与氨气互为等电子体的阳离子为
(5)①金属钛的原子堆积方式如图1所示,则金属钛晶胞俯视图为

A.
 B.
B.  C.
C.  D.
D. 
②某砷镍合金的晶胞如图所示,设阿伏加 德罗常数的值为NA,该晶体的密度ρ=

您最近一年使用:0次
2019-12-10更新
|
429次组卷
|
4卷引用:山西省临汾市洪洞县第一中学2020届高三下学期第一次调研考试理综化学试题
山西省临汾市洪洞县第一中学2020届高三下学期第一次调研考试理综化学试题陕西省宝鸡中学、西安三中等五校2020届高三上学期第一次联考化学试题2020届高三《新题速递·化学》1月第01期(考点14-15)(已下线)考点14 物质结构与性质(选考)-2020年高考化学命题预测与模拟试题分类精编
解题方法
10 . 锰及其化合物用途非常广泛,请回答下列问题:
(1)Mn3+在水溶液中容易歧化为MnO2和Mn2+,下列说法合理的是__ 。
A.Mn3+的价电子构型为3d4,不属于较稳定的电子构型
B.根据Mn2+的电子构型可知,Mn4+中不含成对电子
C.Mn2+易被氧化,可能是因为Mn2+内有大量自旋方向相同的电子
D.Mn2+与Fe3+具有相同的价电子构型,所以它们的化学性质相似
(2)锰的一种配合物的化学式为[Mn(CO)5(CH3CN)]。配体CH3CN与中心原子形成配位键时,提供孤对电子的原子是__ 原子(填写元素名称),该分子中碳原子的杂化方式为__ 。
(3)研究发现,在合成甲醇反应(CO2+3H2=CH3OH+H2O)中,CO氧化物负载的Mn氧化物纳米粒子催化剂具有高活性。反应所涉及的4种物质中,沸点从高到低的顺序为__ 。
(4)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域Π键”,下列物质中存在“离域Π键”的是__ 。
A.SO2 B.SO C.H2S D.CS2
C.H2S D.CS2
(5)C为有机材料的主角,Si为无机材料的主角,SiC结构类似金刚石,图为SiC的晶胞图,其中两个正方体中心重合、各面分别平行,其中心为Si原子(用●表示),试在小立方体的顶点画出C原子(用○表示)的位置,在大正方体画出相应Si原子的位置___ 。

(6)某锰氧化物的晶胞结构如图所示:

该锰的氧化物的化学式为__ ,该晶体中Mn的配位数为__ ,该晶体中Mn之间的最近距离为__ pm(用a、b来表示)。
(1)Mn3+在水溶液中容易歧化为MnO2和Mn2+,下列说法合理的是
A.Mn3+的价电子构型为3d4,不属于较稳定的电子构型
B.根据Mn2+的电子构型可知,Mn4+中不含成对电子
C.Mn2+易被氧化,可能是因为Mn2+内有大量自旋方向相同的电子
D.Mn2+与Fe3+具有相同的价电子构型,所以它们的化学性质相似
(2)锰的一种配合物的化学式为[Mn(CO)5(CH3CN)]。配体CH3CN与中心原子形成配位键时,提供孤对电子的原子是
(3)研究发现,在合成甲醇反应(CO2+3H2=CH3OH+H2O)中,CO氧化物负载的Mn氧化物纳米粒子催化剂具有高活性。反应所涉及的4种物质中,沸点从高到低的顺序为
(4)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域Π键”,下列物质中存在“离域Π键”的是
A.SO2 B.SO
 C.H2S D.CS2
C.H2S D.CS2(5)C为有机材料的主角,Si为无机材料的主角,SiC结构类似金刚石,图为SiC的晶胞图,其中两个正方体中心重合、各面分别平行,其中心为Si原子(用●表示),试在小立方体的顶点画出C原子(用○表示)的位置,在大正方体画出相应Si原子的位置

(6)某锰氧化物的晶胞结构如图所示:

该锰的氧化物的化学式为
您最近一年使用:0次



