解题方法
1 . 铁、钴均为第四周期第Ⅷ族元素,它们的单质及其化合物均具有广泛用途。
(1)基态Co2+中未成对电子数为_____ ;Fe和Co的第三电离能:I3(Fe)______ I3(Co)(填“>”“<”或“=”)。
(2)化学上可用EDTA测定Fe2+和Co2+的含量。EDTA的结构简式如图所示:
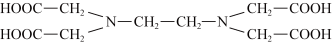
①EDTA中电负性最大的元素是______ (填元素符号),其中C原子的杂化轨道类型为______ 。
②EDTA分子中存在的化学键有_____ (填选项字母)。
a.离子键 b.共价键 c.氢键 d.σ键 e.π键 f.配位键
(3)将1molCoCl3·4NH3溶于水中,加入足量AgNO3溶液生成1molAgCl沉淀。则CoCl3·4NH3中配离子的化学式为_____ 。已知孤电子对与成键电子对的排斥作用大于成键电子对的排斥作用,则NH3分子与Co3+形成配合物后,H-N-H键角______ (填“变大”“变小”或“不变”)。
(4)一种铁氮化合物具有高磁导率,其结构如图所示。已知晶体的密度为ρg•cm-3,阿伏加德罗常数的值为NA。
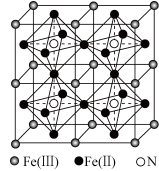
①该铁氮化合物的化学式为______ 。
②一个晶胞内Fe(Ⅱ)构成的一个正八面体的体积为______ cm3。
(1)基态Co2+中未成对电子数为
(2)化学上可用EDTA测定Fe2+和Co2+的含量。EDTA的结构简式如图所示:
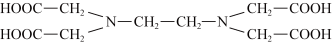
①EDTA中电负性最大的元素是
②EDTA分子中存在的化学键有
a.离子键 b.共价键 c.氢键 d.σ键 e.π键 f.配位键
(3)将1molCoCl3·4NH3溶于水中,加入足量AgNO3溶液生成1molAgCl沉淀。则CoCl3·4NH3中配离子的化学式为
(4)一种铁氮化合物具有高磁导率,其结构如图所示。已知晶体的密度为ρg•cm-3,阿伏加德罗常数的值为NA。

①该铁氮化合物的化学式为
②一个晶胞内Fe(Ⅱ)构成的一个正八面体的体积为
您最近一年使用:0次
解题方法
2 . 黑火药是我国古代的四大发明之一,距今已有1000多年的历史。黑火药在发生爆炸时发生的反应为: (已配平)。回答下列问题:
(已配平)。回答下列问题:
(1)K原子激发态的电子排布式有_______ ,其中能量较高的是_______ 。(填标号)
a.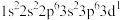 b.
b.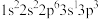
c.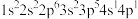 d.
d.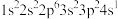
(2)在生成物中,A的电子式为_______ 。
(3)已知 与
与 结构相似,推算HCN分子中
结构相似,推算HCN分子中 键与
键与 键数目之比为
键数目之比为_______ 。
(4)第VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含第VIA族元素的化合物在研究和生产中有许多重要用途。
①O、S、Se原子的第一电离能由大到小的顺序为_______ 。
② 的酸性比
的酸性比 的酸性
的酸性_______ (填“强”或“弱”)。气态 分子中Se的杂化方式为
分子中Se的杂化方式为_______ , 离子的VSEPR模型名称为
离子的VSEPR模型名称为_______ 。
 (已配平)。回答下列问题:
(已配平)。回答下列问题:(1)K原子激发态的电子排布式有
a.
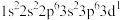 b.
b.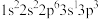
c.
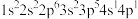 d.
d.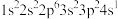
(2)在生成物中,A的电子式为
(3)已知
 与
与 结构相似,推算HCN分子中
结构相似,推算HCN分子中 键与
键与 键数目之比为
键数目之比为(4)第VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含第VIA族元素的化合物在研究和生产中有许多重要用途。
①O、S、Se原子的第一电离能由大到小的顺序为
②
 的酸性比
的酸性比 的酸性
的酸性 分子中Se的杂化方式为
分子中Se的杂化方式为 离子的VSEPR模型名称为
离子的VSEPR模型名称为
您最近一年使用:0次
解题方法
3 . 铜及其化合物在科学研究和工农业生产中有许多用途。回答下列问题:
(1)[Cu(NH3)2]Ac溶液可以吸收合成氨中对催化剂有毒害的CO气体[醋酸根(CH3COO-)简写成Ac-],反应的化学方程式为:[Cu(NH3)2]Ac+CO+NH3 [Cu(NH3)3CO]Ac。
[Cu(NH3)3CO]Ac。
①基态Cu+的核外电子排布式为_____ 。
②CH3COO-中C原子的杂化轨道类型为_____ 。
③[Cu(NH3)2]Ac中所含非金属元素的电负性由大到小的顺序是_____ (用元素符号表示)。
④[Cu(NH3)2]+中N原子形成的H—N—H键角_____ (填“大于”“小于”或“等于”)气态NH3中的键角,原因是_____ 。
⑤1个[Cu(NH3)3CO]+中含有的共价键数为_____ 。
(2)Cu—Mn—Al合金为磁性形状记忆合金材料之一,其晶胞结构如图所示:
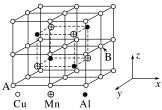
①合金的化学式为_____ 。
②若A原子的坐标参数为(0,1,0),则B原子的坐标参数为_____ 。
③已知该合金晶体的密度为ρg·cm-3,则最近的两个Al原子间的距离为_____ nm(阿伏加德罗常数的值用NA表示)。
(1)[Cu(NH3)2]Ac溶液可以吸收合成氨中对催化剂有毒害的CO气体[醋酸根(CH3COO-)简写成Ac-],反应的化学方程式为:[Cu(NH3)2]Ac+CO+NH3
 [Cu(NH3)3CO]Ac。
[Cu(NH3)3CO]Ac。①基态Cu+的核外电子排布式为
②CH3COO-中C原子的杂化轨道类型为
③[Cu(NH3)2]Ac中所含非金属元素的电负性由大到小的顺序是
④[Cu(NH3)2]+中N原子形成的H—N—H键角
⑤1个[Cu(NH3)3CO]+中含有的共价键数为
(2)Cu—Mn—Al合金为磁性形状记忆合金材料之一,其晶胞结构如图所示:

①合金的化学式为
②若A原子的坐标参数为(0,1,0),则B原子的坐标参数为
③已知该合金晶体的密度为ρg·cm-3,则最近的两个Al原子间的距离为
您最近一年使用:0次
4 . I.金(79Au)是一种非常稳定的金属,但也可以形成多种化合物,并在化合物中呈一价或三价。
(1)已知Au的基态原子的价电子排布式为5dl06s1,则Au位于周期表______ 区。基态Au3+的价电子中空间运动状态不同的电子数为______ 种
(2)有一种化合物由Cs、Cl、Au三种元素组成,其晶胞如下。大球为Cs,小球为Cl,其余球为Au。
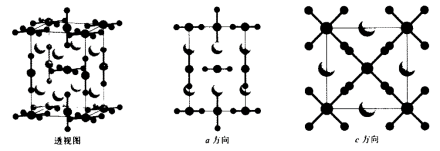
该化合物的化学式为______ ,其中金原子有2种不同的化学环境,形成2种不同的配离子,它们分别是______ 和______ 。
II.过渡金属钛、铜、锌等金属及其化合物在工业上有重要用途。
(3)TiOSO4溶液中加入H2O2可以生成稳定的[TiO(H2O2)]+。己如SzCl2的分子结构与H2O2相似,第一电离能(I1): I1(O)______ I1(S)(填“大于或“小于”),原因是______ ;沸点: H2O2______ S2Cl2(填“>”或“<”),其原因是______ 。
(4)超细铜粉可用作导电材料、催化剂等,制备方法如下:
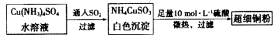
①关于[Cu(NH3)4]SO4和NH4CuSO3中的阴离子相同之处为______ 不同之处为______ ( 填标号)
A.中心原子的杂化轨道类型 B.中心原子的孤电子对数
C.立体结构 D.VSEPR模型
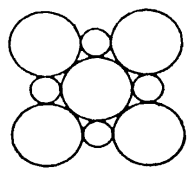
III.(5)MgO具有NaCl型结构(示意图如图所示),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为______ nm(结果保留三位小数)。
(1)已知Au的基态原子的价电子排布式为5dl06s1,则Au位于周期表
(2)有一种化合物由Cs、Cl、Au三种元素组成,其晶胞如下。大球为Cs,小球为Cl,其余球为Au。

该化合物的化学式为
II.过渡金属钛、铜、锌等金属及其化合物在工业上有重要用途。
(3)TiOSO4溶液中加入H2O2可以生成稳定的[TiO(H2O2)]+。己如SzCl2的分子结构与H2O2相似,第一电离能(I1): I1(O)
(4)超细铜粉可用作导电材料、催化剂等,制备方法如下:

①关于[Cu(NH3)4]SO4和NH4CuSO3中的阴离子相同之处为
A.中心原子的杂化轨道类型 B.中心原子的孤电子对数
C.立体结构 D.VSEPR模型
III.(5)MgO具有NaCl型结构(示意图如图所示),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为

您最近一年使用:0次
解题方法
5 . 锰及其化合物用途非常广泛,请回答下列问题:
(1)Mn3+在水溶液中容易歧化为MnO2和Mn2+,下列说法合理的是__ 。
A.Mn3+的价电子构型为3d4,不属于较稳定的电子构型
B.根据Mn2+的电子构型可知,Mn4+中不含成对电子
C.Mn2+易被氧化,可能是因为Mn2+内有大量自旋方向相同的电子
D.Mn2+与Fe3+具有相同的价电子构型,所以它们的化学性质相似
(2)锰的一种配合物的化学式为[Mn(CO)5(CH3CN)]。配体CH3CN与中心原子形成配位键时,提供孤对电子的原子是__ 原子(填写元素名称),该分子中碳原子的杂化方式为__ 。
(3)研究发现,在合成甲醇反应(CO2+3H2=CH3OH+H2O)中,CO氧化物负载的Mn氧化物纳米粒子催化剂具有高活性。反应所涉及的4种物质中,沸点从高到低的顺序为__ 。
(4)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域Π键”,下列物质中存在“离域Π键”的是__ 。
A.SO2 B.SO C.H2S D.CS2
C.H2S D.CS2
(5)C为有机材料的主角,Si为无机材料的主角,SiC结构类似金刚石,图为SiC的晶胞图,其中两个正方体中心重合、各面分别平行,其中心为Si原子(用●表示),试在小立方体的顶点画出C原子(用○表示)的位置,在大正方体画出相应Si原子的位置___ 。

(6)某锰氧化物的晶胞结构如图所示:

该锰的氧化物的化学式为__ ,该晶体中Mn的配位数为__ ,该晶体中Mn之间的最近距离为__ pm(用a、b来表示)。
(1)Mn3+在水溶液中容易歧化为MnO2和Mn2+,下列说法合理的是
A.Mn3+的价电子构型为3d4,不属于较稳定的电子构型
B.根据Mn2+的电子构型可知,Mn4+中不含成对电子
C.Mn2+易被氧化,可能是因为Mn2+内有大量自旋方向相同的电子
D.Mn2+与Fe3+具有相同的价电子构型,所以它们的化学性质相似
(2)锰的一种配合物的化学式为[Mn(CO)5(CH3CN)]。配体CH3CN与中心原子形成配位键时,提供孤对电子的原子是
(3)研究发现,在合成甲醇反应(CO2+3H2=CH3OH+H2O)中,CO氧化物负载的Mn氧化物纳米粒子催化剂具有高活性。反应所涉及的4种物质中,沸点从高到低的顺序为
(4)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域Π键”,下列物质中存在“离域Π键”的是
A.SO2 B.SO
 C.H2S D.CS2
C.H2S D.CS2(5)C为有机材料的主角,Si为无机材料的主角,SiC结构类似金刚石,图为SiC的晶胞图,其中两个正方体中心重合、各面分别平行,其中心为Si原子(用●表示),试在小立方体的顶点画出C原子(用○表示)的位置,在大正方体画出相应Si原子的位置

(6)某锰氧化物的晶胞结构如图所示:

该锰的氧化物的化学式为
您最近一年使用:0次
6 . ⅤA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含ⅤA族元素的化合物在医药生产中有许多重要用途。请回答下列问题:
(1)基态氮原子的价电子排布图是___ ;基态砷原子的电子排布式为___ 。
(2)砷与同周期第ⅦA族的溴的第一电离能相比,较大的是___ 。
(3)AsH3是无色稍有大蒜味的气体。AsH3的沸点高于PH3,其主要原因是___ 。
(4)Na3AsO4可作杀虫剂。AsO 的立体构型为
的立体构型为___ ,与其互为等电子体的一种分子为___ 。
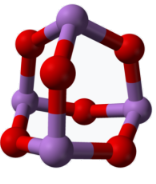
(5)某砷的氧化物俗称“砒霜”,其分子结构如图所示。该化合物的分子式为___ ,砷原子采取___ 杂化。
(6)GaAs是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与___ 个Ga相连。
(1)基态氮原子的价电子排布图是
(2)砷与同周期第ⅦA族的溴的第一电离能相比,较大的是
(3)AsH3是无色稍有大蒜味的气体。AsH3的沸点高于PH3,其主要原因是
(4)Na3AsO4可作杀虫剂。AsO
 的立体构型为
的立体构型为(5)某砷的氧化物俗称“砒霜”,其分子结构如图所示。该化合物的分子式为

(6)GaAs是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与
您最近一年使用:0次
解题方法
7 . 氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯商品名称为“特氟龙”,可做不粘锅涂层。它是一种准晶体,该晶体是一种无平移周期序、但有严格准周期位置序的独特晶体。可通过____________ 方法区分晶体、准晶体和非晶体。
(2)锑(Sb)与砷处于同一主族且相邻,基态锑原子价电子排布式为____________ 。[H2F]+[SbF6]-(氟酸锑)是一种超强酸,存在[H2F]+,写出一种与[H2F]+互为等电子体的阴离子是____________ 。
(3)硼酸(H3BO3)和四氟硼酸铵(NH4BF4)都有着重要的化工用途。
①H3BO3和NH4BF4涉及的四种元素中第二周期元素的第一电离能由大到小的顺序____________ (填元素符号)。
②H3BO3本身不能电离出H+,在水中易结合一个OH﹣生成[B(OH)4]﹣,而体现弱酸性。[B(OH)4]﹣中B原子的杂化类型为____________ 。
③NH4BF4(四氟硼酸铵)可用作铝或铜焊接助熔剂、能腐蚀玻璃等。四氟硼酸铵中存在____________ (填序号):
A.离子键 B. σ键 C.π键D.范德华力 E.配位键
(4)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃。
①CuF比CuCl熔点高的原因是____________ ;
②CuF的晶胞结构如图。F-填充在Cu+围成的____________ 空隙中,空隙填充率为____________ %。

(1)聚四氟乙烯商品名称为“特氟龙”,可做不粘锅涂层。它是一种准晶体,该晶体是一种无平移周期序、但有严格准周期位置序的独特晶体。可通过
(2)锑(Sb)与砷处于同一主族且相邻,基态锑原子价电子排布式为
(3)硼酸(H3BO3)和四氟硼酸铵(NH4BF4)都有着重要的化工用途。
①H3BO3和NH4BF4涉及的四种元素中第二周期元素的第一电离能由大到小的顺序
②H3BO3本身不能电离出H+,在水中易结合一个OH﹣生成[B(OH)4]﹣,而体现弱酸性。[B(OH)4]﹣中B原子的杂化类型为
③NH4BF4(四氟硼酸铵)可用作铝或铜焊接助熔剂、能腐蚀玻璃等。四氟硼酸铵中存在
A.离子键 B. σ键 C.π键D.范德华力 E.配位键
(4)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃。
①CuF比CuCl熔点高的原因是
②CuF的晶胞结构如图。F-填充在Cu+围成的

您最近一年使用:0次
名校
解题方法
8 . ⅣA族元素及其化合物在材料等方面有重要用途。回答下列问题:
(1)碳的一种单质的结构如图(a)所示。该单质的晶体类型为_______ ,原子间存在的共价键类型有________ ,碳原子的杂化轨道类型为________ 。



(2)SiCl4分子的立体构型为________ ,属于________ 分子(填“极性”或“非极性”)。
(3)四卤化硅SiX4的沸点和二卤化铅PbX2的熔点如图(b)所示。
①SiX4的沸点依F、Cl、Br、I次序升高的原因是________ 。
②结合SiX4的沸点和PbX2的熔点的变化规律,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性_______ 。(填“增强”“不变”或“减弱”)
(4)碳的另一种单质C60可以与钾形成低温超导化合物,晶体结构如图(c)所示。K位于立方体的棱上和立方体的内部,此化合物的化学式为_________ 。
(1)碳的一种单质的结构如图(a)所示。该单质的晶体类型为



(2)SiCl4分子的立体构型为
(3)四卤化硅SiX4的沸点和二卤化铅PbX2的熔点如图(b)所示。
①SiX4的沸点依F、Cl、Br、I次序升高的原因是
②结合SiX4的沸点和PbX2的熔点的变化规律,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性
(4)碳的另一种单质C60可以与钾形成低温超导化合物,晶体结构如图(c)所示。K位于立方体的棱上和立方体的内部,此化合物的化学式为
您最近一年使用:0次
名校
9 . 氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过___ 方法区分晶体准晶体和非晶体。
(2)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,存在[H2F]+,该离子的空间构型为___ 。
(3)NH4F(氟化铵)可用于玻璃的蚀刻、防腐剂、消毒剂。氟化铵溶液中存在__ (填字母)。
a.离子键b.σ键c.π键d.氢键e.配位键
(4)SF6被广泛用作高压电气设备的绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图计算相关键能。则F-F键的键能为____ kJ•mol-1。

(1)聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过
(2)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,存在[H2F]+,该离子的空间构型为
(3)NH4F(氟化铵)可用于玻璃的蚀刻、防腐剂、消毒剂。氟化铵溶液中存在
a.离子键b.σ键c.π键d.氢键e.配位键
(4)SF6被广泛用作高压电气设备的绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图计算相关键能。则F-F键的键能为

您最近一年使用:0次
名校
解题方法
10 . I.氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯商品名称为“特氟龙”,可做不粘锅涂层。它是一种准晶体,该晶体是一种无平移周期序、但有严格准周期位置序的独特晶体。可通过____________ 方法区分晶体、准晶体和非晶体。
(2)锑(Sb)与砷处于同一主族且相邻,基态锑原子价电子排布式为______ 。[H2F]+[SbF6]-(氟酸锑)是一种超强酸,存在[H2F]+,写出一种与[H2F]+互为等电子体的阴离子是_________ 。
(3)硼酸(H3BO3)和四氟硼酸铵(NH4BF4)都有着重要的化工用途。
①H3BO3和NH4BF4涉及的四种元素中第二周期元素的第一电离能由大到小的顺序____ (填元素符号)。
②H3BO3本身不能电离出H+,在水中易结合一个OH﹣生成[B(OH)4]﹣,而体现弱酸性。[B(OH)4]﹣中B原子的杂化类型为_________ 。
③NH4BF4(四氟硼酸铵)可用作铝或铜焊接助熔剂、能腐蚀玻璃等。四氟硼酸铵中存在_______ (填序号):
A 离子键 B σ键 C π键 D 范德华力 E 配位键
(4)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃。
①CuF比CuCl熔点高的原因是_____________ ;
②CuF的晶胞结构如图1。F-填充在Cu+围成的_______ 空隙中,空隙填充率为________ %。

图1
Ⅱ.AA705合金(含Cu、Al、Zn、Mg和Ti)几乎与钢一样坚固,但重量仅为钢的三分之一,已被用于飞机机身和机翼、智能手机外壳上等。
(5)CN-、NH3、H2O和OH-等配体都能与Zn2+形成配离子。1mol [Zn(NH3)4]2+含________ molσ键,中心离子的配位数为__________ 。
钛晶体有两种晶胞,如图所示。

①如图2所示,晶胞的空间利用率为______ (用含п的式子表示)。
②已知图3中六棱柱边长为x pm,高为y pm。该钛晶胞密度为D g·cm-3,NA为______ mol-1(用含x y和D的式子表示)。
(1)聚四氟乙烯商品名称为“特氟龙”,可做不粘锅涂层。它是一种准晶体,该晶体是一种无平移周期序、但有严格准周期位置序的独特晶体。可通过
(2)锑(Sb)与砷处于同一主族且相邻,基态锑原子价电子排布式为
(3)硼酸(H3BO3)和四氟硼酸铵(NH4BF4)都有着重要的化工用途。
①H3BO3和NH4BF4涉及的四种元素中第二周期元素的第一电离能由大到小的顺序
②H3BO3本身不能电离出H+,在水中易结合一个OH﹣生成[B(OH)4]﹣,而体现弱酸性。[B(OH)4]﹣中B原子的杂化类型为
③NH4BF4(四氟硼酸铵)可用作铝或铜焊接助熔剂、能腐蚀玻璃等。四氟硼酸铵中存在
A 离子键 B σ键 C π键 D 范德华力 E 配位键
(4)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃。
①CuF比CuCl熔点高的原因是
②CuF的晶胞结构如图1。F-填充在Cu+围成的

图1
Ⅱ.AA705合金(含Cu、Al、Zn、Mg和Ti)几乎与钢一样坚固,但重量仅为钢的三分之一,已被用于飞机机身和机翼、智能手机外壳上等。
(5)CN-、NH3、H2O和OH-等配体都能与Zn2+形成配离子。1mol [Zn(NH3)4]2+含
钛晶体有两种晶胞,如图所示。

①如图2所示,晶胞的空间利用率为
②已知图3中六棱柱边长为x pm,高为y pm。该钛晶胞密度为D g·cm-3,NA为
您最近一年使用:0次



