1 .  固定是实现碳达峰、碳中和的有效途径。使用不同催化剂,
固定是实现碳达峰、碳中和的有效途径。使用不同催化剂, 固定的产物也不同。在戊二酸锌催化下,
固定的产物也不同。在戊二酸锌催化下, 固定方式主要有:
固定方式主要有:
(1)一个基态氧原子的价层电子轨道表示式为___________ ;基态碳原子核外有___________ 个未成对电子。
(2)乙中所含元素电负性由大到小的顺序为___________ (填元素符号),乙中碳原子的杂化类型是___________ 。
(3)戊二酸、丙二酸二甲酯的沸点分别为303℃、181℃,它们沸点差别较大的原因是___________ 。
(4)配离子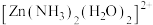 的空间结构只有1种,由此推知
的空间结构只有1种,由此推知 的空间结构是
的空间结构是___________ 。
(5)ZnO晶胞结构如图所示。已知:ZnO晶体的密度为 ,
, 代表阿伏加德罗常数的值。氧和锌的最近距离为
代表阿伏加德罗常数的值。氧和锌的最近距离为___________ nm。
 固定是实现碳达峰、碳中和的有效途径。使用不同催化剂,
固定是实现碳达峰、碳中和的有效途径。使用不同催化剂, 固定的产物也不同。在戊二酸锌催化下,
固定的产物也不同。在戊二酸锌催化下, 固定方式主要有:
固定方式主要有: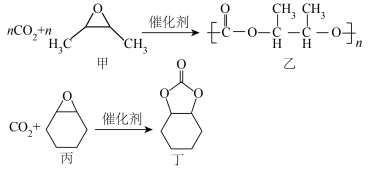
(1)一个基态氧原子的价层电子轨道表示式为
(2)乙中所含元素电负性由大到小的顺序为
(3)戊二酸、丙二酸二甲酯的沸点分别为303℃、181℃,它们沸点差别较大的原因是
(4)配离子
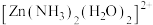 的空间结构只有1种,由此推知
的空间结构只有1种,由此推知 的空间结构是
的空间结构是(5)ZnO晶胞结构如图所示。已知:ZnO晶体的密度为
 ,
, 代表阿伏加德罗常数的值。氧和锌的最近距离为
代表阿伏加德罗常数的值。氧和锌的最近距离为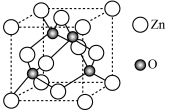
您最近一年使用:0次
2023-12-23更新
|
83次组卷
|
2卷引用:河北省保定市高碑店市崇德实验中学2023-2024学年高三上学期期末考试化学试题
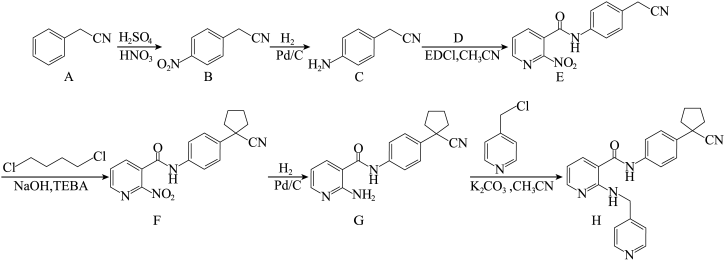
2 . 阿帕替尼(H)是一种治疗晚期胃癌的小分子靶向药物,其合成路线如下: 和
和_______ 。
(2)B→C的反应类型为_______ 。
(3)D的分子式为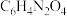 ,其结构简式为
,其结构简式为_______ 。
(4)E→F中加入NaOH的作用是为了吸收生成的_______ (填化学式)。
(5)B与 在一定条件下也可以转化为化合物Ⅰ(分子式为
在一定条件下也可以转化为化合物Ⅰ(分子式为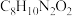 ),写出同时满足下列条件的Ⅰ的一种同分异构体的结构简式:
),写出同时满足下列条件的Ⅰ的一种同分异构体的结构简式:_______ 。
能与盐酸反应生成盐;既能发生银镜反应又能发生水解反应,水解产物之一能与 溶液作用显紫色;分子中共有4种化学环境不同的氢原子。
溶液作用显紫色;分子中共有4种化学环境不同的氢原子。
(6)写出以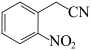 和
和 为原料制备
为原料制备 的合成路线流程图
的合成路线流程图_______ (无机试剂、有机溶剂任用,合成路线流程图示例见本题题干)。
 和
和(2)B→C的反应类型为
(3)D的分子式为
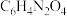 ,其结构简式为
,其结构简式为(4)E→F中加入NaOH的作用是为了吸收生成的
(5)B与
 在一定条件下也可以转化为化合物Ⅰ(分子式为
在一定条件下也可以转化为化合物Ⅰ(分子式为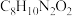 ),写出同时满足下列条件的Ⅰ的一种同分异构体的结构简式:
),写出同时满足下列条件的Ⅰ的一种同分异构体的结构简式:能与盐酸反应生成盐;既能发生银镜反应又能发生水解反应,水解产物之一能与
 溶液作用显紫色;分子中共有4种化学环境不同的氢原子。
溶液作用显紫色;分子中共有4种化学环境不同的氢原子。(6)写出以
 和
和 为原料制备
为原料制备 的合成路线流程图
的合成路线流程图
您最近一年使用:0次
解题方法
3 . 氮族元素包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi),在性质上表现出从典型的非金属元素到典型的金属元素的过渡。回答下列问题:
(1)①基态N原子含有___________ 种不同能量的电子。
② 、
、 、
、 、
、 中,中心原子与
中,中心原子与 中N原子杂化类型相同的为
中N原子杂化类型相同的为___________ (填化学式,下同),微粒的空间结构相同的为___________ 和___________ ;键角:
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
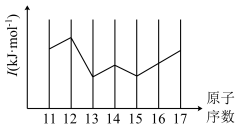
(2)第三周期主族元素某一级电离能如图所示,该电离能是第___________ (填“一”“二”或“三”)电离能,其中P的该级电离能比Si小的原因为___________ 。
(3) 和
和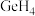 的沸点如下表:
的沸点如下表:
 的沸点比
的沸点比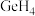 的沸点高的主要原因为
的沸点高的主要原因为___________ 。
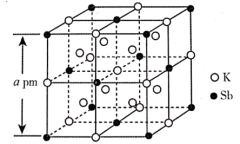
(4)锑钾(Sb-K)合金的立方晶胞结构如图所示,晶胞中锑原子与钾原子的数量比为___________ 。若该合金的密度为 ,该合金的摩尔质量为
,该合金的摩尔质量为___________  (
( 表示阿伏加德罗常数的值,用含
表示阿伏加德罗常数的值,用含 、a、
、a、 的式子表示)。
的式子表示)。
(1)①基态N原子含有
②
 、
、 、
、 、
、 中,中心原子与
中,中心原子与 中N原子杂化类型相同的为
中N原子杂化类型相同的为
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(2)第三周期主族元素某一级电离能如图所示,该电离能是第

(3)
 和
和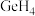 的沸点如下表:
的沸点如下表:| 物质 |  | 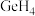 |
| 沸点 | -62℃ | -90℃ |
 的沸点比
的沸点比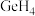 的沸点高的主要原因为
的沸点高的主要原因为(4)锑钾(Sb-K)合金的立方晶胞结构如图所示,晶胞中锑原子与钾原子的数量比为
 ,该合金的摩尔质量为
,该合金的摩尔质量为 (
( 表示阿伏加德罗常数的值,用含
表示阿伏加德罗常数的值,用含 、a、
、a、 的式子表示)。
的式子表示)。
您最近一年使用:0次
名校
4 . LiFePO4、LiPF6、LiAsF6、LiCl等常用于锂离子聚合物电池。请回答:
(1) 的立体构型是
的立体构型是___________ 。
(2)第四周期元素中,与基态As原子核外未成对电子数目相同的元素符号为___________ 。
(3)抗坏血酸(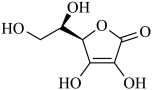 )常被用作碳包覆的碳源,以增强电极导电性,其易溶于水的原因是
)常被用作碳包覆的碳源,以增强电极导电性,其易溶于水的原因是___________ 。
(4)电池工作时,Li⁺沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出),电解质LiPF6或LiAsF6的阴离子结构如图乙所示(X=P、As)。
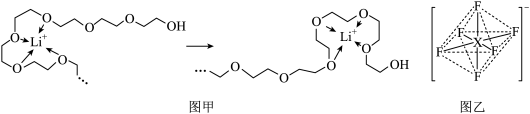
①从化学键角度看,Li⁺迁移过程发生___________ (填“物理”或“化学”)变化。
②已知相同条件下,锂离子的迁移速率与离子键的强弱有关,则Li⁺在___________ (选填“LiPF6”或“LiAsF6”)中迁移较快。
③图乙中X的杂化方式最可能是___________ (填字母编号)。
a.sp3 b.sp3d c.sp3d2 d.sp3d3
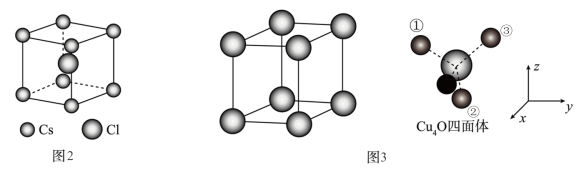
(5)Cu2O晶体结构与CsCl(图2)相似,只是利用Cu4O占据CsCl晶体中Cl的位置,而Cs位置由O原子占据,如图3所示,每个Cu2O晶胞中有___________ 个“Cu2O”;Cu2O晶胞中Cu的配位数是___________ ;若①处Cu原子坐标为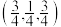 ,②处Cu原子坐标为
,②处Cu原子坐标为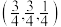 ,则③处Cu原子坐标为(___________,
,则③处Cu原子坐标为(___________,___________ ,)。
(1)
 的立体构型是
的立体构型是(2)第四周期元素中,与基态As原子核外未成对电子数目相同的元素符号为
(3)抗坏血酸(
 )常被用作碳包覆的碳源,以增强电极导电性,其易溶于水的原因是
)常被用作碳包覆的碳源,以增强电极导电性,其易溶于水的原因是(4)电池工作时,Li⁺沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出),电解质LiPF6或LiAsF6的阴离子结构如图乙所示(X=P、As)。

①从化学键角度看,Li⁺迁移过程发生
②已知相同条件下,锂离子的迁移速率与离子键的强弱有关,则Li⁺在
③图乙中X的杂化方式最可能是
a.sp3 b.sp3d c.sp3d2 d.sp3d3
(5)Cu2O晶体结构与CsCl(图2)相似,只是利用Cu4O占据CsCl晶体中Cl的位置,而Cs位置由O原子占据,如图3所示,每个Cu2O晶胞中有
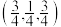 ,②处Cu原子坐标为
,②处Cu原子坐标为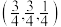 ,则③处Cu原子坐标为(___________,
,则③处Cu原子坐标为(___________,
您最近一年使用:0次
名校
5 . 中国政府承诺:力争CO2的排放在2030年前实现“碳达峰”,2060年前实现“碳中和”,CO2的捕集与利用成为当前研究的热点。回答下面问题:
(1)写出CO2的电子式______ ,CO2分子属于______ (填“极性”或“非极性”)分子,其晶体俗名干冰,属于______ 晶体,其晶体内存在的微粒间相互作用有______ 。
(2)研究发现,在CO2合成甲醇(CH3OH)反应中,Co、Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。Mn基态原子核外电子排布式为______ 。Co在周期表中属于______ 区元素。甲醇(CH3OH)能够与水任意比互溶,解释其原因是______ 。
(3)金属Zn属于金属晶体,其导电的原因是是______ 。已知金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为______ 。
(4)CaF2的晶胞结构如图所示,X代表的离子是______ ;若该立方晶胞参数为apm,CaF2的摩尔质量用Mg/mol,阿伏伽德罗常数用NA来表示,则CaF2晶体的密度=______ g/cm3(写出表达式),阴阳离子的核间距最小为______ pm。

(1)写出CO2的电子式
(2)研究发现,在CO2合成甲醇(CH3OH)反应中,Co、Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。Mn基态原子核外电子排布式为
(3)金属Zn属于金属晶体,其导电的原因是是
(4)CaF2的晶胞结构如图所示,X代表的离子是

您最近一年使用:0次
名校
解题方法
6 . 某课外活动小组利用如图所示装置探究CH4和Cl2的反应,据题意,回答下列问题:

(1)假设甲烷与氯气反应充分,且只产生一种有机物,请写出化学方程式:_______ 。
(2)若题目中甲烷与氯气的体积之比为1:1,则得到的有机产物有_______ (填化学式)。
(3)经过几个小时的反应后,U形管左端的水柱变化是_______(填字母)。
(4)CH4分子的空间构型是_______ ,其中C原子的杂化方式为_______ 。
(5)右端玻璃管的作用是_______ 。

(1)假设甲烷与氯气反应充分,且只产生一种有机物,请写出化学方程式:
(2)若题目中甲烷与氯气的体积之比为1:1,则得到的有机产物有
(3)经过几个小时的反应后,U形管左端的水柱变化是_______(填字母)。
| A.升高 | B.降低 | C.不变 | D.无法确定 |
(5)右端玻璃管的作用是
您最近一年使用:0次
7 . 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素,化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)。
(1)A、B、C的第一电离能由小到大的顺序为_______ 。
(2)B的氢化物的分子空间构型是_______ 其中心原于采取_______ 杂化。
(3)写出化合物AC2的电子式_______ ;分子空间构型是_______ ;其中心原子采取_______ 杂化。
(4)E的核外电子排市式是_______ 。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是_______ 。
(1)A、B、C的第一电离能由小到大的顺序为
(2)B的氢化物的分子空间构型是
(3)写出化合物AC2的电子式
(4)E的核外电子排市式是
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是
您最近一年使用:0次
8 . 黄铜矿(主要成分为CuFeS2)是一种天然矿石。中国在商代或更早就掌握了由它冶炼铜的技术。医药上,黄铜矿有促进骨折愈合的作用。请回答下列问题:
(1)基态Cu+比Cu2+稳定的原因是___ 。
(2)SO 的空间构型为
的空间构型为___ ,与SO 互为等电子体的离子是
互为等电子体的离子是___ (写出一种化学式即可)。
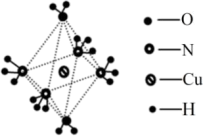
(3)图为某阳离子的结构,加热时该离子先失去的配位体是___ (填化学式),原因是___ 。
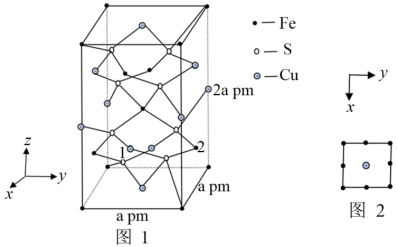
(4)四方晶系的CuFeS2晶胞结构如图1所示。
①CuFeS2中各元素电负性数值从小到大的顺序为___ ,晶胞中S原子的杂化方式为___ 。
②晶胞中Cu和Fe的投影位置如图2所示。设阿伏加德罗常数的值为NA,则该晶体的密度为___ g·cm-3。
③以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1的坐标为( ,
, ,
, ),则原子2的坐标为
),则原子2的坐标为___ 。晶体中距离Fe最近的S有___ 个。
(1)基态Cu+比Cu2+稳定的原因是
(2)SO
 的空间构型为
的空间构型为 互为等电子体的离子是
互为等电子体的离子是(3)图为某阳离子的结构,加热时该离子先失去的配位体是

(4)四方晶系的CuFeS2晶胞结构如图1所示。
①CuFeS2中各元素电负性数值从小到大的顺序为
②晶胞中Cu和Fe的投影位置如图2所示。设阿伏加德罗常数的值为NA,则该晶体的密度为
③以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1的坐标为(
 ,
, ,
, ),则原子2的坐标为
),则原子2的坐标为
您最近一年使用:0次
2021-10-05更新
|
926次组卷
|
8卷引用:河北省实验中学2022届高三年级上学期开学考试化学试题
河北省实验中学2022届高三年级上学期开学考试化学试题河北省石家庄市第二中学2022届高三补偿诊断性考试清华大学中学生标准学术能力诊断性测试2022届高三2021年7月诊断性测试化学试题(已下线)第十二章能力提升检测卷(精练)-2022年一轮复习讲练测(已下线)2021年秋季高三化学开学摸底考试卷03(广东专用)(已下线)专题十一 能力提升检测卷 (测) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)备战2022年高考化学精准检测卷【全国卷】01(已下线)专题十 物质结构与性质(选择性必修2)能力提升检测卷(测)-2023年高考化学一轮复习讲练测(新教材新高考)
名校
9 . 甲醇(CH3OH)空气氧化法是生产工业甲醛(HCHO)的常用方法。发生的反应为2CH3OH+O2 2
2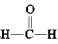 +2H2O
+2H2O
(1)C、H、O 三种元素的电负性由大到小的顺序为___________ 。
(2)H2O的中心原子上的孤电子对数为___________ 。
(3)HCHO分子内σ键与π键个数之比为___________ ,HCHO的空间结构为___________ 。
(4)CH3OH和HCHO分子中碳原子的杂化轨道类型分别为___________ 和___________ 。
(5)甲醇氧化生成HCHO时,会产生CO、CO2、CH3OCH3等副产物。相同条件下,CO2的沸点比O2的高,主要原因为___________ 。
(6)工业上利用甲醛易溶于水的性质吸收产品,解释甲醛易溶于水的原因:___________ 。
 2
2 +2H2O
+2H2O(1)C、H、O 三种元素的电负性由大到小的顺序为
(2)H2O的中心原子上的孤电子对数为
(3)HCHO分子内σ键与π键个数之比为
(4)CH3OH和HCHO分子中碳原子的杂化轨道类型分别为
(5)甲醇氧化生成HCHO时,会产生CO、CO2、CH3OCH3等副产物。相同条件下,CO2的沸点比O2的高,主要原因为
(6)工业上利用甲醛易溶于水的性质吸收产品,解释甲醛易溶于水的原因:
您最近一年使用:0次
2021-07-11更新
|
441次组卷
|
5卷引用:河北省张家口市张北县第一中学2022-2023学年高二下学期4月月考化学试题
10 . 磷、硫、氯、砷等是农药中的重要组成元素。回答下列问题:
(1)基态砷原子的核外子排布式为_______ 。
(2)生产农药的原料PSCl3中P、S、Cl的第一电离能由大到小的顺序为_______ ,电负性由大到小的顺序为_______ 。
(3)AsCl3分子的立体构型为_______ ,其中As的杂化轨道类型为_______ 。
(4)H2O与H2S为同族元素的氢化物,H2O可以形成H9O 或H3O+,而H2S几乎不能形成类似的H9S
或H3O+,而H2S几乎不能形成类似的H9S 或H3S+,其原因是
或H3S+,其原因是_______ 。
(5)AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2 000 ℃,其晶胞结构如图所示。
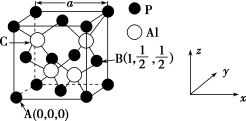
①磷化铝的晶体类型为_______ 。
②A、B点的原子坐标如图所示,则C点的原子坐标为_______ 。
③磷化铝的晶胞参数a=546.35 pm,其密度为_______ g·cm-3(列出计算式即可,用NA表示阿伏加德罗常数的值)。
(1)基态砷原子的核外子排布式为
(2)生产农药的原料PSCl3中P、S、Cl的第一电离能由大到小的顺序为
(3)AsCl3分子的立体构型为
(4)H2O与H2S为同族元素的氢化物,H2O可以形成H9O
 或H3O+,而H2S几乎不能形成类似的H9S
或H3O+,而H2S几乎不能形成类似的H9S 或H3S+,其原因是
或H3S+,其原因是(5)AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2 000 ℃,其晶胞结构如图所示。

①磷化铝的晶体类型为
②A、B点的原子坐标如图所示,则C点的原子坐标为
③磷化铝的晶胞参数a=546.35 pm,其密度为
您最近一年使用:0次
2021-04-22更新
|
395次组卷
|
3卷引用:河北省衡水市第二中学2021-2022学年高二下学期期中考试化学试题



