解题方法
1 . 我国科学家研究发现,常温常压下,铁基离子液体 在工业尾气中
在工业尾气中 、
、 等的脱除方面具有良好的性能。
等的脱除方面具有良好的性能。 结构如图所示。
结构如图所示。 中C原子的杂化轨道类型有
中C原子的杂化轨道类型有___________ 。在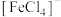 中,配体为
中,配体为___________ ,配位数为___________ 。
(2)在一定条件下 还可以转化为较稳定的
还可以转化为较稳定的
 中σ键与π键的个数比为
中σ键与π键的个数比为___________ , 的电子式为
的电子式为___________ 。
(3) 与
与 反应生成具有特征蓝色的物质X,这是实验室中检验
反应生成具有特征蓝色的物质X,这是实验室中检验 的常用方法。
的常用方法。
①科学家通过最常用的___________ 实验测定了物质X的晶体结构,其晶胞如图b所示(未表示 ),图a表示晶胞的
),图a表示晶胞的 结构(未表示K+)。
结构(未表示K+)。___________ 。
③若A处粒子的坐标参数为(0,0,0),B处粒子为(1,1,1),则C处粒子的坐标为___________ 。
④已知物质X的摩尔质量为 ,晶胞中
,晶胞中 与
与 的最小距离为dnm,阿伏加德罗常数为
的最小距离为dnm,阿伏加德罗常数为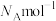 。则该晶胞中两个
。则该晶胞中两个 之间的最短距离为
之间的最短距离为___________ nm,晶体的密度为___________  。
。
 在工业尾气中
在工业尾气中 、
、 等的脱除方面具有良好的性能。
等的脱除方面具有良好的性能。 结构如图所示。
结构如图所示。
 中C原子的杂化轨道类型有
中C原子的杂化轨道类型有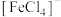 中,配体为
中,配体为(2)在一定条件下
 还可以转化为较稳定的
还可以转化为较稳定的
 中σ键与π键的个数比为
中σ键与π键的个数比为 的电子式为
的电子式为(3)
 与
与 反应生成具有特征蓝色的物质X,这是实验室中检验
反应生成具有特征蓝色的物质X,这是实验室中检验 的常用方法。
的常用方法。①科学家通过最常用的
 ),图a表示晶胞的
),图a表示晶胞的 结构(未表示K+)。
结构(未表示K+)。
③若A处粒子的坐标参数为(0,0,0),B处粒子为(1,1,1),则C处粒子的坐标为
④已知物质X的摩尔质量为
 ,晶胞中
,晶胞中 与
与 的最小距离为dnm,阿伏加德罗常数为
的最小距离为dnm,阿伏加德罗常数为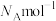 。则该晶胞中两个
。则该晶胞中两个 之间的最短距离为
之间的最短距离为 。
。
您最近一年使用:0次
名校
解题方法
2 . 近日,由蒋华良院士和饶子和院士领衔的联合课题组,综合利用虚拟筛选和酶学测试相结合的策略进行药物筛选,发现肉桂硫胺是抗击新型冠状病毒的潜在用药,其合成路线如下:
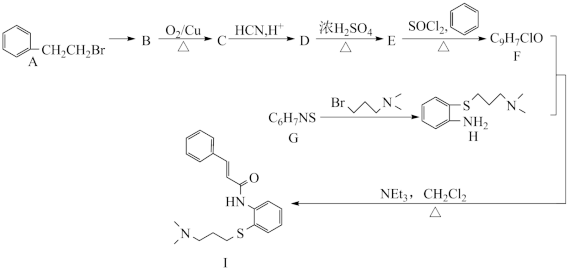

已知:I.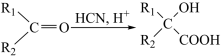
II.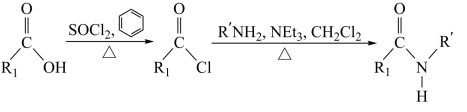
(1)A中碳原子杂化方式为___________ 。
(2)B反应生成C的化学方程式___________
(3)D生成E的反应类型___________ 。
(4)G结构简式为___________ 。
(5)写出符合下列条件的E的任一种 同分异构体的结构简式___________ 。
I.具有两个取代基的芳香族化合物
II.酸性条件下水解,水解产物遇到 溶液显紫色
溶液显紫色
III.核磁共振氢谱显示苯环上有四种化学环境的氢
(6)乙酰苯胺(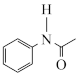 ),
),参照 I 的上述合成路线 和下面的信息,设计一条由苯和乙酸为起始原料制备乙酰苯胺的合成路线:___________ 。
(已知: ,无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)
,无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)


已知:I.
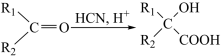
II.

(1)A中碳原子杂化方式为
(2)B反应生成C的化学方程式
(3)D生成E的反应类型
(4)G结构简式为
(5)写出符合下列条件的E的
I.具有两个取代基的芳香族化合物
II.酸性条件下水解,水解产物遇到
 溶液显紫色
溶液显紫色III.核磁共振氢谱显示苯环上有四种化学环境的氢
(6)乙酰苯胺(
 ),
),(已知:
 ,无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)
,无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)
您最近一年使用:0次
解题方法
3 . 第Ⅷ族元素铁、钴、镍性质相似,称为铁系元素。单质及其化合物在生命科学、工业生产等领域有着重要的应用。回答下列问题。
(1)卟吩分子中所有原子共平面,具有独特的电子结构,其结构如图1。血红素是由中心 与配体卟吩衍生物结合成的大环配位化合物,其结构如图2。
与配体卟吩衍生物结合成的大环配位化合物,其结构如图2。

卟吩分子中N原子采取___________ 杂化,血红素中心离子的配位数为___________ ,血红素中含有的化学键有___________ (填序号)。
a.离子键 b.共价键 c.氢键 d.配位键 e.金属键
(2)某种半导体NiO具有NaCl型结构(如图),其晶胞参数为a pm。

①已知阿伏伽德罗常数为 ,则NiO晶体的摩尔体积
,则NiO晶体的摩尔体积
___________  。(列出算式)
。(列出算式)
②NiO晶体中部分O原子被N原子替代后可以改善半导体的性能, 键中离子键成分的百分数小于
键中离子键成分的百分数小于 键,原因是
键,原因是___________ 。
③若该晶胞中氧原子有25%被氮原子替代,则该晶体的化学式为___________ ;N所替代的O的位置可能是___________ 。
(1)卟吩分子中所有原子共平面,具有独特的电子结构,其结构如图1。血红素是由中心
 与配体卟吩衍生物结合成的大环配位化合物,其结构如图2。
与配体卟吩衍生物结合成的大环配位化合物,其结构如图2。
卟吩分子中N原子采取
a.离子键 b.共价键 c.氢键 d.配位键 e.金属键
(2)某种半导体NiO具有NaCl型结构(如图),其晶胞参数为a pm。

①已知阿伏伽德罗常数为
 ,则NiO晶体的摩尔体积
,则NiO晶体的摩尔体积
 。(列出算式)
。(列出算式)②NiO晶体中部分O原子被N原子替代后可以改善半导体的性能,
 键中离子键成分的百分数小于
键中离子键成分的百分数小于 键,原因是
键,原因是③若该晶胞中氧原子有25%被氮原子替代,则该晶体的化学式为
您最近一年使用:0次
2023-07-11更新
|
96次组卷
|
2卷引用:山西省运城市2022-2023学年高二下学期期末考试化学试题
名校
解题方法
4 . 中科院大连化学物理研究所科学家用Ni-BaH3/Al2O3、Ni-LiH等作催化剂,实现了在常压、100~300℃的条件下合成氨,这一成果发表在《Nature Energy》杂志上。
(1)基态 的核外电子排布式为
的核外电子排布式为___________ ,若该离子核外电子空间运动状态有15种,则该离子处于___________ (填“基”或“激发”)态。
(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(NH2CH2COOH)是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
①硝酸溶液中 的空间构型为
的空间构型为___________ 。
②甘氨酸中C原子的杂化方式为___________ ,晶体类型是___________ ,其熔、沸点远高于相对分子质量几乎相等的丙酸(熔点为-21℃,沸点为141℃)的主要原因:一是甘氨酸能形成内盐;二是___________ 。
(3)NH3分子中的键角为107°,但在 中NH3分子的键角如图1所示,导致这种变化的原因是
中NH3分子的键角如图1所示,导致这种变化的原因是___________ 。
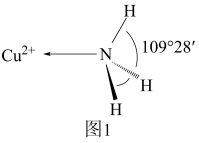
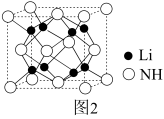
(4)亚氨基锂(Li2NH)是一种储氢容量高、安全性能好的固体储氢材料,其晶胞结构如图2所示,若晶胞参数为dpm,密度为ρg/cm3,则阿伏加德罗常数
___________  (列出表达式)。
(列出表达式)。
(1)基态
 的核外电子排布式为
的核外电子排布式为(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(NH2CH2COOH)是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
①硝酸溶液中
 的空间构型为
的空间构型为②甘氨酸中C原子的杂化方式为
(3)NH3分子中的键角为107°,但在
 中NH3分子的键角如图1所示,导致这种变化的原因是
中NH3分子的键角如图1所示,导致这种变化的原因是
(4)亚氨基锂(Li2NH)是一种储氢容量高、安全性能好的固体储氢材料,其晶胞结构如图2所示,若晶胞参数为dpm,密度为ρg/cm3,则阿伏加德罗常数

 (列出表达式)。
(列出表达式)。
您最近一年使用:0次
2023-07-07更新
|
84次组卷
|
3卷引用:山西省怀仁市第一中学校2022-2023学年高二下学期期末考试理综化学试题
5 . 氨基吡啶与铜等金属离子所形成的配合物具备良好的磁学性质,某氨基吡啶衍生物铜配合物X的结构简式如图所示。
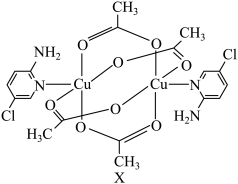
(1)基态氯原子的价层电子排布图为______ ;下列不同状态的氮原子中,能量最高的是______ (填字母)。
A. B.
B.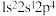 C.
C.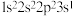 D.
D.
(2)C、N、O元素原子的电负性由大到小的顺序为______ 。
(3)X中 的配位数是
的配位数是______ ;铜元素有不同价态氧化物,高温下稳定性
______ CuO(填“大于”或“小于”),从离子的电子层结构角度分析,主要原因是______ 。
(4)X中N原子的杂化方式为______ 。
(5)下列关于X的说法中不正确的是______(填字母)。

(1)基态氯原子的价层电子排布图为
A.
 B.
B.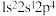 C.
C.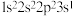 D.
D.
(2)C、N、O元素原子的电负性由大到小的顺序为
(3)X中
 的配位数是
的配位数是
(4)X中N原子的杂化方式为
(5)下列关于X的说法中不正确的是______(填字母)。
A.存在大π键 |
| B.存在氢键、配位键等化学键 |
| C.碳、氧原子间形成的σ键和π键个数比为2∶1 |
| D.铜属于d区元素 |
您最近一年使用:0次
2023-07-06更新
|
80次组卷
|
2卷引用:山西省怀仁市第十一中学校2022-2023学年高二下学期7月期末化学试题
名校
解题方法
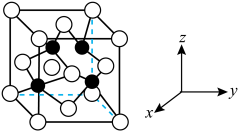
6 . 半导体晶体是半导体工业的主要基础原料,第一代半导体代表材料是锗(Ge)单晶和硅单晶(Si),他们的出现实现了超大规模集成电路,第二代砷化镓(GaAs)等化合物半导体制成的激光器成为光通信系统中的关键器件,氮化硼(BN)、碳化硅(SiC)、金刚石等属于第三代半导体材料,又被称为高温半导体材料。
(1) 的价电子排布式为
的价电子排布式为___________ 。
(2)石墨型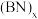 转变为金刚石型
转变为金刚石型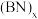 时,
时, 原子的杂化轨道类型由
原子的杂化轨道类型由___________ 变为___________ 。金刚石型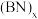 的硬度比金刚石大,推测其原因是
的硬度比金刚石大,推测其原因是___________ 。
(3)磷酸和亚磷酸 是磷元素的两种含氧酸。亚磷酸与
是磷元素的两种含氧酸。亚磷酸与 反应只生成
反应只生成 和
和 两种盐,则
两种盐,则 的结构式为
的结构式为___________ ,其为___________ 元酸
(4)下图为Ga和N形成的某种晶体的晶胞,该晶体也为高温半导体材料。其中黑色的球为Ga,白色球为N,该晶体的化学式为___________ 。若晶胞密度为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则两个最近的Ga之间的距离为
,则两个最近的Ga之间的距离为___________ 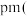 列出计算表达式
列出计算表达式 。
。
(1)
 的价电子排布式为
的价电子排布式为(2)石墨型
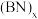 转变为金刚石型
转变为金刚石型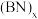 时,
时, 原子的杂化轨道类型由
原子的杂化轨道类型由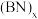 的硬度比金刚石大,推测其原因是
的硬度比金刚石大,推测其原因是(3)磷酸和亚磷酸
 是磷元素的两种含氧酸。亚磷酸与
是磷元素的两种含氧酸。亚磷酸与 反应只生成
反应只生成 和
和 两种盐,则
两种盐,则 的结构式为
的结构式为(4)下图为Ga和N形成的某种晶体的晶胞,该晶体也为高温半导体材料。其中黑色的球为Ga,白色球为N,该晶体的化学式为
 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则两个最近的Ga之间的距离为
,则两个最近的Ga之间的距离为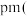 列出计算表达式
列出计算表达式 。
。
您最近一年使用:0次
2023-07-06更新
|
50次组卷
|
2卷引用:山西省应县第一中学校2022-2023学年高二下学期7月期末考试化学试题
解题方法
7 . 氧化镓是一种新型超宽窄带半导体材料,由于自身的优异性能,在紫外探测、高频功率器件等领域吸引了越来越多的关注和研究,中国科技部将其列入“十四五研发计划”,让第四代半导体获得更广泛的关注。回答下列问题:
(1)基态 原子最外层电子排布式为
原子最外层电子排布式为_______ 。
(2)①氧化镓的熔点为1740℃,氧化钙的熔点为2613℃,但有的离子晶体如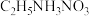 (硝酸乙基铵)的熔点只有12℃。
(硝酸乙基铵)的熔点只有12℃。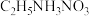 中N原子的杂化轨道类型是
中N原子的杂化轨道类型是_______ , 离子的空间结构为
离子的空间结构为_______ ,该物质中所含化学键类型:_______ (填字母)。
A.金属键 B.离子键 C.共价键 D.范德华力 E.σ键
②第一电离能:Al_______ Mg(填“>”或“<”),其原因是_______ 。
(3)锑化物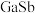 是一种超窄禁带半导体材料,可用于红外探测其晶胞结构如图所示。若该晶体的密度为
是一种超窄禁带半导体材料,可用于红外探测其晶胞结构如图所示。若该晶体的密度为 ,设Ga和Sb的原子半径分别为
,设Ga和Sb的原子半径分别为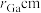 和
和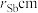 ,则原子的空间占有率为
,则原子的空间占有率为_______  (列出计算表达式,
(列出计算表达式,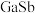 的摩尔质量为
的摩尔质量为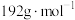 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 )。
)。

(1)基态
 原子最外层电子排布式为
原子最外层电子排布式为(2)①氧化镓的熔点为1740℃,氧化钙的熔点为2613℃,但有的离子晶体如
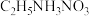 (硝酸乙基铵)的熔点只有12℃。
(硝酸乙基铵)的熔点只有12℃。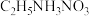 中N原子的杂化轨道类型是
中N原子的杂化轨道类型是 离子的空间结构为
离子的空间结构为A.金属键 B.离子键 C.共价键 D.范德华力 E.σ键
②第一电离能:Al
(3)锑化物
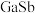 是一种超窄禁带半导体材料,可用于红外探测其晶胞结构如图所示。若该晶体的密度为
是一种超窄禁带半导体材料,可用于红外探测其晶胞结构如图所示。若该晶体的密度为 ,设Ga和Sb的原子半径分别为
,设Ga和Sb的原子半径分别为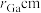 和
和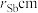 ,则原子的空间占有率为
,则原子的空间占有率为 (列出计算表达式,
(列出计算表达式,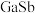 的摩尔质量为
的摩尔质量为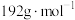 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
8 . 锂、铁、铬、卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题。
(1)Fe在元素周期表中的位置为_______ ,位于_______ 区,有_______ 个不同运动状态的价电子,最高能层中电子所占据的原子轨道呈_______ 形。
(2)C、N、O、F都是第二周期的典型非金属元素,下列说法不正确的是_______(填标号)。
(3)固态氟化氢中存在 形式,画出
形式,画出 的链状结构
的链状结构_______ 。
(4)下列Li原子轨道表示式表示的状态中,能量最低和最高的分别为_______ 、_______ (填字母)。
A.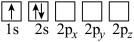 B.
B.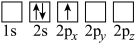
C. D.
D.
(5)①对于基态Cr原子,下列叙述正确的是_______ (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为
B.4s电子能量较高,一定在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
② 、
、 以及分子
以及分子 的空间结构和相应的键角如下图所示。
的空间结构和相应的键角如下图所示。
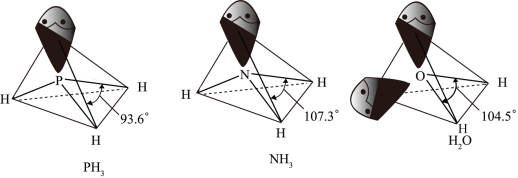
 中P的杂化类型是
中P的杂化类型是_______ , 的键角小于
的键角小于 的分析原因:
的分析原因:_______ 。
(1)Fe在元素周期表中的位置为
(2)C、N、O、F都是第二周期的典型非金属元素,下列说法不正确的是_______(填标号)。
| A.第一电离能:C<N<O<F |
| B.原子半径:C>N>O>F |
| C.最简单气态氢化物的热稳定性:N<O<F |
| D.元素的最高正价:C<N<O |
 形式,画出
形式,画出 的链状结构
的链状结构(4)下列Li原子轨道表示式表示的状态中,能量最低和最高的分别为
A.
 B.
B.
C.
 D.
D.
(5)①对于基态Cr原子,下列叙述正确的是
A.轨道处于半充满时体系总能量低,核外电子排布应为

B.4s电子能量较高,一定在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
②
 、
、 以及分子
以及分子 的空间结构和相应的键角如下图所示。
的空间结构和相应的键角如下图所示。
 中P的杂化类型是
中P的杂化类型是 的键角小于
的键角小于 的分析原因:
的分析原因:
您最近一年使用:0次
解题方法
9 . 金属钼(Mo)常用于工业、军事等领域,已被多个国家列为战略金属,我国的钼储量居世界第二。已知钼在元素周期表中呈现的信息为
(1)钼位于元素周期表的位置是_______ ,基态Mo原子核外有_______ 种不同运动状态的电子,其核外电子排布式是_______ 。
(2)辉钼( )在纳米电子设备制造领域比硅或富勒烯(如Co)更有优势,可用
)在纳米电子设备制造领域比硅或富勒烯(如Co)更有优势,可用 硫化
硫化 溶液生产辉钼。O、N、S的第一电离能由大到小的顺序为
溶液生产辉钼。O、N、S的第一电离能由大到小的顺序为_______ , 中心原子的杂化轨道类型为
中心原子的杂化轨道类型为_______ 。
(3) 纳米粒子具有类似于石墨的层状结构,具有优异的润滑性能,其原因是
纳米粒子具有类似于石墨的层状结构,具有优异的润滑性能,其原因是_______ 。
(4)Mo能与CO形成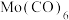 的配合物,其中Mo的化合价为
的配合物,其中Mo的化合价为_______ ,其配体分子与 具有相似的化学结构,则该配体分子中σ键与π键数目之比为
具有相似的化学结构,则该配体分子中σ键与π键数目之比为_______ 。
(5)金属钼晶体中的原子堆积方式如图所示,这种堆积方式为_______ 堆积。若晶体钼的密度为 ,钼原子半径为r pm,
,钼原子半径为r pm, 表示阿伏加德罗常数的值,M表示钼的相对原子质量,则钼晶胞中原子的空间利用率为
表示阿伏加德罗常数的值,M表示钼的相对原子质量,则钼晶胞中原子的空间利用率为_______ (用含有ρ、r、 、M的代数式表示)。
、M的代数式表示)。

(1)钼位于元素周期表的位置是
(2)辉钼(
 )在纳米电子设备制造领域比硅或富勒烯(如Co)更有优势,可用
)在纳米电子设备制造领域比硅或富勒烯(如Co)更有优势,可用 硫化
硫化 溶液生产辉钼。O、N、S的第一电离能由大到小的顺序为
溶液生产辉钼。O、N、S的第一电离能由大到小的顺序为 中心原子的杂化轨道类型为
中心原子的杂化轨道类型为(3)
 纳米粒子具有类似于石墨的层状结构,具有优异的润滑性能,其原因是
纳米粒子具有类似于石墨的层状结构,具有优异的润滑性能,其原因是(4)Mo能与CO形成
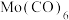 的配合物,其中Mo的化合价为
的配合物,其中Mo的化合价为 具有相似的化学结构,则该配体分子中σ键与π键数目之比为
具有相似的化学结构,则该配体分子中σ键与π键数目之比为(5)金属钼晶体中的原子堆积方式如图所示,这种堆积方式为
 ,钼原子半径为r pm,
,钼原子半径为r pm, 表示阿伏加德罗常数的值,M表示钼的相对原子质量,则钼晶胞中原子的空间利用率为
表示阿伏加德罗常数的值,M表示钼的相对原子质量,则钼晶胞中原子的空间利用率为 、M的代数式表示)。
、M的代数式表示)。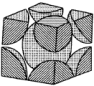
您最近一年使用:0次
2022-05-28更新
|
251次组卷
|
3卷引用:山西运城盐湖五中2023-2024学年高三上学期期末考试化学试题
解题方法
10 . 铜及其化合物在科学研究和工农业生产中有许多用途。回答下列问题:
(1)[Cu(NH3)2]Ac溶液可以吸收合成氨中对催化剂有毒害的CO气体[醋酸根(CH3COO-)简写成Ac-],反应的化学方程式为:[Cu(NH3)2]Ac+CO+NH3 [Cu(NH3)3CO]Ac。
[Cu(NH3)3CO]Ac。
①基态Cu+的核外电子排布式为_____ 。
②CH3COO-中C原子的杂化轨道类型为_____ 。
③[Cu(NH3)2]Ac中所含非金属元素的电负性由大到小的顺序是_____ (用元素符号表示)。
④[Cu(NH3)2]+中N原子形成的H—N—H键角_____ (填“大于”“小于”或“等于”)气态NH3中的键角,原因是_____ 。
⑤1个[Cu(NH3)3CO]+中含有的共价键数为_____ 。
(2)Cu—Mn—Al合金为磁性形状记忆合金材料之一,其晶胞结构如图所示:
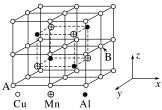
①合金的化学式为_____ 。
②若A原子的坐标参数为(0,1,0),则B原子的坐标参数为_____ 。
③已知该合金晶体的密度为ρg·cm-3,则最近的两个Al原子间的距离为_____ nm(阿伏加德罗常数的值用NA表示)。
(1)[Cu(NH3)2]Ac溶液可以吸收合成氨中对催化剂有毒害的CO气体[醋酸根(CH3COO-)简写成Ac-],反应的化学方程式为:[Cu(NH3)2]Ac+CO+NH3
 [Cu(NH3)3CO]Ac。
[Cu(NH3)3CO]Ac。①基态Cu+的核外电子排布式为
②CH3COO-中C原子的杂化轨道类型为
③[Cu(NH3)2]Ac中所含非金属元素的电负性由大到小的顺序是
④[Cu(NH3)2]+中N原子形成的H—N—H键角
⑤1个[Cu(NH3)3CO]+中含有的共价键数为
(2)Cu—Mn—Al合金为磁性形状记忆合金材料之一,其晶胞结构如图所示:

①合金的化学式为
②若A原子的坐标参数为(0,1,0),则B原子的坐标参数为
③已知该合金晶体的密度为ρg·cm-3,则最近的两个Al原子间的距离为
您最近一年使用:0次



