2022·天津·模拟预测
解题方法
1 . 硫代硫酸钠( )可用作照相业的定影剂,使胶片或相纸表面覆着的溴化银溶解,其反应的化学方程式为:
)可用作照相业的定影剂,使胶片或相纸表面覆着的溴化银溶解,其反应的化学方程式为: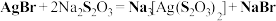 。下列说法正确的是
。下列说法正确的是
 )可用作照相业的定影剂,使胶片或相纸表面覆着的溴化银溶解,其反应的化学方程式为:
)可用作照相业的定影剂,使胶片或相纸表面覆着的溴化银溶解,其反应的化学方程式为: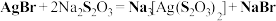 。下列说法正确的是
。下列说法正确的是A.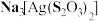 属于强电解质, 属于强电解质,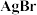 属于非电解质 属于非电解质 |
B.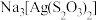 中含有离子键、共价键 中含有离子键、共价键 |
| C.pH越小,越有利于上述反应进行 |
D.可用硝酸银溶液检验 中的阴离子 中的阴离子 |
您最近一年使用:0次
解题方法
2 . 元素的性质与其在周期表中的位置密切相关,回答下列问题:
(1)焰色实验是检测金属元素常用的方法,下列元素不能用焰色实验检测的是____ 。
(2)如表是Fe和Cu的部分数据,I2(Cu)____ I2(Fe)(填“>”或“<”)。
(3)磷酸亚铁锂电池的新能源汽车对减少二氧化碳排放和大气污染具有重要意义。工业上用FeCl3、NH4H2PO4、LiCl及苯胺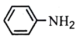 为原料制磷酸亚铁锂电池材料。NH
为原料制磷酸亚铁锂电池材料。NH 的空间构型为
的空间构型为____ ;PO 中P的杂化轨道类型是
中P的杂化轨道类型是____ ;O、P、Cl原子的半径最大的是____ 。(填元素符号)
(4)如图是CuSO4•5H2O结构式,CuSO4•5H2O中Cu2+的配位数是____ 。
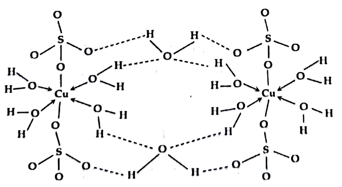
(5)如图是CuSO4•5H2O晶胞的结构图,一个晶胞中有____ 个CuSO4•5H2O。
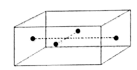
(6)用硫酸铜晶体(CuSO4•5H2O相对分子质量为250)配制0.10mol/L的硫酸铜溶液1000mL时,应称取晶体____ g。
(1)焰色实验是检测金属元素常用的方法,下列元素不能用焰色实验检测的是
| A.Fe | B.Cu | C.Ba | D.Ca |
| 元素 | 核外电子排布式 | 第一电离能I1(kJ·mol-1) | 第二电离能I2(kJ·mol-1) |
| Fe | [Ar]3d64s2 | 762 | |
| Cu | [Ar]3d104s1 | 746 |
 为原料制磷酸亚铁锂电池材料。NH
为原料制磷酸亚铁锂电池材料。NH 的空间构型为
的空间构型为 中P的杂化轨道类型是
中P的杂化轨道类型是(4)如图是CuSO4•5H2O结构式,CuSO4•5H2O中Cu2+的配位数是

(5)如图是CuSO4•5H2O晶胞的结构图,一个晶胞中有

(6)用硫酸铜晶体(CuSO4•5H2O相对分子质量为250)配制0.10mol/L的硫酸铜溶液1000mL时,应称取晶体
您最近一年使用:0次
名校
解题方法
3 . 铜及其化合物在科学研究和工业生产中具有许多用途。回答下列问题:
(1) 中阳离子的基态核外电子排布式为
中阳离子的基态核外电子排布式为___________ ;Cu和Ni在元素周期表中的位置相邻,Ni在元素周期表中的位置是___________ 。
(2)将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体 。乙醇分子中C原子的杂化轨道类型为
。乙醇分子中C原子的杂化轨道类型为___________ ; 能与
能与 以配位键形成
以配位键形成 ,则
,则 的空间构型是
的空间构型是___________ 。 中存在的化学键除了极性共价键外,还有
中存在的化学键除了极性共价键外,还有___________ 。 极易溶于水的原因主要有两个,一是
极易溶于水的原因主要有两个,一是___________ ,二是___________ 。
(3) 溶液中加入过量KCN溶液能生成配离子
溶液中加入过量KCN溶液能生成配离子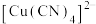 ,1mol
,1mol  中含有的
中含有的 键数目为
键数目为___________ ,与 互为等电子体的离子有
互为等电子体的离子有___________ 写出一种即可。
(4)已知ZnS的晶胞如图所示, 的配位数为
的配位数为___________ 。若晶体密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶胞参数为
,则晶胞参数为___________ (用含 、
、 的代数式表示)nm。
的代数式表示)nm。

(1)
 中阳离子的基态核外电子排布式为
中阳离子的基态核外电子排布式为(2)将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体
 。乙醇分子中C原子的杂化轨道类型为
。乙醇分子中C原子的杂化轨道类型为 能与
能与 以配位键形成
以配位键形成 ,则
,则 的空间构型是
的空间构型是 中存在的化学键除了极性共价键外,还有
中存在的化学键除了极性共价键外,还有 极易溶于水的原因主要有两个,一是
极易溶于水的原因主要有两个,一是(3)
 溶液中加入过量KCN溶液能生成配离子
溶液中加入过量KCN溶液能生成配离子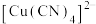 ,1mol
,1mol  中含有的
中含有的 键数目为
键数目为 互为等电子体的离子有
互为等电子体的离子有(4)已知ZnS的晶胞如图所示,
 的配位数为
的配位数为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶胞参数为
,则晶胞参数为 、
、 的代数式表示)nm。
的代数式表示)nm。
您最近一年使用:0次
名校
解题方法
4 . 2022年春晚中舞蹈诗剧《只此青绿》感动国人。回答下列问题:
(1)石青,化学式为Cu3(CO3)2(OH)2,基态Cu2+核外电子的空间运动状态有_______ 种。
(2)亚铁氰化钾,化学式为K4[Fe(CN)6]。[Fe(CN)6]4-中配体CN-的配位原子是_______ (填元素符号),CN-中C原子的杂化方式_______ ,[Fe(CN)6]4-中σ键和π键的数目之比为_______ 。
(3)Cu2S晶胞中S2-的位置如图1所示,侧视图如图2所示,Cu+位于S2-所构成的四面体中心。

Cu+填充了晶胞中四面体空隙的百分率是_______ ,S2-配位数为_______ 。若晶胞参数a nm,晶体的密度为dg·cm-3,则阿伏加德罗常数的值为_______ (用含a和d的式子表示)。
(4)Cu2+可与H2O、Cl-、NH3等配体形成配位数为4的配离子,如[Cu(H2O)4]2+、[CuCl4]2-、[Cu(NH3)4]2+。某同学按如下步骤完成实验:

①[Cu(H2O)4]2+呈蓝色,但溶液Ⅰ却呈黄绿色,其原因是_______ ,为了能观察到溶液Ⅰ中[Cu(H2O)4]2+呈蓝色,可采取的方法是_______ 。
②CuCl2溶液中的铜主要以[Cu(H2O)4]2+、[CuCl4]2-形式存在。常温下,将CuCl2溶于浓盐酸中,测定平衡体系中:[Cu(H2O)4]2+浓度为a mol•L-1、Cl-浓度为b mol•L-1、[CuCl4]2-浓度为c mol•L-1,Cl-的转化率为_______ (用a、b、c中的字母表示)。
③常温下,用惰性电极电解浓度较大的CuCl2溶液,当电解到阴极附近出现蓝色Cu(OH)2絮状物,经测定阴极附近溶液的pH=m,此时阴极附近c(Cu2+)=_______ mol•L-1 (已知:Cu(OH)2的Ksp=2.2×10-20)
④向溶液Ⅱ中通入NH3至过量观察到的现象是_______ 。
(1)石青,化学式为Cu3(CO3)2(OH)2,基态Cu2+核外电子的空间运动状态有
(2)亚铁氰化钾,化学式为K4[Fe(CN)6]。[Fe(CN)6]4-中配体CN-的配位原子是
(3)Cu2S晶胞中S2-的位置如图1所示,侧视图如图2所示,Cu+位于S2-所构成的四面体中心。

Cu+填充了晶胞中四面体空隙的百分率是
(4)Cu2+可与H2O、Cl-、NH3等配体形成配位数为4的配离子,如[Cu(H2O)4]2+、[CuCl4]2-、[Cu(NH3)4]2+。某同学按如下步骤完成实验:

①[Cu(H2O)4]2+呈蓝色,但溶液Ⅰ却呈黄绿色,其原因是
②CuCl2溶液中的铜主要以[Cu(H2O)4]2+、[CuCl4]2-形式存在。常温下,将CuCl2溶于浓盐酸中,测定平衡体系中:[Cu(H2O)4]2+浓度为a mol•L-1、Cl-浓度为b mol•L-1、[CuCl4]2-浓度为c mol•L-1,Cl-的转化率为
③常温下,用惰性电极电解浓度较大的CuCl2溶液,当电解到阴极附近出现蓝色Cu(OH)2絮状物,经测定阴极附近溶液的pH=m,此时阴极附近c(Cu2+)=
④向溶液Ⅱ中通入NH3至过量观察到的现象是
您最近一年使用:0次
2022-05-12更新
|
366次组卷
|
2卷引用:天津市和平区2022届高三第二次质量调查化学试题
解题方法
5 . 金属及其化合物在生产生活中有着广泛应用。回答下列问题:
(1)锰、锝、铼位于同一副族且原子序数依次增大。类比锰,写出基态锝原子价层电子排布式_______ 。
(2)下列状态的铁中,电离最外层的一个电子所需能量最大的是_______(填编号),
(3) 溶于浓氨水的化学方程式为:
溶于浓氨水的化学方程式为:
①氨水中的微粒存在的化学键有_______ (填标号)
A.极性键 B.非极性键 C.氢键 D.σ键 E.π键
② 中所含非金属元素的电负性由大到小的顺序是
中所含非金属元素的电负性由大到小的顺序是_______ 。 的空间构型为
的空间构型为_______
(4) 中配位原子为
中配位原子为_______ ,提供空轨道的离子为_______ 。
(5)超硬材料氨化铂的一种晶胞如图所示。与N等距最近Pt的原子个数是_______ ,若该晶胞参数为apm,密度为 ,则阿伏加德罗常数(NA)为
,则阿伏加德罗常数(NA)为_______  (用含a、ρ的式子表示,并化成最简)。
(用含a、ρ的式子表示,并化成最简)。

(1)锰、锝、铼位于同一副族且原子序数依次增大。类比锰,写出基态锝原子价层电子排布式
(2)下列状态的铁中,电离最外层的一个电子所需能量最大的是_______(填编号),
A. | B. |
C. | D. |
 溶于浓氨水的化学方程式为:
溶于浓氨水的化学方程式为:
①氨水中的微粒存在的化学键有
A.极性键 B.非极性键 C.氢键 D.σ键 E.π键
②
 中所含非金属元素的电负性由大到小的顺序是
中所含非金属元素的电负性由大到小的顺序是 的空间构型为
的空间构型为(4)
 中配位原子为
中配位原子为(5)超硬材料氨化铂的一种晶胞如图所示。与N等距最近Pt的原子个数是
 ,则阿伏加德罗常数(NA)为
,则阿伏加德罗常数(NA)为 (用含a、ρ的式子表示,并化成最简)。
(用含a、ρ的式子表示,并化成最简)。
您最近一年使用:0次
6 . MnO2可作氨选择性催化还原法脱除NOx的催化剂。
(1)基态Mn的价层电子排布的轨道表示式是____ 。
(2)MnO2可由(NH4)2S2O8与MnSO4反应制得。S2O 的结构如图。
的结构如图。

①S2O 中S—O—O
中S—O—O____ (填“是”或“不是”)在一条直线上。
②S2O 中的O—O比H2O2中的更
中的O—O比H2O2中的更____ (填“难”或“易”)断裂。
(3)一种MnO2晶体的晶胞示意图如图,该长方体晶胞的长和宽均为anm,高为bnm。

①图中“●”代表的是____ (填“Mn”或“O”)。
②NA为阿伏加德罗常数,该晶体的密度为____ g·cm-3。
③MnO2作催化剂,氨催化还原脱除NO的一种催化机理示意图如图。

从化学键的角度解释MnO2能结合NH3的原因:____ 。该催化过程的总反应的化学方程式是____ 。
(1)基态Mn的价层电子排布的轨道表示式是
(2)MnO2可由(NH4)2S2O8与MnSO4反应制得。S2O
 的结构如图。
的结构如图。
①S2O
 中S—O—O
中S—O—O②S2O
 中的O—O比H2O2中的更
中的O—O比H2O2中的更(3)一种MnO2晶体的晶胞示意图如图,该长方体晶胞的长和宽均为anm,高为bnm。

①图中“●”代表的是
②NA为阿伏加德罗常数,该晶体的密度为
③MnO2作催化剂,氨催化还原脱除NO的一种催化机理示意图如图。

从化学键的角度解释MnO2能结合NH3的原因:
您最近一年使用:0次
2022-05-08更新
|
636次组卷
|
4卷引用:天津市新华中学2023届高三下学期第一次统一练习化学试题
7 . 下列说法正确的是
A. 能与 能与 以配位键结合 以配位键结合 |
B. 与 与 分子的空间结构均为四面体形 分子的空间结构均为四面体形 |
C. 的沸点比 的沸点比 的高,是因 的高,是因 分子间存在氢键 分子间存在氢键 |
D. 比 比 更易溶于水,是因 更易溶于水,是因 是极性键而 是极性键而 是非极性键 是非极性键 |
您最近一年使用:0次
名校
解题方法
8 . 火星岩石冲含有大量氧化物,如 、
、 ,
, 、
、 、
、 、
、 、
、 等。回答下列问题:
等。回答下列问题:
(1)下表的氧化物中偏向共价晶体的过渡晶体是___________ ;(填化学式)。
(2)基态铁元素的原子最高能级电子云轮廓为___________ 形。
(3) 与
与 溶液反应生成的
溶液反应生成的 离子中
离子中 的杂化类型是
的杂化类型是___________ ; 和O构成的空间构型是
和O构成的空间构型是___________ 。
(4)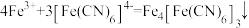 (普鲁士蓝),该反应可检验溶液中
(普鲁士蓝),该反应可检验溶液中 ,如图是普鲁士蓝
,如图是普鲁士蓝 晶胞的结构,与
晶胞的结构,与 形成配位键的是
形成配位键的是___________ (填 或
或 );
); 离子中
离子中 键与
键与 键的个数比是
键的个数比是___________ ;晶胞中与一个 距离相等的N有
距离相等的N有___________ 个。

 、
、 ,
, 、
、 、
、 、
、 、
、 等。回答下列问题:
等。回答下列问题:(1)下表的氧化物中偏向共价晶体的过渡晶体是
| 氧化物 |  |  |  |  |
| 离子键的百分数 | 62% | 50% | 41% | 33% |
(2)基态铁元素的原子最高能级电子云轮廓为
(3)
 与
与 溶液反应生成的
溶液反应生成的 离子中
离子中 的杂化类型是
的杂化类型是 和O构成的空间构型是
和O构成的空间构型是(4)
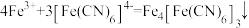 (普鲁士蓝),该反应可检验溶液中
(普鲁士蓝),该反应可检验溶液中 ,如图是普鲁士蓝
,如图是普鲁士蓝 晶胞的结构,与
晶胞的结构,与 形成配位键的是
形成配位键的是 或
或 );
); 离子中
离子中 键与
键与 键的个数比是
键的个数比是 距离相等的N有
距离相等的N有
您最近一年使用:0次
2022-05-01更新
|
324次组卷
|
2卷引用:天津市河东区2022届高三一模化学试题
名校
解题方法
9 . 实验室以CuSO4•5H2O为原料制备[Cu(NH3)4]SO4•H2O并进行定量分析。
已知:CuSO4+4NH3•H2O=[Cu(NH3)4]SO4+4H2O
[Cu(NH3)4]2++4H+=Cu2++4NH
(1)配制溶液:称取一定质量的CuSO4•5H2O晶体,放入锥形瓶中,溶解后滴加氨水,装置A如图所示(胶头滴管中吸有氨水)。
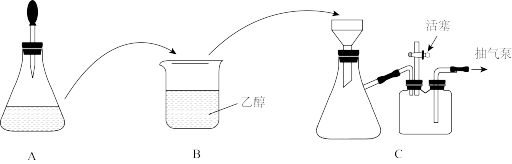
滴加氨水时,有浅蓝色沉淀Cu2(OH)2SO4生成;继续滴加氨水,沉淀消失,得到深蓝色溶液[Cu(NH3)4]SO4。用离子方程式解释由浅蓝色沉淀生成深蓝色溶液的原理:____ 。
(2)制备晶体:将装置A中溶液转移至装置B中,析出[Cu(NH3)4]SO4•H2O晶体;将装置B中混合物转移至装置C的漏斗中,减压过滤,用乙醇洗涤晶体2~3次;取出晶体,干燥。
①两次转移均需洗涤原容器,且将洗涤液也全部转移,目的是____ 。
②减压过滤时,抽气泵处于工作状态,活塞需关闭,使装置内产生负压。洗涤晶体时,为了使乙醇与晶体充分接触,提高洗涤的效果,要____ (填“打开”或“关闭”,下同)活塞后,向漏斗中加入乙醇至浸没沉淀,待乙醇流下后,再____ 活塞。
(3)废液回收:从含有[Cu(NH3)4]SO4、乙醇和一水合氨的废液中回收乙醇并获得CuSO4和(NH4)2SO4的混合溶液,应加入的试剂是____ (填名称),回收乙醇的实验方法为____ 。
(4)用沉淀法测定晶体中SO 的含量:称取一定质量的[Cu(NH3)4]SO4•H2O晶体,加适量蒸馏水溶解,向其中滴加足量
的含量:称取一定质量的[Cu(NH3)4]SO4•H2O晶体,加适量蒸馏水溶解,向其中滴加足量____ 溶液,搅拌,过滤,洗涤,干燥,称量沉淀的质量。如何检验沉淀已经洗净____ 。
(5)探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取ag试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用cmol/LEDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。滴定反应如下:Cu2++H2Y2-=CuY2-+2H+。
写出计算CuSO4·5H2O质量分数的表达式ω=____ 。
下列操作会导致CuSO4·5H2O含量的测定结果偏高的是____ 。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
已知:CuSO4+4NH3•H2O=[Cu(NH3)4]SO4+4H2O
[Cu(NH3)4]2++4H+=Cu2++4NH

(1)配制溶液:称取一定质量的CuSO4•5H2O晶体,放入锥形瓶中,溶解后滴加氨水,装置A如图所示(胶头滴管中吸有氨水)。

滴加氨水时,有浅蓝色沉淀Cu2(OH)2SO4生成;继续滴加氨水,沉淀消失,得到深蓝色溶液[Cu(NH3)4]SO4。用离子方程式解释由浅蓝色沉淀生成深蓝色溶液的原理:
(2)制备晶体:将装置A中溶液转移至装置B中,析出[Cu(NH3)4]SO4•H2O晶体;将装置B中混合物转移至装置C的漏斗中,减压过滤,用乙醇洗涤晶体2~3次;取出晶体,干燥。
①两次转移均需洗涤原容器,且将洗涤液也全部转移,目的是
②减压过滤时,抽气泵处于工作状态,活塞需关闭,使装置内产生负压。洗涤晶体时,为了使乙醇与晶体充分接触,提高洗涤的效果,要
(3)废液回收:从含有[Cu(NH3)4]SO4、乙醇和一水合氨的废液中回收乙醇并获得CuSO4和(NH4)2SO4的混合溶液,应加入的试剂是
(4)用沉淀法测定晶体中SO
 的含量:称取一定质量的[Cu(NH3)4]SO4•H2O晶体,加适量蒸馏水溶解,向其中滴加足量
的含量:称取一定质量的[Cu(NH3)4]SO4•H2O晶体,加适量蒸馏水溶解,向其中滴加足量(5)探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取ag试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用cmol/LEDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。滴定反应如下:Cu2++H2Y2-=CuY2-+2H+。
写出计算CuSO4·5H2O质量分数的表达式ω=
下列操作会导致CuSO4·5H2O含量的测定结果偏高的是
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
您最近一年使用:0次
名校
解题方法
10 . 碳族元素及其化合物在材料领域有广泛应用。
(1)冠醚是由多个二元醇分子之间失水形成的环状化合物。X、Y、Z是常见的三种冠醚,其结构如图甲所示。它们能与碱金属离子作用,并且随着环的大小不同而与不同金属离子作用。

①Li+半径与X的空腔大小相近,恰好能进入到X的环内,且与氧原子的一个孤电子对作用形成稳定结构W(如图甲)。基态碳原子核外有____ 种运动状态不同的电子,其价电子轨道表示式为____ 。W中Li+与孤电子对之间的作用属于____ (填序号)。
A.离子键 B.分子间作用力 C.氢键 D.配位键
②冠醚Y能与K+形成稳定结构,但不能与Li+形成稳定结构,理由是____ 。
③冠醚分子中C—O—C的键角____ 109°28'(填“>”“<”或“=”)。
(2)金刚石、晶体硅和碳化硅的熔点由高到低的顺序为____ (用化学式表示),金刚石的晶胞结构如图甲,晶胞边长为apm,金刚石的密度可表示为____ g/cm3。

(3)SiCl4与N-甲基咪唑( )反应可以得到M2+,其结构如图乙所示,N-甲基咪唑分子中碳原子的杂化轨道类型为
)反应可以得到M2+,其结构如图乙所示,N-甲基咪唑分子中碳原子的杂化轨道类型为____ ,1个M2+中含有____ 个σ键。

(1)冠醚是由多个二元醇分子之间失水形成的环状化合物。X、Y、Z是常见的三种冠醚,其结构如图甲所示。它们能与碱金属离子作用,并且随着环的大小不同而与不同金属离子作用。

①Li+半径与X的空腔大小相近,恰好能进入到X的环内,且与氧原子的一个孤电子对作用形成稳定结构W(如图甲)。基态碳原子核外有
A.离子键 B.分子间作用力 C.氢键 D.配位键
②冠醚Y能与K+形成稳定结构,但不能与Li+形成稳定结构,理由是
③冠醚分子中C—O—C的键角
(2)金刚石、晶体硅和碳化硅的熔点由高到低的顺序为

(3)SiCl4与N-甲基咪唑(
 )反应可以得到M2+,其结构如图乙所示,N-甲基咪唑分子中碳原子的杂化轨道类型为
)反应可以得到M2+,其结构如图乙所示,N-甲基咪唑分子中碳原子的杂化轨道类型为
您最近一年使用:0次



