2024·上海·三模
名校
解题方法
1 . 制备锂离子电池的正极材料的前体 的一种流程如下:
的一种流程如下:
ii. 可溶于水,
可溶于水, 微溶于水
微溶于水
iii.
iv.
I.制备
1.用 溶液、
溶液、 溶液分步浸取磷灰石生成HF、
溶液分步浸取磷灰石生成HF、 和
和 ,主要反应的化学方程式为
,主要反应的化学方程式为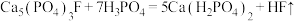 和
和
___________ 。
2.增大酸浸反应速率的措施有___________ (写1条)。
3.其他条件不变时,若仅用 溶液酸浸,浸取的速率低于用
溶液酸浸,浸取的速率低于用 、
、 分步浸取法,原因是
分步浸取法,原因是___________ 。
II.制备
将 、
、 、
、 混合并调节溶液的pH制备
混合并调节溶液的pH制备 。
。
4.酸性条件下,生成 的离子方程式是
的离子方程式是___________ 。
常温下,利用NaOH调节 溶液pH时,得到溶液中含磷各微粒的物质的量分数与pH的关系如图所示。
溶液pH时,得到溶液中含磷各微粒的物质的量分数与pH的关系如图所示。
6. 时,溶液中的
时,溶液中的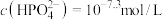 ,则
,则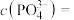
___________  ,再加入
,再加入 晶体、
晶体、 溶液使溶液中的
溶液使溶液中的 ,不考虑溶液体积的变化,通过计算说明此时能否产生
,不考虑溶液体积的变化,通过计算说明此时能否产生 沉淀
沉淀___________ 。
 的纯度及颗粒大小会影响其性能,沉淀速率过快容易团聚。
的纯度及颗粒大小会影响其性能,沉淀速率过快容易团聚。
7.研究表明,沉淀时可加入含 的溶液,
的溶液, 的作用是
的作用是___________ 。
8.配离子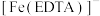 的结构如图所示,图中M代表
的结构如图所示,图中M代表 。EDTA中碳原子的杂化方式为
。EDTA中碳原子的杂化方式为___________ , 的配位数为
的配位数为___________ 。 而不是更高的pH制备
而不是更高的pH制备 ,可能的原因是
,可能的原因是___________ 、___________ (答出2点)。
 的一种流程如下:
的一种流程如下:

ii.
 可溶于水,
可溶于水, 微溶于水
微溶于水iii.

iv.

I.制备

1.用
 溶液、
溶液、 溶液分步浸取磷灰石生成HF、
溶液分步浸取磷灰石生成HF、 和
和 ,主要反应的化学方程式为
,主要反应的化学方程式为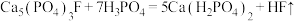 和
和
2.增大酸浸反应速率的措施有
3.其他条件不变时,若仅用
 溶液酸浸,浸取的速率低于用
溶液酸浸,浸取的速率低于用 、
、 分步浸取法,原因是
分步浸取法,原因是II.制备

将
 、
、 、
、 混合并调节溶液的pH制备
混合并调节溶液的pH制备 。
。4.酸性条件下,生成
 的离子方程式是
的离子方程式是常温下,利用NaOH调节
 溶液pH时,得到溶液中含磷各微粒的物质的量分数与pH的关系如图所示。
溶液pH时,得到溶液中含磷各微粒的物质的量分数与pH的关系如图所示。 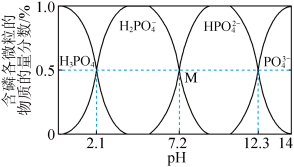
A. 的电离方程式为: 的电离方程式为: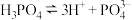 |
B.M点时,溶液中 |
C. 时,溶液 时,溶液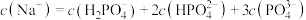 |
D. 时,溶液中水的电离程度比纯水大 时,溶液中水的电离程度比纯水大 |
 时,溶液中的
时,溶液中的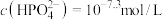 ,则
,则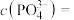
 ,再加入
,再加入 晶体、
晶体、 溶液使溶液中的
溶液使溶液中的 ,不考虑溶液体积的变化,通过计算说明此时能否产生
,不考虑溶液体积的变化,通过计算说明此时能否产生 沉淀
沉淀 的纯度及颗粒大小会影响其性能,沉淀速率过快容易团聚。
的纯度及颗粒大小会影响其性能,沉淀速率过快容易团聚。7.研究表明,沉淀时可加入含
 的溶液,
的溶液, 的作用是
的作用是8.配离子
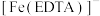 的结构如图所示,图中M代表
的结构如图所示,图中M代表 。EDTA中碳原子的杂化方式为
。EDTA中碳原子的杂化方式为 的配位数为
的配位数为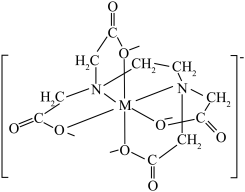
 而不是更高的pH制备
而不是更高的pH制备 ,可能的原因是
,可能的原因是
您最近半年使用:0次
2 . 铜氨溶液含有 ,具有溶解纤维素的性能,在溶解纤维素后所得溶液中再加酸时纤维素又可以沉淀析出,利用这种性质来制造人造丝。用硫酸铜溶液和氨水反应可以制得铜氨溶液。
,具有溶解纤维素的性能,在溶解纤维素后所得溶液中再加酸时纤维素又可以沉淀析出,利用这种性质来制造人造丝。用硫酸铜溶液和氨水反应可以制得铜氨溶液。
(1) 溶液呈蓝色是因为含有水合铜离子
溶液呈蓝色是因为含有水合铜离子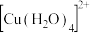 ,结构示意图如图所示:基态
,结构示意图如图所示:基态 原子核外电子排布式为
原子核外电子排布式为_______ 。
向 溶液中加入少量氨水,得到浅蓝色的碱式硫酸铜的沉淀;若继续加入氨水,沉淀溶解,得到深蓝色的含
溶液中加入少量氨水,得到浅蓝色的碱式硫酸铜的沉淀;若继续加入氨水,沉淀溶解,得到深蓝色的含 的铜氨溶液。
的铜氨溶液。
①比较键角:NH3_______ NH (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。
②该实验中, 与
与 结合能力
结合能力_______ (填“大于”“小于”或“等于”) 与
与 结合能力,解释原因:
结合能力,解释原因:_______ 。
③经实验发现:金属铜与氨水和过氧化氢的混合溶液反应也可得到 。金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是
。金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是_______ ,反应的离子方应程式为_______ 。
(3)某种铜的氯化物晶胞形状为立方体,结构如图所示。
已知该晶胞的密度为 ,阿伏加德罗常数为
,阿伏加德罗常数为 。则该晶胞的边长为
。则该晶胞的边长为_______  (列出计算式)。
(列出计算式)。
 ,具有溶解纤维素的性能,在溶解纤维素后所得溶液中再加酸时纤维素又可以沉淀析出,利用这种性质来制造人造丝。用硫酸铜溶液和氨水反应可以制得铜氨溶液。
,具有溶解纤维素的性能,在溶解纤维素后所得溶液中再加酸时纤维素又可以沉淀析出,利用这种性质来制造人造丝。用硫酸铜溶液和氨水反应可以制得铜氨溶液。(1)
 溶液呈蓝色是因为含有水合铜离子
溶液呈蓝色是因为含有水合铜离子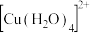 ,结构示意图如图所示:基态
,结构示意图如图所示:基态 原子核外电子排布式为
原子核外电子排布式为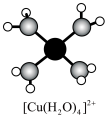
向
 溶液中加入少量氨水,得到浅蓝色的碱式硫酸铜的沉淀;若继续加入氨水,沉淀溶解,得到深蓝色的含
溶液中加入少量氨水,得到浅蓝色的碱式硫酸铜的沉淀;若继续加入氨水,沉淀溶解,得到深蓝色的含 的铜氨溶液。
的铜氨溶液。①比较键角:NH3
 (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。②该实验中,
 与
与 结合能力
结合能力 与
与 结合能力,解释原因:
结合能力,解释原因:③经实验发现:金属铜与氨水和过氧化氢的混合溶液反应也可得到
 。金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是
。金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是(3)某种铜的氯化物晶胞形状为立方体,结构如图所示。
已知该晶胞的密度为
 ,阿伏加德罗常数为
,阿伏加德罗常数为 。则该晶胞的边长为
。则该晶胞的边长为 (列出计算式)。
(列出计算式)。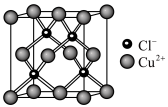
您最近半年使用:0次
2024·河北石家庄·二模
解题方法
3 . 物质的结构决定其性质。下列实例与解释不相符的是
| 选项 | 事实 | 解释 |
| A | 金属是电的良导体 | 金属晶体中的自由电子在外电场作用下发生定向移动 |
| B | NF3不易与Cu2+形成配位键 | F的电负性大,导致N原子核对其孤电子对的吸引力大 |
| C | CO的沸点高于N2 | CO的极性大于N2 |
| D |  中的键角小于 中的键角小于 | S的原子半径较大,其价层σ键电子对之间的斥力较小 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
7日内更新
|
232次组卷
|
3卷引用:化学(天津卷01)-2024年高考押题预测卷
名校
4 . I.金属催化剂M(Co、Ni)催化硼氢化钠( )水解释放
)水解释放 机理如下图所示:
机理如下图所示:

(1)过程Ⅱ中形成化学键的类型有________(填序号)。
(2) 最终会转化为
最终会转化为 ,1个
,1个 中存在
中存在________ 个配位键。
(3) 是一种重要的还原剂,其组成元素的电负性由大到小的顺序为
是一种重要的还原剂,其组成元素的电负性由大到小的顺序为________ 。
Ⅱ.过渡金属Q与镧形成的合金是一种储氢材料,其中基态Q原子的价电子排布式为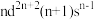 ,中子数为31,
,中子数为31,
(4)Q原子符号为________ ;基态Q原子核外成对电子数和未成对电子数之比为________ 。
Ⅲ. 、
、 是新型磁性材料的成分。依据其中有关元素回答问题:
是新型磁性材料的成分。依据其中有关元素回答问题:
(5)钕(Nd)属于镧系元素,则其在元素周期表中处于________ 区,Co元素在元素周期表中的位置________ 。
Ⅳ.分子式为 的化合物的结构如图,
的化合物的结构如图,
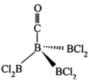
(6)其中B原子的杂化类型是________ ,B-B-B键的键角________ Cl-B-Cl的键角(填“ ”“
”“ ”或“
”或“ ”)。
”)。
 )水解释放
)水解释放 机理如下图所示:
机理如下图所示:
(1)过程Ⅱ中形成化学键的类型有________(填序号)。
| A.离子键 | B.金属键 | C.极性键 | D.非极性键 |
(2)
 最终会转化为
最终会转化为 ,1个
,1个 中存在
中存在(3)
 是一种重要的还原剂,其组成元素的电负性由大到小的顺序为
是一种重要的还原剂,其组成元素的电负性由大到小的顺序为Ⅱ.过渡金属Q与镧形成的合金是一种储氢材料,其中基态Q原子的价电子排布式为
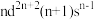 ,中子数为31,
,中子数为31,(4)Q原子符号为
Ⅲ.
 、
、 是新型磁性材料的成分。依据其中有关元素回答问题:
是新型磁性材料的成分。依据其中有关元素回答问题:(5)钕(Nd)属于镧系元素,则其在元素周期表中处于
Ⅳ.分子式为
 的化合物的结构如图,
的化合物的结构如图,
(6)其中B原子的杂化类型是
 ”“
”“ ”或“
”或“ ”)。
”)。
您最近半年使用:0次
名校
解题方法
5 . 铜、铁、锌原子结构的特殊性,决定了它们的单质及其化合物在化工生产中发挥着重要的作用,回答下列问题。
(1) 的价电子排布式为
的价电子排布式为___________ ,基态铜原子最高能级电子云轮廓图形状为___________ 。
(2)当黄铜受到氨腐蚀时,会出现“龟裂”现象,生成四氨合铜配合物。
① 中阴离子的空间构型为
中阴离子的空间构型为___________ 。
② 中
中 的键角比独立
的键角比独立 的键角
的键角___________ (填“大”“小”或“相等”),前10号元素中,第一电离能比N大的元素有___________ 种。
③铜元素会形成多种配离子, 的氨水溶液在空气中放置迅速由无色变为深蓝色,写出该过程的离子方程式:
的氨水溶液在空气中放置迅速由无色变为深蓝色,写出该过程的离子方程式:___________ 。
(3)一个配体中有两个配位原子的配体叫双齿配体, 就是一种双齿配体。
就是一种双齿配体。 的配位数是6,硫酸铁溶液中加入
的配位数是6,硫酸铁溶液中加入 后生成配离子为
后生成配离子为___________ 。(用化学符号表示)
(4)ZnS晶胞如图所示: 周围与它最接近且距离相等的
周围与它最接近且距离相等的 有
有___________ 个。
②已知该晶胞密度为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则晶胞边长为
,则晶胞边长为___________ pm。(列出计算式即可)
(1)
 的价电子排布式为
的价电子排布式为(2)当黄铜受到氨腐蚀时,会出现“龟裂”现象,生成四氨合铜配合物。
①
 中阴离子的空间构型为
中阴离子的空间构型为②
 中
中 的键角比独立
的键角比独立 的键角
的键角③铜元素会形成多种配离子,
 的氨水溶液在空气中放置迅速由无色变为深蓝色,写出该过程的离子方程式:
的氨水溶液在空气中放置迅速由无色变为深蓝色,写出该过程的离子方程式:(3)一个配体中有两个配位原子的配体叫双齿配体,
 就是一种双齿配体。
就是一种双齿配体。 的配位数是6,硫酸铁溶液中加入
的配位数是6,硫酸铁溶液中加入 后生成配离子为
后生成配离子为(4)ZnS晶胞如图所示:
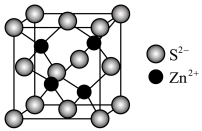
 周围与它最接近且距离相等的
周围与它最接近且距离相等的 有
有②已知该晶胞密度为
 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则晶胞边长为
,则晶胞边长为
您最近半年使用:0次
名校
解题方法
6 . 我国科学家制备了一种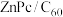 太阳电池,其结构示意图如下。
太阳电池,其结构示意图如下。___________ 区(填“s”“d”“ds”或“p”)。
(2) 分子中60个碳原子都是等价的,均以近似
分子中60个碳原子都是等价的,均以近似___________ 杂化的方式形成3个不共平面的 键,余下的1个p轨道电子互相重叠形成闭壳层电子结构,
键,余下的1个p轨道电子互相重叠形成闭壳层电子结构, 电子云分布在
电子云分布在 分子笼的内外层表面上。循环伏安测试表明:
分子笼的内外层表面上。循环伏安测试表明: 在溶液中可以逐步可逆地接受6个电子形成负离子,却很难失去电子变为阳离子。
在溶液中可以逐步可逆地接受6个电子形成负离子,却很难失去电子变为阳离子。
(3)①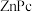 中基态
中基态 的电子排布式为
的电子排布式为___________ 。
②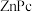 中存在配位键的原因是
中存在配位键的原因是___________ 。
(4)某溶剂中,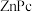 可以和
可以和 形成分子间电荷转移复合物,反应方程式可表示为:
形成分子间电荷转移复合物,反应方程式可表示为: ,不同温度下生成电荷转移复合物的平衡常数如下表。
,不同温度下生成电荷转移复合物的平衡常数如下表。
反应: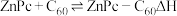
___________ 0(填“>”或。“<”), 中
中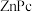 是电子
是电子___________ (填“给体”或“受体”)。
(5) 晶体结构属于氯化钠型,其晶胞结构如图所示。
晶体结构属于氯化钠型,其晶胞结构如图所示。 的熔点和沸点比
的熔点和沸点比 的高,请解释原因
的高,请解释原因___________ 。
② 晶体的密度约为
晶体的密度约为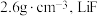 晶胞的体积约为
晶胞的体积约为___________  (列出计算式即可)。
(列出计算式即可)。
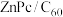 太阳电池,其结构示意图如下。
太阳电池,其结构示意图如下。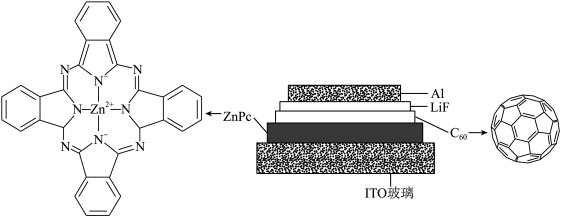
(2)
 分子中60个碳原子都是等价的,均以近似
分子中60个碳原子都是等价的,均以近似 键,余下的1个p轨道电子互相重叠形成闭壳层电子结构,
键,余下的1个p轨道电子互相重叠形成闭壳层电子结构, 电子云分布在
电子云分布在 分子笼的内外层表面上。循环伏安测试表明:
分子笼的内外层表面上。循环伏安测试表明: 在溶液中可以逐步可逆地接受6个电子形成负离子,却很难失去电子变为阳离子。
在溶液中可以逐步可逆地接受6个电子形成负离子,却很难失去电子变为阳离子。(3)①
 中基态
中基态 的电子排布式为
的电子排布式为②
 中存在配位键的原因是
中存在配位键的原因是(4)某溶剂中,
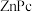 可以和
可以和 形成分子间电荷转移复合物,反应方程式可表示为:
形成分子间电荷转移复合物,反应方程式可表示为: ,不同温度下生成电荷转移复合物的平衡常数如下表。
,不同温度下生成电荷转移复合物的平衡常数如下表。| 温度 | 生成 的K 的K |
 | 1.2329 |
 | 0.9674 |
 | 0.4923 |
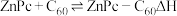
 中
中 是电子
是电子(5)
 晶体结构属于氯化钠型,其晶胞结构如图所示。
晶体结构属于氯化钠型,其晶胞结构如图所示。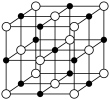
 的熔点和沸点比
的熔点和沸点比 的高,请解释原因
的高,请解释原因②
 晶体的密度约为
晶体的密度约为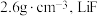 晶胞的体积约为
晶胞的体积约为 (列出计算式即可)。
(列出计算式即可)。
您最近半年使用:0次
名校
7 . 回答下列问题:
(1)钒(23V)元素价层电子的电子排布图为___________ 。第四周期末成对电子数最多的元素是___________ (填元素符号),该元素基态原子核外电子共有___________ 种不同能量的电子。
(2)丁二酮肟( )中
)中 键与
键与 键数目之比为
键数目之比为___________ 。
(3)下列关于物质结构的表述中正确的是___________ 。
①元素Br位于周期表第四周期VIIA族,核外电子排布式为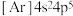 ,属于p区
,属于p区
②非极性分子往往具有高度对称性,如 、
、 、
、 、
、 分子
分子
③晶体与非晶体的本质区别为是否具有固定的熔点
④ 是极性分子,故
是极性分子,故 易溶于水
易溶于水
(4)向硫酸铜溶液中滴加浓氨水,先出现蓝色沉淀,继续滴加氨水,沉淀溶解,出现深蓝色溶液,用离子方程式解释沉淀溶解的原因:___________ 。
(5) 晶胞结构如图所示。D离子代表的是
晶胞结构如图所示。D离子代表的是___________ ,其配位数为___________ ,若晶胞参数为anm,则最近的D原子和B原子之间的距离为___________ nm。 的结构如图所示。
的结构如图所示。 结构中键角1、2、3由大到小的顺序是
结构中键角1、2、3由大到小的顺序是___________ (填序号)。
(1)钒(23V)元素价层电子的电子排布图为
(2)丁二酮肟(
 )中
)中 键与
键与 键数目之比为
键数目之比为(3)下列关于物质结构的表述中正确的是
①元素Br位于周期表第四周期VIIA族,核外电子排布式为
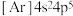 ,属于p区
,属于p区②非极性分子往往具有高度对称性,如
 、
、 、
、 、
、 分子
分子③晶体与非晶体的本质区别为是否具有固定的熔点
④
 是极性分子,故
是极性分子,故 易溶于水
易溶于水(4)向硫酸铜溶液中滴加浓氨水,先出现蓝色沉淀,继续滴加氨水,沉淀溶解,出现深蓝色溶液,用离子方程式解释沉淀溶解的原因:
(5)
 晶胞结构如图所示。D离子代表的是
晶胞结构如图所示。D离子代表的是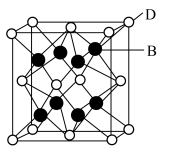
 的结构如图所示。
的结构如图所示。
 结构中键角1、2、3由大到小的顺序是
结构中键角1、2、3由大到小的顺序是
您最近半年使用:0次
名校
解题方法
8 . 金属材料对于促进生产发展、改善人类生活发挥了巨大作用。
I.钢是人类使用最早的金属之一,至今仍被广泛应用于电气、电子等领域。
(1)写出基态Cu原子的核外电子排布式___________ 。涩法冶炼是以赤铜矿( )精矿为主要原料,通过浸出、置换、电解等流程制备高坑度的工艺。
)精矿为主要原料,通过浸出、置换、电解等流程制备高坑度的工艺。
(2)赤铜矿在稀硫酸中浸出,得到硫酸铜溶液,该反应的离子方程式为___ 。
(3)已知: 晶胞为立方体形,边长为
晶胞为立方体形,边长为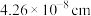 。根据图示,每个
。根据图示,每个 晶胞中含O原子的数目为
晶胞中含O原子的数目为___________ 个。计算 晶体的密度
晶体的密度
___________  (结果保留两位小数)。
(结果保留两位小数)。
(4)基态Na原子的价层电子轨道表示式为___________ 。
(5)NaCl熔点为:800.8℃,工业上采用电解熔融NaCl制备金属Na。电解反应方程式为:
 ,加入
,加入 的目的是
的目的是___________ 。
(6)除去 粉末中混有的少量
粉末中混有的少量 的方法是
的方法是___________ 。
Ⅲ.钛被誉为太空金属和亲生物金属,拥有卓越的金属特性。它在特定温度下能与多种物质发生反应,在生产和日常生活中都能找到它的踪影。
(7) 原子的价电子排布式为
原子的价电子排布式为 ,它在元素周期表中的位置是
,它在元素周期表中的位置是___________ 。
(8) 易与
易与 形成
形成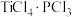 。下列关于
。下列关于 分子说法错误的是___________。
分子说法错误的是___________。
(9)钛溶于盐酸制得的三氯化钛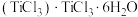 晶体有两种异构体:
晶体有两种异构体: (绿色)、
(绿色)、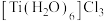 (紫色),两者配位数
(紫色),两者配位数___________ (选填“相同”或“不同”),绿色晶体中配体是___________ 。
I.钢是人类使用最早的金属之一,至今仍被广泛应用于电气、电子等领域。
(1)写出基态Cu原子的核外电子排布式
 )精矿为主要原料,通过浸出、置换、电解等流程制备高坑度的工艺。
)精矿为主要原料,通过浸出、置换、电解等流程制备高坑度的工艺。(2)赤铜矿在稀硫酸中浸出,得到硫酸铜溶液,该反应的离子方程式为
(3)已知:
 晶胞为立方体形,边长为
晶胞为立方体形,边长为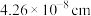 。根据图示,每个
。根据图示,每个 晶胞中含O原子的数目为
晶胞中含O原子的数目为 晶体的密度
晶体的密度
 (结果保留两位小数)。
(结果保留两位小数)。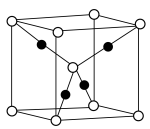
(4)基态Na原子的价层电子轨道表示式为
(5)NaCl熔点为:800.8℃,工业上采用电解熔融NaCl制备金属Na。电解反应方程式为:

 ,加入
,加入 的目的是
的目的是(6)除去
 粉末中混有的少量
粉末中混有的少量 的方法是
的方法是Ⅲ.钛被誉为太空金属和亲生物金属,拥有卓越的金属特性。它在特定温度下能与多种物质发生反应,在生产和日常生活中都能找到它的踪影。
(7)
 原子的价电子排布式为
原子的价电子排布式为 ,它在元素周期表中的位置是
,它在元素周期表中的位置是(8)
 易与
易与 形成
形成 。下列关于
。下列关于 分子说法错误的是___________。
分子说法错误的是___________。| A.键角为120° | B.是极性分子 |
C.含有 键 键 | D.中心原子采取 杂化 杂化 |
(9)钛溶于盐酸制得的三氯化钛
 晶体有两种异构体:
晶体有两种异构体: (绿色)、
(绿色)、 (紫色),两者配位数
(紫色),两者配位数
您最近半年使用:0次
2024-04-19更新
|
220次组卷
|
2卷引用:天津市红桥区2024届高三一模化学试题
9 . 配合物在许多方面有着广泛的用途,目前我国科学家利用配合物在能源转化与储存方面有着杰出的贡献,请根据题意回答下列问题:
(1)将 1 mol TiCl3·4H2O 溶于水,加入足量 AgNO3 溶液,得到 1 mol AgCl 沉淀,已知Ti3+的配位数为6,TiCl3·4H2O的化学式用配合物的形式表示为___ 。
(2)有下列实验:___ 。深蓝色晶体的化学式为___ 。
②写出蓝色沉淀溶解成深蓝色溶液的离子方程式___ 。
③[Cu(NH3)4]2+中H−N−H键角比NH3分子中H−N−H键角___ (填“大”或“小”)。[Cu(NH3)4]SO4中存在的化学键类型有___ (填标号)。
A.离子键 B.共价键 C.氢键 D.配位键
④物质在外磁场的作用下会发生磁化现象,在磁场中物质的磁性可分为顺磁性、反磁性和铁磁性,中心离子或原子上含有未成对电子的物质具有顺磁性,下列配离子中具有顺磁性的是___ (填标号)。
A.[Cr(OH)4] − B.[Cu(CN)4]3− C.[ZnCl4]2− D.[Fe(CN)6]4−
画出[Cu(CN)4]2−的结构:___ (用“→”或“—”将配位键表示出来)。
(1)将 1 mol TiCl3·4H2O 溶于水,加入足量 AgNO3 溶液,得到 1 mol AgCl 沉淀,已知Ti3+的配位数为6,TiCl3·4H2O的化学式用配合物的形式表示为
(2)有下列实验:

②写出蓝色沉淀溶解成深蓝色溶液的离子方程式
③[Cu(NH3)4]2+中H−N−H键角比NH3分子中H−N−H键角
A.离子键 B.共价键 C.氢键 D.配位键
④物质在外磁场的作用下会发生磁化现象,在磁场中物质的磁性可分为顺磁性、反磁性和铁磁性,中心离子或原子上含有未成对电子的物质具有顺磁性,下列配离子中具有顺磁性的是
A.[Cr(OH)4] − B.[Cu(CN)4]3− C.[ZnCl4]2− D.[Fe(CN)6]4−
画出[Cu(CN)4]2−的结构:
您最近半年使用:0次
名校
解题方法
10 . 已知:2[Co(H2O)6]2++10NH3+2NH +H2O2=2[Co(NH3)6]3++14H2O,下列说法错误的
+H2O2=2[Co(NH3)6]3++14H2O,下列说法错误的
 +H2O2=2[Co(NH3)6]3++14H2O,下列说法错误的
+H2O2=2[Co(NH3)6]3++14H2O,下列说法错误的| A.NH3和H2O的中心原子的杂化类型相同 |
| B.反应中H2O2作氧化剂,发生还原反应,被还原 |
| C.NH3和H2O与Co3+的配位能力:NH3 < H2O |
| D.1mol[Co(H2O)6]2+配离子中,含有的σ键数目为18×6.02×1023 |
您最近半年使用:0次



