名校
解题方法
1 . 请回答下列问题:
(1)5G芯片主要材质是高纯硅。基态Si原子核外电子的运动状态有_________ 种。
(2)高纯硅制备过程中会有 、
、 等中间产物生成。
等中间产物生成。
沸点:
_________  (填“>”或“<”);
(填“>”或“<”);
已知电负性:H>Si, 充分水解会生成两种酸和一种气体,写出该反应的化学方程式为
充分水解会生成两种酸和一种气体,写出该反应的化学方程式为______ 。
(3)复兴号高铁车体材质用到Mn、Co等元素。Mn的一种配合物化学式为:[ ],下列说法错误的是
],下列说法错误的是_________ (填字母标号)。
A. 中σ键与π键数目之比为5:2
中σ键与π键数目之比为5:2
B.Mn原子的配位数为6
C. 中C原子的杂化类型为
中C原子的杂化类型为 、
、
(4)FePO4是一种锂离子电池的正极材料,放电时生成LiFePO4。
①下列电子排布图表示的Li原子的状态中,能量最高的为_________ (填序号)。
a.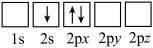 b.
b.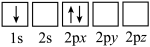
c.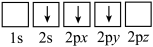
②锂离子电池充放电过程中,正极材料晶胞的组成变化如图所示。
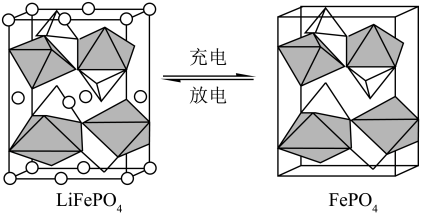
 的空间构型为
的空间构型为_________ 。正极材料在 和
和 之间转化时,每摩尔晶胞转移电子的物质的量为
之间转化时,每摩尔晶胞转移电子的物质的量为___________ mol。
(1)5G芯片主要材质是高纯硅。基态Si原子核外电子的运动状态有
(2)高纯硅制备过程中会有
 、
、 等中间产物生成。
等中间产物生成。沸点:

 (填“>”或“<”);
(填“>”或“<”);已知电负性:H>Si,
 充分水解会生成两种酸和一种气体,写出该反应的化学方程式为
充分水解会生成两种酸和一种气体,写出该反应的化学方程式为(3)复兴号高铁车体材质用到Mn、Co等元素。Mn的一种配合物化学式为:[
 ],下列说法错误的是
],下列说法错误的是A.
 中σ键与π键数目之比为5:2
中σ键与π键数目之比为5:2B.Mn原子的配位数为6
C.
 中C原子的杂化类型为
中C原子的杂化类型为 、
、
(4)FePO4是一种锂离子电池的正极材料,放电时生成LiFePO4。
①下列电子排布图表示的Li原子的状态中,能量最高的为
a.
 b.
b.
c.

②锂离子电池充放电过程中,正极材料晶胞的组成变化如图所示。

 的空间构型为
的空间构型为 和
和 之间转化时,每摩尔晶胞转移电子的物质的量为
之间转化时,每摩尔晶胞转移电子的物质的量为
您最近一年使用:0次
2 . 中国科学院上海微系统与信息技术研究所发明了一种新型基于单质碲和氮化钛电极界面效应的开关器件,该研究突破为我国发展海量存储和近存计算在大数据时代参与国际竞争提供了新的技术方案,该成果荣获2022年度中国科学十大进展。回答下列问题:
(1)工业上以铜阳极泥(主要成分 )为原料提取碲(Te),涉及如下反应:
)为原料提取碲(Te),涉及如下反应:
Ⅰ. ,
,
Ⅱ.
下列说法正确的是
(2)氧、硫、硒、碲在周期表中位于同一主族。
①补全基态碲原子的简化电子排布式: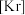
___________ ,
②碲的最高价氧化物的水化物碲酸 的酸性比
的酸性比
___________ (选填“强”或“弱”),其氧化性比硫酸强。向碲酸中通入 气体,若反应中生成的
气体,若反应中生成的 与
与 的物质的量之比为2:1,写出反应的化学方程式
的物质的量之比为2:1,写出反应的化学方程式___________ 。
(3)钛的某配合物可用于催化环烯烃聚合,其结构如下图所示:
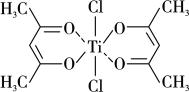
①碳原子的杂化类型有___________ 种。
②该配合物中存在的化学键有___________ (填字母)。
a.离子键 b.配位键 c.金属键
d.共价键 e.氢键
(4)氮化钛晶体的晶胞结构如图所示,该晶体结构中与N原子距离最近且相等的 原子有
原子有___________ 个;若该晶胞的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶胞中
,则晶胞中 原子与
原子与 原子的最近距离为
原子的最近距离为___________  。(用含
。(用含 的代数式表示)
的代数式表示)

(1)工业上以铜阳极泥(主要成分
 )为原料提取碲(Te),涉及如下反应:
)为原料提取碲(Te),涉及如下反应:Ⅰ.
 ,
,Ⅱ.

下列说法正确的是
A. 中 中 元素的化合价是+2价 元素的化合价是+2价 |
B.氧化性强弱顺序为: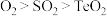 |
C.II中氧化剂是 ,氧化产物是 ,氧化产物是 |
D.生成 理论上转移 理论上转移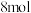 电子 电子 |
①补全基态碲原子的简化电子排布式:
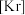
②碲的最高价氧化物的水化物碲酸
 的酸性比
的酸性比
 气体,若反应中生成的
气体,若反应中生成的 与
与 的物质的量之比为2:1,写出反应的化学方程式
的物质的量之比为2:1,写出反应的化学方程式(3)钛的某配合物可用于催化环烯烃聚合,其结构如下图所示:

①碳原子的杂化类型有
②该配合物中存在的化学键有
a.离子键 b.配位键 c.金属键
d.共价键 e.氢键
(4)氮化钛晶体的晶胞结构如图所示,该晶体结构中与N原子距离最近且相等的
 原子有
原子有 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶胞中
,则晶胞中 原子与
原子与 原子的最近距离为
原子的最近距离为 。(用含
。(用含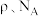 的代数式表示)
的代数式表示)
您最近一年使用:0次
解题方法
3 . 请回答下列问题。
(1)离子半径
___________  (填“>”或“<”)。
(填“>”或“<”)。
(2)C、O对应简单气态氢化物的稳定性强的是___________ (用化学式表示),该氢化物由固态变为气态克服的微粒间作用力有___________ 。
(3)O元素基态原子中能量最高的电子占据的原子轨道呈___________ 形。
(4)检验K元素常用的方法___________ 。
(5)元素C、H组成的化合物R是合成烈性炸药TNT的原料,写出R的结构简式___________ 。
(6)钛被誉为“21世纪的金属”,其化合物广泛用于国防、电讯器材、医疗器械和化工设备等领域。钛的某配合物可用于催化环烯烃聚合,其结构如图所示:
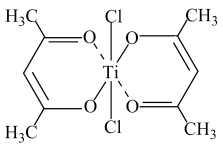
①钛的配位数为___________ 。
②该配合物中存在的化学键有___________ (填序号)。
a.离子键 b.配位键 c.金属键 d.共价键
(1)离子半径

 (填“>”或“<”)。
(填“>”或“<”)。(2)C、O对应简单气态氢化物的稳定性强的是
(3)O元素基态原子中能量最高的电子占据的原子轨道呈
(4)检验K元素常用的方法
(5)元素C、H组成的化合物R是合成烈性炸药TNT的原料,写出R的结构简式
(6)钛被誉为“21世纪的金属”,其化合物广泛用于国防、电讯器材、医疗器械和化工设备等领域。钛的某配合物可用于催化环烯烃聚合,其结构如图所示:

①钛的配位数为
②该配合物中存在的化学键有
a.离子键 b.配位键 c.金属键 d.共价键
您最近一年使用:0次
解题方法
4 . 数十亿年来,随着地球上物质的不断变化,大气的成分也发生着很大的变化。
表中是原始大气和目前空气的主要成分:
用表中所涉及物质按要求回答下列问题。
(1)含有10个电子的分子有__________________ 。
(2)由极性键构成的非极性分子有__________________ 。
(3)沸点最高的物质是__________________ 。
(4)不含孤电子对的氢化物分子有__________________ ,它的空间结构为__________________ 。
(5)极易溶于水且水溶液呈碱性的物质是_________ 。
(6) 的结构可表示为
的结构可表示为 ,与
,与 结构最相似的分子是
结构最相似的分子是_________ 。二者分子的极性_________ (填“相同”或“不相同”)。
(7)写出 与
与 反应的离子方程式:
反应的离子方程式:________ ;能与 形成配位键的分子还有
形成配位键的分子还有______ 。
表中是原始大气和目前空气的主要成分:
| 目前空气的成分 |
|
| 原始大气的主要成分 |  、 、 、 、 、 、 等 等 |
用表中所涉及物质按要求回答下列问题。
(1)含有10个电子的分子有
(2)由极性键构成的非极性分子有
(3)沸点最高的物质是
(4)不含孤电子对的氢化物分子有
(5)极易溶于水且水溶液呈碱性的物质是
(6)
 的结构可表示为
的结构可表示为 ,与
,与 结构最相似的分子是
结构最相似的分子是(7)写出
 与
与 反应的离子方程式:
反应的离子方程式: 形成配位键的分子还有
形成配位键的分子还有
您最近一年使用:0次
5 .  失水后可转为
失水后可转为 ,与
,与 可联合制备铁粉精(
可联合制备铁粉精( )和
)和 。按要求回答下列问题。
。按要求回答下列问题。
I. 的结构如图所示。
的结构如图所示。

(1) 价层电子的轨道表示式为
价层电子的轨道表示式为___________ 。
(2) 中的键角比
中的键角比 分子中的
分子中的___________ 。(填“大”、“小”或“一样大”)
(3)图中 分别与
分别与 、
、 的作用力为
的作用力为___________ 、___________ 。
Ⅱ. 晶胞为立方体,棱长为apm,如图所示:
晶胞为立方体,棱长为apm,如图所示:
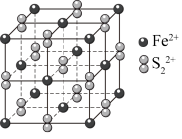
(4)与 等距且紧邻的
等距且紧邻的 离子个数为
离子个数为___________ 。晶胞的密度为___________ g⋅cm (设阿伏加德罗常数的值为
(设阿伏加德罗常数的值为 ,列算式)。
,列算式)。
(5)以 为燃料,联合
为燃料,联合 的分解,制备铁粉精(
的分解,制备铁粉精( )和
)和 。
。
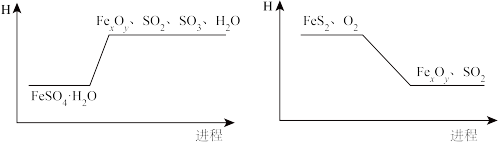
①结合下列“ 分解”、“
分解”、“ 与
与 反应”分别生成
反应”分别生成 的焓变图示,解释制备铁粉精的过程能充分实现“能源和资源”有效利用的原因:
的焓变图示,解释制备铁粉精的过程能充分实现“能源和资源”有效利用的原因:___________ 。
②此过程中,发生氧化反应的物质为___________ 。
 失水后可转为
失水后可转为 ,与
,与 可联合制备铁粉精(
可联合制备铁粉精( )和
)和 。按要求回答下列问题。
。按要求回答下列问题。I.
 的结构如图所示。
的结构如图所示。
(1)
 价层电子的轨道表示式为
价层电子的轨道表示式为(2)
 中的键角比
中的键角比 分子中的
分子中的(3)图中
 分别与
分别与 、
、 的作用力为
的作用力为Ⅱ.
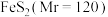 晶胞为立方体,棱长为apm,如图所示:
晶胞为立方体,棱长为apm,如图所示:
(4)与
 等距且紧邻的
等距且紧邻的 离子个数为
离子个数为 (设阿伏加德罗常数的值为
(设阿伏加德罗常数的值为 ,列算式)。
,列算式)。(5)以
 为燃料,联合
为燃料,联合 的分解,制备铁粉精(
的分解,制备铁粉精( )和
)和 。
。①结合下列“
 分解”、“
分解”、“ 与
与 反应”分别生成
反应”分别生成 的焓变图示,解释制备铁粉精的过程能充分实现“能源和资源”有效利用的原因:
的焓变图示,解释制备铁粉精的过程能充分实现“能源和资源”有效利用的原因:
②此过程中,发生氧化反应的物质为
您最近一年使用:0次
名校
解题方法
6 . 实验测得Al与氯元素形成化合物的实际组成为 ,其球棍模型如图所示。已知
,其球棍模型如图所示。已知 在加热时易升华,与过量的NaOH溶液反应可生成
在加热时易升华,与过量的NaOH溶液反应可生成 -。下列说法不正确的是
-。下列说法不正确的是
 ,其球棍模型如图所示。已知
,其球棍模型如图所示。已知 在加热时易升华,与过量的NaOH溶液反应可生成
在加热时易升华,与过量的NaOH溶液反应可生成 -。下列说法不正确的是
-。下列说法不正确的是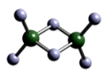
A. 属于分子晶体 属于分子晶体 |
B. 中Al原子为 中Al原子为 杂化 杂化 |
C. 中存在的化学键有极性共价键、配位键 中存在的化学键有极性共价键、配位键 |
D. 属于配合物 属于配合物 |
您最近一年使用:0次
2023-05-23更新
|
88次组卷
|
2卷引用:天津市朱唐庄中学2023-2024学年高二下学期3月检测化学试卷
名校
7 . 按要求回答下列问题
(1) 的资源化利用是解决温室效应的重要途径。科学家致力于
的资源化利用是解决温室效应的重要途径。科学家致力于 与
与 反应制
反应制 的研究。
的研究。
① 分子中碳原子的杂化轨道类型为
分子中碳原子的杂化轨道类型为________ ;干冰是很好的制冷剂,干冰升华时, 需要克服的作用力是
需要克服的作用力是________ 。
② 的沸点比
的沸点比 高,主要原因是
高,主要原因是________ 。
③ 被氧化为HCHO,HCHO继续被氧化可生成HCOOH。HCHO分子的空间结构为
被氧化为HCHO,HCHO继续被氧化可生成HCOOH。HCHO分子的空间结构为________ ,HCOOH分子内σ键与π键个数之比为________ 。
(2)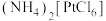 的中心离子是
的中心离子是________ ,配位体是________ 。
(3) 合金是目前已发现的储氢密度是最高的储氢材料之一,其晶胞结构如图所示:
合金是目前已发现的储氢密度是最高的储氢材料之一,其晶胞结构如图所示:
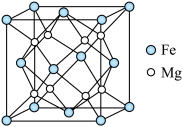
①单质铁和镁都是由________ 键形成的晶体。
②距离Mg原子最近的Fe原子个数是________ 。
③若该晶胞的棱长为 ,阿伏加得罗常数的值为
,阿伏加得罗常数的值为 ,则该合金的密度为
,则该合金的密度为________  。
。
(1)
 的资源化利用是解决温室效应的重要途径。科学家致力于
的资源化利用是解决温室效应的重要途径。科学家致力于 与
与 反应制
反应制 的研究。
的研究。①
 分子中碳原子的杂化轨道类型为
分子中碳原子的杂化轨道类型为 需要克服的作用力是
需要克服的作用力是②
 的沸点比
的沸点比 高,主要原因是
高,主要原因是③
 被氧化为HCHO,HCHO继续被氧化可生成HCOOH。HCHO分子的空间结构为
被氧化为HCHO,HCHO继续被氧化可生成HCOOH。HCHO分子的空间结构为(2)
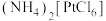 的中心离子是
的中心离子是(3)
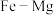 合金是目前已发现的储氢密度是最高的储氢材料之一,其晶胞结构如图所示:
合金是目前已发现的储氢密度是最高的储氢材料之一,其晶胞结构如图所示:
①单质铁和镁都是由
②距离Mg原子最近的Fe原子个数是
③若该晶胞的棱长为
 ,阿伏加得罗常数的值为
,阿伏加得罗常数的值为 ,则该合金的密度为
,则该合金的密度为 。
。
您最近一年使用:0次
2023·天津·模拟预测
8 . 硒—钴—锏 三元整流剂在导电玻璃中应用广泛,且三种元素形成的单质及其化合物均有重要的应用。请回答下列问题:
三元整流剂在导电玻璃中应用广泛,且三种元素形成的单质及其化合物均有重要的应用。请回答下列问题:
(1)钴位于元素周期表中_____________ (填“s”、“p”、“d”或“ds”)区,与钴位于同一周期且含有相同未成对电子数的元素有_____________ 种。
(2)元素 、O、N的第一电离能由大到小的顺序
、O、N的第一电离能由大到小的顺序___________________ 。硒的某种氧化物为链状聚合结构如图所示,该氧化物的化学式为___________________ 。

(3)二硒键和二硫键是重要的光响应动态共价键,其光响应原理可用图表示。

已知光的波长与键能成反比,则图中实现光响应的波长:
_______  (填“>”、“<”或“=”),其原因是
(填“>”、“<”或“=”),其原因是_________________ 。
(4)[ (15—冠—5)
(15—冠—5) ](“15—冠—5”是指冠醚的环上原子总数为15,其中O原子数为5)是一种配位离子,该配位离子的结构示意图如图1,该配位离子中含有的
](“15—冠—5”是指冠醚的环上原子总数为15,其中O原子数为5)是一种配位离子,该配位离子的结构示意图如图1,该配位离子中含有的 键数目为
键数目为_____________ 。全惠斯勒合金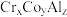 的晶胞结构如图2所示,其化学式为
的晶胞结构如图2所示,其化学式为___________________ 。

 三元整流剂在导电玻璃中应用广泛,且三种元素形成的单质及其化合物均有重要的应用。请回答下列问题:
三元整流剂在导电玻璃中应用广泛,且三种元素形成的单质及其化合物均有重要的应用。请回答下列问题:(1)钴位于元素周期表中
(2)元素
 、O、N的第一电离能由大到小的顺序
、O、N的第一电离能由大到小的顺序
(3)二硒键和二硫键是重要的光响应动态共价键,其光响应原理可用图表示。

已知光的波长与键能成反比,则图中实现光响应的波长:

 (填“>”、“<”或“=”),其原因是
(填“>”、“<”或“=”),其原因是(4)[
 (15—冠—5)
(15—冠—5) ](“15—冠—5”是指冠醚的环上原子总数为15,其中O原子数为5)是一种配位离子,该配位离子的结构示意图如图1,该配位离子中含有的
](“15—冠—5”是指冠醚的环上原子总数为15,其中O原子数为5)是一种配位离子,该配位离子的结构示意图如图1,该配位离子中含有的 键数目为
键数目为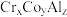 的晶胞结构如图2所示,其化学式为
的晶胞结构如图2所示,其化学式为
您最近一年使用:0次
名校
解题方法
9 . 某小组进行如下“简单配合物的形成”的实验活动。
实验用品:试管、胶头滴管: 、
、 、
、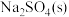 、
、 、蒸馏水、乙醇;
、蒸馏水、乙醇; 的
的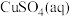 、
、 氨水。
氨水。
按要求回答下列问题。
(1)分别取下表中粉末少量于点滴板各孔穴中,加入足量蒸馏水溶解,对比观察现象,填写表中空白:
(2)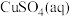 与氨水反应的实验
与氨水反应的实验
①向盛有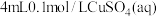 的试管中滴入几滴
的试管中滴入几滴 氨水实验现象为
氨水实验现象为_________ ;写出该反应的离子方程式:________________ 。
②继续加入氨水,得到深蓝色透明溶液。写出该反应的离子方程式:__________________ 。
③再加入乙醇,观察到析出深蓝色晶体。写出该晶体的化学式:__________________ 。
④经结构测定实验证明,步骤②中的深蓝色的配离子中:中心离子为_________ ,配位数为_________ ,配体为_________ 。
实验用品:试管、胶头滴管:
 、
、 、
、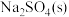 、
、 、蒸馏水、乙醇;
、蒸馏水、乙醇; 的
的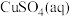 、
、 氨水。
氨水。按要求回答下列问题。
(1)分别取下表中粉末少量于点滴板各孔穴中,加入足量蒸馏水溶解,对比观察现象,填写表中空白:
固体物质 |  |  | 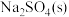 |  |
粉末颜色 | 白色 | 深褐色 | 白色 | 白色 |
溶液颜色 | 天蓝色 | 无色 | ||
实验结论 | ①溶液中呈无色的主要离子有 | |||
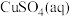 与氨水反应的实验
与氨水反应的实验①向盛有
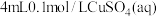 的试管中滴入几滴
的试管中滴入几滴 氨水实验现象为
氨水实验现象为②继续加入氨水,得到深蓝色透明溶液。写出该反应的离子方程式:
③再加入乙醇,观察到析出深蓝色晶体。写出该晶体的化学式:
④经结构测定实验证明,步骤②中的深蓝色的配离子中:中心离子为
您最近一年使用:0次
2023-05-02更新
|
244次组卷
|
2卷引用:天津市河西区2022-2023学年高二下学期4月期中考试化学试题
10 . 钴及其化合物在催化剂、磁性材料、电池等领域应用十分广泛。回答下列问题:
(1)纳米氧化钴可以在室温下将甲醛完全催化氧化为 和
和 。
。
①基态钴原子的核外价层电子排布式为___________ 。
②甲醛分子中三种元素电负性由大到小的顺序为___________ (填元素符号);甲醛分子的立体构型为___________ ;分子中 键与
键与 键数目比为
键数目比为___________ 。
(2) 是橙黄色晶体,该配合物中提供空轨道接受孤对电子的微粒是
是橙黄色晶体,该配合物中提供空轨道接受孤对电子的微粒是___________ , 是
是___________ (填“极性”或“非极性”)分子。
(3) 可用作锂离子电池的电极材料。在元素周期表中,与
可用作锂离子电池的电极材料。在元素周期表中,与 的化学性质最相似的邻族元素是
的化学性质最相似的邻族元素是___________ (填元素符号),该元素基态原子核外M层电子的自旋状态___________ (填“相同”或“相反”); 的熔点为848℃,属于
的熔点为848℃,属于___________ 晶体。
(4)某钴化合物纳米粉可以提高碱性电池的性能。该化合物晶胞结构如图,已知晶胞参数为 ,则此晶体密度为(列出计算式即可)
,则此晶体密度为(列出计算式即可)___________  。(
。( 代表阿伏伽德罗常数)
代表阿伏伽德罗常数)

(1)纳米氧化钴可以在室温下将甲醛完全催化氧化为
 和
和 。
。①基态钴原子的核外价层电子排布式为
②甲醛分子中三种元素电负性由大到小的顺序为
 键与
键与 键数目比为
键数目比为(2)
 是橙黄色晶体,该配合物中提供空轨道接受孤对电子的微粒是
是橙黄色晶体,该配合物中提供空轨道接受孤对电子的微粒是 是
是(3)
 可用作锂离子电池的电极材料。在元素周期表中,与
可用作锂离子电池的电极材料。在元素周期表中,与 的化学性质最相似的邻族元素是
的化学性质最相似的邻族元素是 的熔点为848℃,属于
的熔点为848℃,属于(4)某钴化合物纳米粉可以提高碱性电池的性能。该化合物晶胞结构如图,已知晶胞参数为
 ,则此晶体密度为(列出计算式即可)
,则此晶体密度为(列出计算式即可) 。(
。( 代表阿伏伽德罗常数)
代表阿伏伽德罗常数)
您最近一年使用:0次
2023-05-01更新
|
258次组卷
|
2卷引用:天津市第四十七中学2022-2023学年高二下学期期中考试化学试题

 、
、 、
、 、
、 等
等

