名校
解题方法
1 . 二苯铬[(C6H6)2Cr]可作烯烃聚合或异丙醇脱氢等反应的催化剂,工业上常用 Cr2O3为原料按如下流程制备二苯铬
下列说法正确的是
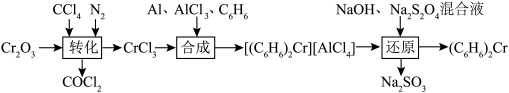
下列说法正确的是
| A.为了向“转化”提供稳定的CCl4气流,可用水浴加热 CCl4并用氮气带出CCl4 |
| B.1mol[(C6H6)2Cr][AlCl4]中含有6NA个配位键(NA表示阿伏加德罗常数的值) |
| C.“还原”中,还需通入一定量N₂,主要目的是防止Na2S2O4被氧化 |
| D.“还原”后,经过滤、蒸馏水洗涤可得到纯净的二苯铬 |
您最近一年使用:0次
2024-05-30更新
|
164次组卷
|
4卷引用:黑龙江省大庆市实验中学实验二部2023-2024学年高三下学期得分训练化学试题(五)
2 . 无水三氯化铬( )是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧化。实验室利用反应
)是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧化。实验室利用反应 制取
制取 的
的 (俗称光气)有毒,遇水发生水解,实验所需装置如图所示。
(俗称光气)有毒,遇水发生水解,实验所需装置如图所示。
(1)上述装置的正确连接顺序为___________ (填字母,按气流方向从左到右)。
(2)装置A中所盛放的试剂是___________ ,装置A中竖直长玻璃管的作用是___________ 。装置D中n瓶的作用是___________ 。实验过程中为了避免装置A中长玻璃管中液面上升,可以采用的方法为___________ (填序号)。
①对m处导管进行加热 ②将m处导管加粗 ③持续通入氮气
(3)装置E中发生反应的离子方程式为___________ 。无水 的作用是
的作用是___________ 。
(4)已知 分子中各原子均满足最外层8电子稳定结构,则1mol
分子中各原子均满足最外层8电子稳定结构,则1mol 含有
含有 键的个数为
键的个数为___________ ( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(5) 的结构有三种,且铬的配位数均为6,等物质的量的三种物质电离出的氯离子数目之比为3∶2∶1,对应的颜色分别为紫色、浅绿色和蓝绿色。其中浅绿色的结构中配离子的化学式为
的结构有三种,且铬的配位数均为6,等物质的量的三种物质电离出的氯离子数目之比为3∶2∶1,对应的颜色分别为紫色、浅绿色和蓝绿色。其中浅绿色的结构中配离子的化学式为___________ 。哈勃-韦斯(Haber-Weiss)原理表明,某些金属离子可以催化双氧水分解的原因是其次外层未排满的d轨道可以存取电子,降低活化能,使分解反应容易发生。则
___________ (填“能”或“不能”)催化双氧水分解。
 )是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧化。实验室利用反应
)是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧化。实验室利用反应 制取
制取 的
的 (俗称光气)有毒,遇水发生水解,实验所需装置如图所示。
(俗称光气)有毒,遇水发生水解,实验所需装置如图所示。
(1)上述装置的正确连接顺序为
(2)装置A中所盛放的试剂是
①对m处导管进行加热 ②将m处导管加粗 ③持续通入氮气
(3)装置E中发生反应的离子方程式为
 的作用是
的作用是(4)已知
 分子中各原子均满足最外层8电子稳定结构,则1mol
分子中各原子均满足最外层8电子稳定结构,则1mol 含有
含有 键的个数为
键的个数为 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。(5)
 的结构有三种,且铬的配位数均为6,等物质的量的三种物质电离出的氯离子数目之比为3∶2∶1,对应的颜色分别为紫色、浅绿色和蓝绿色。其中浅绿色的结构中配离子的化学式为
的结构有三种,且铬的配位数均为6,等物质的量的三种物质电离出的氯离子数目之比为3∶2∶1,对应的颜色分别为紫色、浅绿色和蓝绿色。其中浅绿色的结构中配离子的化学式为
您最近一年使用:0次
名校
解题方法
3 . 下列离子方程式能正确表示该化学反应过程的是
A.向硫化钠溶液中通入过量的 : :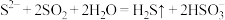 |
B.硫酸亚铁溶液中加入 产生沉淀: 产生沉淀: |
C.向含AgCl的悬浊液中加入足量氨水: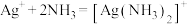 |
D. 溶于 溶于 溶液的主要反应: 溶液的主要反应: |
您最近一年使用:0次
解题方法
4 . 硫代硫酸盐是一类具有应用前景的浸金试剂,硫代硫酸根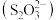 可看作是
可看作是 中的一个
中的一个 原子被
原子被 原子取代的产物,浸金时
原子取代的产物,浸金时 与
与 配位形成
配位形成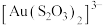 。
。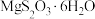 的晶胞形状为长方体,结构如图所示,下列说法正确的是
的晶胞形状为长方体,结构如图所示,下列说法正确的是
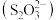 可看作是
可看作是 中的一个
中的一个 原子被
原子被 原子取代的产物,浸金时
原子取代的产物,浸金时 与
与 配位形成
配位形成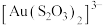 。
。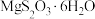 的晶胞形状为长方体,结构如图所示,下列说法正确的是
的晶胞形状为长方体,结构如图所示,下列说法正确的是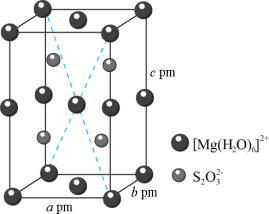
A. 中 中 键数目为12 键数目为12 |
B. 的空间结构是四面体形 的空间结构是四面体形 |
C.与 配位时, 配位时, 中心 中心 原子可作配位原子 原子可作配位原子 |
D.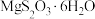 晶体的密度为: 晶体的密度为: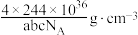 |
您最近一年使用:0次
名校
5 . 实验室用新制的氨水制备氨的配合物并测定其成分。
(1)氨水的制备如图, A中发生反应的化学方程式为___________ ,单向阀的作用是___________ 。C中溶液为___________ 。

(2)银氨溶液的制备及成分研究
25°C,磁力搅拌下向25.00 mL 0.12mol/L的AgNO3溶液中逐滴加入稀释后的氨水(浓度为1.205mol/L),实验测得烧杯内溶液的pH随氨水加入体积的变化曲线如图所示。经计算可知B点AgNO3是否已反应完全___________ (填 “是”或“否”);若要避免制备银氨溶液的过程生成AgOH沉淀,有人提出可在AgNO3溶液中加入一定浓度的NH4NO3,用平衡移动原理解释原因___________ 。

(3)已知D点刚好变澄清溶液,若该溶液中的溶质为强碱性的Ag(NH3)2OH,则pH应为___________ , 由此可判断D点溶质不是Ag(NH3)2OH。据此写出A~D总反应的化学方程式___________ 。
(4)欲得到Ag(NH3)2OH的溶液,可将沉淀量达到最大值时的浊液___________ 、___________ ,再继续滴加氨水。但 Ag(NH3)2OH溶液若碱性太强,则久置易分解生成爆炸性物质Ag3N,该分解反应的方程式为___________ 。
(1)氨水的制备如图, A中发生反应的化学方程式为

(2)银氨溶液的制备及成分研究
25°C,磁力搅拌下向25.00 mL 0.12mol/L的AgNO3溶液中逐滴加入稀释后的氨水(浓度为1.205mol/L),实验测得烧杯内溶液的pH随氨水加入体积的变化曲线如图所示。经计算可知B点AgNO3是否已反应完全

(3)已知D点刚好变澄清溶液,若该溶液中的溶质为强碱性的Ag(NH3)2OH,则pH应为
(4)欲得到Ag(NH3)2OH的溶液,可将沉淀量达到最大值时的浊液
您最近一年使用:0次
名校
6 . 我国从古代青铜器(如:司母戊鼎)最早的使用,到目前我国铜的消费量位居全球首位,真可谓“铜铸中华”。铜的合金在生产生活、国防科研中有广泛应用。回答下列问题:
(1)对于基态Cu原子,下列叙述正确的是____ (填标号)。
(2)一价铜离子能形成多种配位离子,常见的构型有[Cu(NH3)2]+、[CuCl3]2-、[Cu(CN)4]3-。三种配离子中的Cu、H、Cl、C原子电负性由大到小顺序是____ ;配离子[Cu(CN)4]3-的空间构型为正四面体形,则Cu的杂化类型为____ 杂化;在一个配离子[Cu(CN)4]3-中有____ 个σ键。
(3)二价铜离子也能形成多种配位离子。[Cu(NH3)4(H2O)2]2+中配位原子是____ (填元素符号),中心离子的配位数为____ ;在常温常压下,NH3易极溶于水,其原因为:____ (答两点即可)。
(4)黄铜矿(CuFeS2)可用于冶炼金属铜。金属晶体铜为面心立方最密堆积,其空间利用率为____ ,配位数为____ 。CuFeS2的晶胞如图所示,晶胞参数为apm、bpm。晶体中与一个Cu原子最近的S原子有____ 个;在CuFeS2晶胞中已标出两原子的原子分数坐标,则A原子的分数坐标为____ ;若NA为阿伏加德罗常数的值,则晶体密度为ρ=____ g·cm-3。

(1)对于基态Cu原子,下列叙述正确的是
| A.轨道处于半充满、全充满时体系总能量低,核外电子排布应为[Ar]3d104s1 |
| B.3d能级上的电子能量比4s的高,因此铜原子首先失去的是3d的电子 |
| C.第一电离能比钾的低,原子对键合电子的吸引力比钙小 |
| D.基态Cu的价电子有1种不同运动状态的电子 |
(3)二价铜离子也能形成多种配位离子。[Cu(NH3)4(H2O)2]2+中配位原子是
(4)黄铜矿(CuFeS2)可用于冶炼金属铜。金属晶体铜为面心立方最密堆积,其空间利用率为

您最近一年使用:0次
名校
解题方法
7 . 高温超导体通常指在液氮温度(77K)以上超导的材料,而超导体是在23K下才显示超导性。铜元素化合物种类繁多,是高温氧化物超导体研究的热点。请回答下列问题。
(1)高温超导材料镧钡铜氧化物中含有Cu3+,基态时Cu3+的价层电子排布图为_______ 。基态O2-中含有_______ 种不同空间运动状态的电子。
(2)在硫酸铜溶液中加入过量氨水,生成配离子[Cu(NH3)4]2+,其中配体为_______ 。1mol[Cu(NH3)4]2+中含有的σ键的数目为_______ 个。NH3、PH3、AsH3的沸点由高到低的顺序为_______ (填化学式,下同),稳定性由强到弱的顺序为_______ 。
(3)La2CuO4是第一个被发现的高温氧化物超导体,它属于_______ 晶体(填晶体类型)。图为其晶胞结构。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。例如图中原子1的坐标为(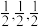 ),则原子2的坐标为
),则原子2的坐标为______ 。由于晶胞的无隙并置堆积,所以向上下左右重复,导致8个顶点坐标相同,都是(0,0,0),所以坐标中“1”就是“0”,例如该晶胞Cu原子有两种不同原子坐标。O原子有_______ 种不同的原子坐标。

(4)图中晶胞参数分别为a pm、a pm、c pm,La2CuO4的摩尔质量为M g/mol,求该晶体的密度ρ=_______ g·cm-3(列出计算式,设NA为阿伏加德罗常数的值)。
(1)高温超导材料镧钡铜氧化物中含有Cu3+,基态时Cu3+的价层电子排布图为
(2)在硫酸铜溶液中加入过量氨水,生成配离子[Cu(NH3)4]2+,其中配体为
(3)La2CuO4是第一个被发现的高温氧化物超导体,它属于
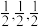 ),则原子2的坐标为
),则原子2的坐标为
(4)图中晶胞参数分别为a pm、a pm、c pm,La2CuO4的摩尔质量为M g/mol,求该晶体的密度ρ=
您最近一年使用:0次
名校
解题方法
8 . CO 易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5; [Cu(NH3)2]Ac 溶液用于除去CO的化学反应方程式:[Cu(NH3)2]Ac+CO+NH3=[Cu(NH3)3] Ac·CO (式中Ac-代表醋酸根)。请回答下列问题:
(1)C、N、O的第一电离能最大的是_____________ ,原因是___________________________ 。基态Fe 原子的价电子排布图为___________________________ 。
(2)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是_____________ ,羰基铁的结构如图,根据该图可知CO作为配位体是以__________ 原子为配位原子与Fe原子结合。

(3)离子水化能是气态离子溶于大量水中成为无限稀释溶液时释放的能量。离子在溶液中的稳定性可以从离子的大小、电荷、水化能等因素来解释。Cu2+和Cu+的水化能分别是-2121kJ·mol-1和-582 kJ·mol-1,在水溶液里Cu2+比Cu+稳定的原因是_______________________________ 。[Cu(NH3)2]+在水溶液中相对稳定,在配合物[Cu(NH3)2]Ac中碳原子的杂化类型是________________________________ 。
(4)用[Cu(NH3)2]Ac除去CO的反应中,肯定有形成________________ 。
a.离子键 b.配位键 c.非极性键 d. σ键
(5)钙铜合金的晶体结构可看成(a) (b) 两种原子层交替堆积排列而成图(c),则该合金六方晶胞(即平行六面体晶胞)中含为Cu________ 个。已知同层的Ca-Cu的距离为294pm,根据图示求同层相邻Ca-Ca的距离__________ pm (已知 =1.73 计算结果保留整数)。
=1.73 计算结果保留整数)。

(1)C、N、O的第一电离能最大的是
(2)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是

(3)离子水化能是气态离子溶于大量水中成为无限稀释溶液时释放的能量。离子在溶液中的稳定性可以从离子的大小、电荷、水化能等因素来解释。Cu2+和Cu+的水化能分别是-2121kJ·mol-1和-582 kJ·mol-1,在水溶液里Cu2+比Cu+稳定的原因是
(4)用[Cu(NH3)2]Ac除去CO的反应中,肯定有形成
a.离子键 b.配位键 c.非极性键 d. σ键
(5)钙铜合金的晶体结构可看成(a) (b) 两种原子层交替堆积排列而成图(c),则该合金六方晶胞(即平行六面体晶胞)中含为Cu
 =1.73 计算结果保留整数)。
=1.73 计算结果保留整数)。
您最近一年使用:0次
2018-03-09更新
|
499次组卷
|
2卷引用:黑龙江省哈尔滨市第三中学校2018届高三一模考试理综化学试题



