1 . ZnO在化学工业中主要用作橡胶和颜料的添加剂,医药上用于制软膏、橡皮膏等。工业上可由菱锌矿(主要成分为ZnCO3,还含有Ni、Cd、Fe、Mn等元素)制备。工艺如图所示:
已知:①“溶浸”后的溶液中金属离子主要有:Zn2+、Fe2+、Cd2+、Mn2+、Ni2+。
②弱酸性溶液中KMnO4能将Mn2+氧化生成MnO2。
③氧化性顺序:Ni2+>Cd2+>Zn2+。
(1)基态Zn原子的核外电子排布式为___________ ,铁在元素周期表中的位置为___________ ,Ni2+和Fe2+可形成如图所示的配合物离子,其中铁的一个配体为茂环阴离子(C5H ),该配体以π电子参与配位,配合物离子中与铁形成配位键的电子共有
),该配体以π电子参与配位,配合物离子中与铁形成配位键的电子共有___________ 个,S元素的杂化方式为___________ 。 ”是向“溶浸”后的溶液中加入少量
”是向“溶浸”后的溶液中加入少量___________ (填化学式)调节至弱酸性(pH为5.5)。此时溶液中 的最大浓度是
的最大浓度是___________ 。
(3)加 “氧化除杂”发生反应的离子方程式分别是
“氧化除杂”发生反应的离子方程式分别是 和
和___________ 。
(4)“还原除杂”除去的离子是___________ 。
(5)生成碱式碳酸锌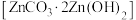 沉淀,写出该步骤的离子方程式
沉淀,写出该步骤的离子方程式___________ 。碱式碳酸锌灼烧后得到ZnO,ZnO的一种晶体的晶胞是立方晶胞(如图所示),晶胞参数为apm,该晶胞的密度为___________ g/cm3,请在图中画出该晶胞沿 轴方向的平面投影图
轴方向的平面投影图___________ 。

| 金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ | Mn2+ | Ni2+ |
| 开始沉淀的pH | 1.5 | 6.3 | 6.0 | 7.4 | 8.1 | 6.9 |
| 沉淀完全的pH | 2.8 | 8.3 | 8.0 | 9.4 | 10.1 | 8.9 |
②弱酸性溶液中KMnO4能将Mn2+氧化生成MnO2。
③氧化性顺序:Ni2+>Cd2+>Zn2+。
(1)基态Zn原子的核外电子排布式为
 ),该配体以π电子参与配位,配合物离子中与铁形成配位键的电子共有
),该配体以π电子参与配位,配合物离子中与铁形成配位键的电子共有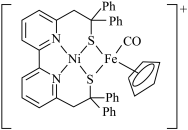
 ”是向“溶浸”后的溶液中加入少量
”是向“溶浸”后的溶液中加入少量 的最大浓度是
的最大浓度是(3)加
 “氧化除杂”发生反应的离子方程式分别是
“氧化除杂”发生反应的离子方程式分别是 和
和(4)“还原除杂”除去的离子是
(5)生成碱式碳酸锌
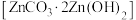 沉淀,写出该步骤的离子方程式
沉淀,写出该步骤的离子方程式 轴方向的平面投影图
轴方向的平面投影图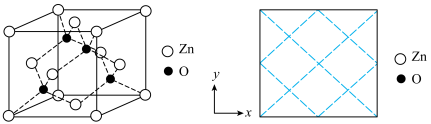
您最近半年使用:0次
2 . 已知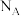 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
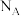 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A. 和 和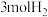 反应形成的 反应形成的 键数目为 键数目为 |
B. 固体溶于 固体溶于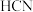 酸所得溶液显中性, 酸所得溶液显中性,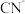 的数目为 的数目为 |
C. 固体中含有氨气分子数目为 固体中含有氨气分子数目为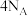 |
D. 与 与 充分反应,转移的电子数目为 充分反应,转移的电子数目为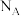 |
您最近半年使用:0次
名校
解题方法
3 . 废定影液的主要成分为 ,以废定影液为原料制备
,以废定影液为原料制备 的工艺流程如图:
的工艺流程如图: )可看作是
)可看作是 中的一个O原子被S原子取代的产物。
中的一个O原子被S原子取代的产物。
②常温下, 稳
稳 ;
; 。
。
(1)硫化钠溶液显碱性,其原因为___________ (用离子方程式表示)。
(2)比较S原子和O原子的电负性大小,并从原子结构的角度说明理由:___________ 。
(3) 的空间结构是
的空间结构是___________ 。
(4)常温下,“沉淀”时发生的反应为 ,平衡时,
,平衡时,
___________ (列出计算式即可)。
(5)“反应”时有淡黄色固体生成,发生反应的化学方程式为___________ 。
(6)MgS2O3·6H2O的晶胞形状为长方体,结构如图所示。 个数为
个数为___________ 。晶体中微粒间作用力有___________ (填标号)。
a.氢键 b.离子键 c.极性共价键 d.配位键
 ,以废定影液为原料制备
,以废定影液为原料制备 的工艺流程如图:
的工艺流程如图: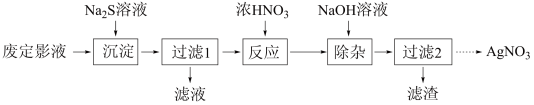
 )可看作是
)可看作是 中的一个O原子被S原子取代的产物。
中的一个O原子被S原子取代的产物。②常温下,
 稳
稳 ;
; 。
。(1)硫化钠溶液显碱性,其原因为
(2)比较S原子和O原子的电负性大小,并从原子结构的角度说明理由:
(3)
 的空间结构是
的空间结构是(4)常温下,“沉淀”时发生的反应为
 ,平衡时,
,平衡时,
(5)“反应”时有淡黄色固体生成,发生反应的化学方程式为
(6)MgS2O3·6H2O的晶胞形状为长方体,结构如图所示。
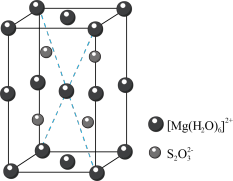
 个数为
个数为a.氢键 b.离子键 c.极性共价键 d.配位键
您最近半年使用:0次
昨日更新
|
32次组卷
|
2卷引用:2024届吉林省通化市梅河口市第五中学高三下学期二模化学试题
4 .  是一种强还原性的高能物质,在航天、能源等领域有广泛应用。我国科学家合成的某
是一种强还原性的高能物质,在航天、能源等领域有广泛应用。我国科学家合成的某 催化剂(用
催化剂(用 表示)能高效电催化氧化
表示)能高效电催化氧化 合成
合成 ,其反应机理如图所示。下列说法正确的是
,其反应机理如图所示。下列说法正确的是
 是一种强还原性的高能物质,在航天、能源等领域有广泛应用。我国科学家合成的某
是一种强还原性的高能物质,在航天、能源等领域有广泛应用。我国科学家合成的某 催化剂(用
催化剂(用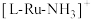 表示)能高效电催化氧化
表示)能高效电催化氧化 合成
合成 ,其反应机理如图所示。下列说法正确的是
,其反应机理如图所示。下列说法正确的是
A.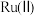 催化剂降低该反应的活化能,大大缩短达到化学平衡所需的时间 催化剂降低该反应的活化能,大大缩短达到化学平衡所需的时间 |
B.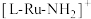 中氮原子上有孤电子对 中氮原子上有孤电子对 |
C.该过程的总反应式为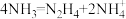 |
D.由于 中存在非极性共价键,所以 中存在非极性共价键,所以 易溶于水 易溶于水 |
您最近半年使用:0次
5 . 下列物质中不属于 配合物的是
| A.NaAl(OH)4 | B.CuSO4•5H2O | C.[Ag(NH3)2]OH | D.(NH4)2C2O4 |
您最近半年使用:0次
6 . 设 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是A.1mol 完全溶于水,所得溶液中含氮微粒数为 完全溶于水,所得溶液中含氮微粒数为 |
B.1L0.1mol/L的 溶液中含有 溶液中含有 的数目为 的数目为 |
C.1mol 中σ键的数目为 中σ键的数目为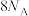 |
D.标准状况下,22.4LHC1分子中含有 的数目为 的数目为 |
您最近半年使用:0次
名校
7 . 铜及其化合物在生活、生产中用途广泛。以黄铜矿为原料冶炼铜涉及多个反应,其中一个反应为
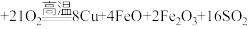 。回答下列问题:
。回答下列问题:
(1)基态铜原子的价层电子的轨道表示式(电子排布图)为___________ ,基态铜原子核外电子的空间运动状态(原子轨道)有___________ 种。
(2)高温下CuO能转化为 的原因是
的原因是___________ (从原子结构角度分析)。
(3) 、
、 、
、 、
、 四种含硫微粒中,中心原子为
四种含硫微粒中,中心原子为 杂化的是
杂化的是___________ ,属于极性分子的是___________ 。
(4) 、FeO的熔点是下列两个数值中的一个:1360℃、1565℃。
、FeO的熔点是下列两个数值中的一个:1360℃、1565℃。 、FeO两种氧化物的晶体类型都是
、FeO两种氧化物的晶体类型都是___________ ,1360℃是___________ 的熔点。
(5) 晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(硫原子)的分数坐标为
晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(硫原子)的分数坐标为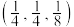 ,则原子2(铁原子)的分数坐标为
,则原子2(铁原子)的分数坐标为___________ 。晶胞参数分别为a pm,a pm、2a pm, 晶体的密度为
晶体的密度为___________  (列出计算表达式,设阿伏加德罗常数的值为
(列出计算表达式,设阿伏加德罗常数的值为 )。
)。

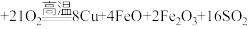 。回答下列问题:
。回答下列问题:(1)基态铜原子的价层电子的轨道表示式(电子排布图)为
(2)高温下CuO能转化为
 的原因是
的原因是(3)
 、
、 、
、 、
、 四种含硫微粒中,中心原子为
四种含硫微粒中,中心原子为 杂化的是
杂化的是(4)
 、FeO的熔点是下列两个数值中的一个:1360℃、1565℃。
、FeO的熔点是下列两个数值中的一个:1360℃、1565℃。 、FeO两种氧化物的晶体类型都是
、FeO两种氧化物的晶体类型都是(5)
 晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(硫原子)的分数坐标为
晶体的晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1(硫原子)的分数坐标为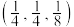 ,则原子2(铁原子)的分数坐标为
,则原子2(铁原子)的分数坐标为 晶体的密度为
晶体的密度为 (列出计算表达式,设阿伏加德罗常数的值为
(列出计算表达式,设阿伏加德罗常数的值为 )。
)。
您最近半年使用:0次
名校
解题方法
8 . 科学家新合成了镍催化剂NiSCN,并将其应用在光氧化还原/镍催化的卤代芳烃碳氮键和碳氧键偶联反应中,反应机理如图所示(Ar-为芳基),下列叙述正确的是

| A.SCN-Ni(Ⅱ)中N提供孤电子对与Ni(Ⅱ)提供的空轨道形成配位键 |
| B.上述总反应属于加成反应,原子利用率为100% |
C.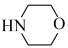 和 和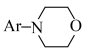 中C原子杂化类型完全相同 中C原子杂化类型完全相同 |
| D.上述循环中,Ni的化合价保持不变 |
您最近半年使用:0次
名校
解题方法
9 . 制备锂离子电池的正极材料的前体 的一种流程如下:
的一种流程如下:
ii. 可溶于水,
可溶于水, 微溶于水
微溶于水
iii.
iv.
I.制备
1.用 溶液、
溶液、 溶液分步浸取磷灰石生成HF、
溶液分步浸取磷灰石生成HF、 和
和 ,主要反应的化学方程式为
,主要反应的化学方程式为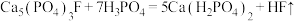 和
和
___________ 。
2.增大酸浸反应速率的措施有___________ (写1条)。
3.其他条件不变时,若仅用 溶液酸浸,浸取的速率低于用
溶液酸浸,浸取的速率低于用 、
、 分步浸取法,原因是
分步浸取法,原因是___________ 。
II.制备
将 、
、 、
、 混合并调节溶液的pH制备
混合并调节溶液的pH制备 。
。
4.酸性条件下,生成 的离子方程式是
的离子方程式是___________ 。
常温下,利用NaOH调节 溶液pH时,得到溶液中含磷各微粒的物质的量分数与pH的关系如图所示。
溶液pH时,得到溶液中含磷各微粒的物质的量分数与pH的关系如图所示。
6. 时,溶液中的
时,溶液中的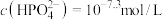 ,则
,则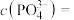
___________  ,再加入
,再加入 晶体、
晶体、 溶液使溶液中的
溶液使溶液中的 ,不考虑溶液体积的变化,通过计算说明此时能否产生
,不考虑溶液体积的变化,通过计算说明此时能否产生 沉淀
沉淀___________ 。
 的纯度及颗粒大小会影响其性能,沉淀速率过快容易团聚。
的纯度及颗粒大小会影响其性能,沉淀速率过快容易团聚。
7.研究表明,沉淀时可加入含 的溶液,
的溶液, 的作用是
的作用是___________ 。
8.配离子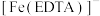 的结构如图所示,图中M代表
的结构如图所示,图中M代表 。EDTA中碳原子的杂化方式为
。EDTA中碳原子的杂化方式为___________ , 的配位数为
的配位数为___________ 。 而不是更高的pH制备
而不是更高的pH制备 ,可能的原因是
,可能的原因是___________ 、___________ (答出2点)。
 的一种流程如下:
的一种流程如下:

ii.
 可溶于水,
可溶于水, 微溶于水
微溶于水iii.

iv.

I.制备

1.用
 溶液、
溶液、 溶液分步浸取磷灰石生成HF、
溶液分步浸取磷灰石生成HF、 和
和 ,主要反应的化学方程式为
,主要反应的化学方程式为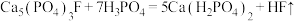 和
和
2.增大酸浸反应速率的措施有
3.其他条件不变时,若仅用
 溶液酸浸,浸取的速率低于用
溶液酸浸,浸取的速率低于用 、
、 分步浸取法,原因是
分步浸取法,原因是II.制备

将
 、
、 、
、 混合并调节溶液的pH制备
混合并调节溶液的pH制备 。
。4.酸性条件下,生成
 的离子方程式是
的离子方程式是常温下,利用NaOH调节
 溶液pH时,得到溶液中含磷各微粒的物质的量分数与pH的关系如图所示。
溶液pH时,得到溶液中含磷各微粒的物质的量分数与pH的关系如图所示。 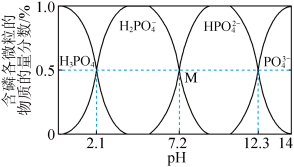
A. 的电离方程式为: 的电离方程式为: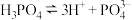 |
B.M点时,溶液中 |
C. 时,溶液 时,溶液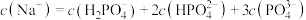 |
D. 时,溶液中水的电离程度比纯水大 时,溶液中水的电离程度比纯水大 |
 时,溶液中的
时,溶液中的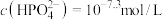 ,则
,则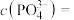
 ,再加入
,再加入 晶体、
晶体、 溶液使溶液中的
溶液使溶液中的 ,不考虑溶液体积的变化,通过计算说明此时能否产生
,不考虑溶液体积的变化,通过计算说明此时能否产生 沉淀
沉淀 的纯度及颗粒大小会影响其性能,沉淀速率过快容易团聚。
的纯度及颗粒大小会影响其性能,沉淀速率过快容易团聚。7.研究表明,沉淀时可加入含
 的溶液,
的溶液, 的作用是
的作用是8.配离子
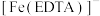 的结构如图所示,图中M代表
的结构如图所示,图中M代表 。EDTA中碳原子的杂化方式为
。EDTA中碳原子的杂化方式为 的配位数为
的配位数为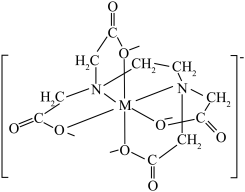
 而不是更高的pH制备
而不是更高的pH制备 ,可能的原因是
,可能的原因是
您最近半年使用:0次
10 . 铜氨溶液含有 ,具有溶解纤维素的性能,在溶解纤维素后所得溶液中再加酸时纤维素又可以沉淀析出,利用这种性质来制造人造丝。用硫酸铜溶液和氨水反应可以制得铜氨溶液。
,具有溶解纤维素的性能,在溶解纤维素后所得溶液中再加酸时纤维素又可以沉淀析出,利用这种性质来制造人造丝。用硫酸铜溶液和氨水反应可以制得铜氨溶液。
(1) 溶液呈蓝色是因为含有水合铜离子
溶液呈蓝色是因为含有水合铜离子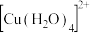 ,结构示意图如图所示:基态
,结构示意图如图所示:基态 原子核外电子排布式为
原子核外电子排布式为_______ 。
向 溶液中加入少量氨水,得到浅蓝色的碱式硫酸铜的沉淀;若继续加入氨水,沉淀溶解,得到深蓝色的含
溶液中加入少量氨水,得到浅蓝色的碱式硫酸铜的沉淀;若继续加入氨水,沉淀溶解,得到深蓝色的含 的铜氨溶液。
的铜氨溶液。
①比较键角:NH3_______ NH (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。
②该实验中, 与
与 结合能力
结合能力_______ (填“大于”“小于”或“等于”) 与
与 结合能力,解释原因:
结合能力,解释原因:_______ 。
③经实验发现:金属铜与氨水和过氧化氢的混合溶液反应也可得到 。金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是
。金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是_______ ,反应的离子方应程式为_______ 。
(3)某种铜的氯化物晶胞形状为立方体,结构如图所示。
已知该晶胞的密度为 ,阿伏加德罗常数为
,阿伏加德罗常数为 。则该晶胞的边长为
。则该晶胞的边长为_______  (列出计算式)。
(列出计算式)。
 ,具有溶解纤维素的性能,在溶解纤维素后所得溶液中再加酸时纤维素又可以沉淀析出,利用这种性质来制造人造丝。用硫酸铜溶液和氨水反应可以制得铜氨溶液。
,具有溶解纤维素的性能,在溶解纤维素后所得溶液中再加酸时纤维素又可以沉淀析出,利用这种性质来制造人造丝。用硫酸铜溶液和氨水反应可以制得铜氨溶液。(1)
 溶液呈蓝色是因为含有水合铜离子
溶液呈蓝色是因为含有水合铜离子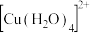 ,结构示意图如图所示:基态
,结构示意图如图所示:基态 原子核外电子排布式为
原子核外电子排布式为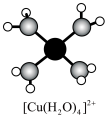
向
 溶液中加入少量氨水,得到浅蓝色的碱式硫酸铜的沉淀;若继续加入氨水,沉淀溶解,得到深蓝色的含
溶液中加入少量氨水,得到浅蓝色的碱式硫酸铜的沉淀;若继续加入氨水,沉淀溶解,得到深蓝色的含 的铜氨溶液。
的铜氨溶液。①比较键角:NH3
 (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。②该实验中,
 与
与 结合能力
结合能力 与
与 结合能力,解释原因:
结合能力,解释原因:③经实验发现:金属铜与氨水和过氧化氢的混合溶液反应也可得到
 。金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是
。金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是(3)某种铜的氯化物晶胞形状为立方体,结构如图所示。
已知该晶胞的密度为
 ,阿伏加德罗常数为
,阿伏加德罗常数为 。则该晶胞的边长为
。则该晶胞的边长为 (列出计算式)。
(列出计算式)。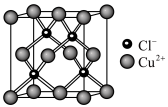
您最近半年使用:0次



