名校
1 . 氮化钠可与水发生反应Na3N+3H2O = 3NaOH+NH3 ↑,下列叙述不正确的是
A.NaOH的电子式为: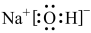 |
| B.H2O是极性分子 |
| C.Na3N中既含离子键也含共价键 |
| D.NH3的空间构型为三角锥形 |
您最近一年使用:0次
2 . “暖冰技术”的原理:在强电场作用下使液态水瞬间凝固结晶。目前科学家们已经成功地制造出了“室温冰”,称为“暖冰”。下列关于“暖冰”的说法中正确的是
| A.“暖冰”的熔点升高,“暖冰”属于原子晶体 |
| B.“暖冰”分子与干冰分子的空间结构相同 |
C.“暖冰”分子可能与 分子的极性相同 分子的极性相同 |
| D.在强电场作用下,水分子间更易形成分子间氢键,因而可制得“暖冰” |
您最近一年使用:0次
2022-12-13更新
|
180次组卷
|
2卷引用:黑龙江省海伦市第二中学2022-2023学年高三上学期期末考试化学试题
名校
解题方法
3 . 周期表中VIA族元素及其化合物应用广泛。用硫磺熏蒸中药材的传统由来已久; 是一种易燃的有毒气体(燃烧热为
是一种易燃的有毒气体(燃烧热为 ),可制取各种硫化物;硫酸、硫酸盐是重要化工原料;硫酰氯
),可制取各种硫化物;硫酸、硫酸盐是重要化工原料;硫酰氯 是重要的化工试剂,常作氯化剂或氯磺化剂。硒
是重要的化工试剂,常作氯化剂或氯磺化剂。硒 和碲(52
和碲(52 的单质及其化合物在电子、冶金、材料等领域有广阔的发展前景,工业上以精炼铜的阳极泥(含CuSe)为原料回收
的单质及其化合物在电子、冶金、材料等领域有广阔的发展前景,工业上以精炼铜的阳极泥(含CuSe)为原料回收 ,以电解强碱性
,以电解强碱性 溶液制备
溶液制备 。下列说法正确的是
。下列说法正确的是
 是一种易燃的有毒气体(燃烧热为
是一种易燃的有毒气体(燃烧热为 ),可制取各种硫化物;硫酸、硫酸盐是重要化工原料;硫酰氯
),可制取各种硫化物;硫酸、硫酸盐是重要化工原料;硫酰氯 是重要的化工试剂,常作氯化剂或氯磺化剂。硒
是重要的化工试剂,常作氯化剂或氯磺化剂。硒 和碲(52
和碲(52 的单质及其化合物在电子、冶金、材料等领域有广阔的发展前景,工业上以精炼铜的阳极泥(含CuSe)为原料回收
的单质及其化合物在电子、冶金、材料等领域有广阔的发展前景,工业上以精炼铜的阳极泥(含CuSe)为原料回收 ,以电解强碱性
,以电解强碱性 溶液制备
溶液制备 。下列说法正确的是
。下列说法正确的是A. 、 、 都是由极性键构成的极性分子 都是由极性键构成的极性分子 |
B. 与 与 微粒中的 微粒中的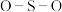 夹角都是 夹角都是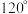 |
C.硒原子基态核外电子排布式为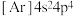 |
| D.VIA族元素氢化物的沸点从上到下依次增大 |
您最近一年使用:0次
2022-12-04更新
|
309次组卷
|
2卷引用:黑龙江省富锦市第一中学2022-2023学年高二上学期期末考试化学试题
4 . 下列对分子结构及其性质的解释中,不正确的是
| A.乙烷难溶于水、溴易溶于四氯化碳都可用相似相溶原理解释 |
B.酸性: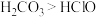 ,是因为 ,是因为 分子中的氢原子数目比HClO多 分子中的氢原子数目比HClO多 |
C.羟基乙酸 不属于手性分子,因其分子中不存在手性碳原子 不属于手性分子,因其分子中不存在手性碳原子 |
D. 的沸点高于 的沸点高于 ,因乙醇分子中含—OH,能形成分子间氢键 ,因乙醇分子中含—OH,能形成分子间氢键 |
您最近一年使用:0次
2022-07-19更新
|
513次组卷
|
4卷引用:黑龙江省哈尔滨市六校2021-2022学年高二下学期期末联考化学试题
黑龙江省哈尔滨市六校2021-2022学年高二下学期期末联考化学试题(已下线)2.3 分子结构与物质的性质-同步学习必备知识(已下线)化学键 分子结构及性质江西省宜春市丰城市第九中学2023-2024学年高二下学期4月月考化学试题
名校
解题方法
5 . ①NH3 ②CO2 ③SiCl4 ④BF3 ⑤C2H4 ⑥H2O2 ⑦Cl2 ⑧P4 ⑨H2S
(1)含极性共价键的非极性分子___________ (填序号,下同)
(2)含非极性共价键的非极性分子___________
(3)含极性共价键的极性分子___________
(4)①NH3中心原子杂化方式___________ 分子的空间构型___________
(5)④BF3中心原子杂化方式___________ 分子的空间构型___________
(1)含极性共价键的非极性分子
(2)含非极性共价键的非极性分子
(3)含极性共价键的极性分子
(4)①NH3中心原子杂化方式
(5)④BF3中心原子杂化方式
您最近一年使用:0次
名校
6 . 下列说法不正确的是
| A.乳酸分子CH3CH(OH)COOH是手性分子 |
B.酸性: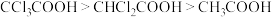 是因为 是因为 原子为吸电子基,使得羟基O-H键极性增强,易电离出H+ 原子为吸电子基,使得羟基O-H键极性增强,易电离出H+ |
| C.硫难溶于水,微溶于酒精,易溶于CS2,说明分子极性:H2O>C2H5OH>CS2 |
| D.邻羟基苯甲醛的沸点高于对羟基苯甲醛的沸点 |
您最近一年使用:0次
2022-06-13更新
|
151次组卷
|
3卷引用:黑龙江省双鸭山市第一中学2021-2022学年高二6月月考化学试题
名校
解题方法
7 . 下列说法不正确的是
A.乳酸分子(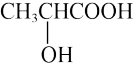 )是手性分子 )是手性分子 |
| B.水蒸气、液态水和冰中均存在氢键 |
| C.硫难溶于水,微溶于酒精,易溶于CS2,说明分子极性:H2O>C2H5OH>CS2 |
| D.酸性:CCl3COOH>CHCl2COOH>CH3COOH是因为Cl原子为吸电子基,使得羟基O-H键极性增强,易电离出H+ |
您最近一年使用:0次
2022-05-17更新
|
442次组卷
|
5卷引用:黑龙江省肇东市第四中学2021-2022学年高二下学期期中考试化学试题
名校
解题方法
8 . LDFCB是锂离子电池常用的一种离子导体,其阴离子由同周期元素原子序数依次增大的原子W、X、Y、Z构成,结构如图。基态Y原子的s轨道与p轨道电子数相等,Z的核外电子总数是W的最外层电子数的3倍。下列说法正确的是
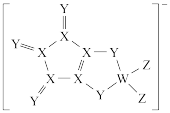

| A.同周期元素第一电离能小于Y的有5种 |
| B.简单氢化物的沸点:Z>Y>X |
| C.W的最高价氧化物对应的水化物具有两性 |
| D.W和Z可形成含有极性共价键的非极性分子 |
您最近一年使用:0次
2022-05-11更新
|
672次组卷
|
9卷引用:黑龙江省哈尔滨市实验中学2022-2023学年高三上学期期中考试化学试题
9 . 三氯化氮( )的空间结构类似于
)的空间结构类似于 ,为三角锥形。下列说法
,为三角锥形。下列说法不正确 的是
 )的空间结构类似于
)的空间结构类似于 ,为三角锥形。下列说法
,为三角锥形。下列说法A. 键是极性键 键是极性键 | B. 分子中不存在孤电子对 分子中不存在孤电子对 |
C. 分子为极性分子 分子为极性分子 | D. 可能易溶于极性溶剂 可能易溶于极性溶剂 |
您最近一年使用:0次
2022-05-05更新
|
217次组卷
|
2卷引用:黑龙江省哈尔滨市宾县第二中学2022-2023学年高二下学期第二次月考化学试题
名校
解题方法
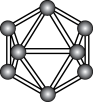
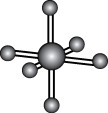
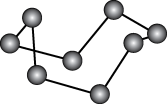
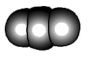
10 . 观察下列模型并结合有关信息,判断有关说法正确的是
| 硼晶体结构单元 | SF6分子 | S8 | HCN | |
| 结构模型示意图 |
|
|
|
|
| 备注 | 熔点1873K | — | 易溶于CS2 | — |
| A.单质硼属于共价晶体 | B.SF6是由极性键构成的极性分子 |
| C.固态硫S8属于共价晶体 | D.HCN的结构式为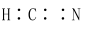 |
您最近一年使用:0次
2022-05-05更新
|
236次组卷
|
6卷引用:黑龙江省大庆市大庆中学2021-2022学年高二下学期期中考试化学试题