名校
1 . 某小组在实验室用NaClO溶液和NH3反应制备N2H4,并进行相关的性质探究实验。
(1)制备N2H4
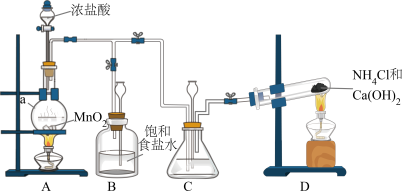
制备N2H4的离子方程式为___________ 。
Ⅱ.测定产品中水合肼(N2H4 · H2O)的含量
称取产品6.0 g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右), 加水配成250 mL溶液,移取25.00 mL置于锥形瓶中,并滴加2 ~ 3滴淀粉溶液,用 0.3000 mol • L-1的碘标准溶液滴定(已知:N2H4·H2O+2I2 =N2↑ +4HI+H2O)。
(2)滴定到达终点的现象是___________ 。
(3)实验测得消耗碘标准溶液的平均值为20.00 mL,产品中水合肼的质量分数为___________ 。
Ⅲ.探究肼的性质。
(4)写出肼的电子式___________ ,肼为___________ 分子。(填“极性”或“非极性”)。
(5)预设肼可能具有___________ (a.氧化性 b.还原性 c.酸性 d.碱性)。
将制得的肼分离提纯后,进行如图实验探究。
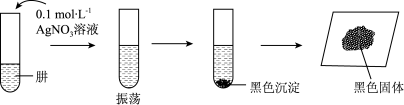
【查阅资料]AgOH在溶液中不稳定,易分解生成黑色的Ag2O,Ag2O可溶于氨水。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】设计如下方案,进行实验。
(6)请完成表中的空白部分:①___________ ;②___________ 。
(7)实验表明,黑色固体主要成分是Ag,还有少量氧化银,请解释原因:___________ 。
(1)制备N2H4

制备N2H4的离子方程式为
Ⅱ.测定产品中水合肼(N2H4 · H2O)的含量
称取产品6.0 g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右), 加水配成250 mL溶液,移取25.00 mL置于锥形瓶中,并滴加2 ~ 3滴淀粉溶液,用 0.3000 mol • L-1的碘标准溶液滴定(已知:N2H4·H2O+2I2 =N2↑ +4HI+H2O)。
(2)滴定到达终点的现象是
(3)实验测得消耗碘标准溶液的平均值为20.00 mL,产品中水合肼的质量分数为
Ⅲ.探究肼的性质。
(4)写出肼的电子式
(5)预设肼可能具有
将制得的肼分离提纯后,进行如图实验探究。

【查阅资料]AgOH在溶液中不稳定,易分解生成黑色的Ag2O,Ag2O可溶于氨水。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】设计如下方案,进行实验。
| 操作 | 现象 | 实验结论 |
| i.取少量黑色固体于试管中,加入适量①___________ | 黑色固体部分溶解 | 黑色固体有Ag2O |
| ii.取少量黑色固体于试管中加入足量稀硝酸,振荡 | ②___________ | 黑色固体是Ag和Ag2O |
(7)实验表明,黑色固体主要成分是Ag,还有少量氧化银,请解释原因:
您最近一年使用:0次
2 . 某学习小组探究卤素单质参与氧化还原反应原理,试从电化学角度分析物质氧化性和还原性的变化规律。
(1)实验需要配制200mL 1.0mol·L-1的KCl溶液,下图所示的仪器中,配制溶液不需要的是___________ (填选项),配制上述溶液还需用到的玻璃仪器有烧杯、玻璃棒和___________ (填仪器名称)。___________ 。
(3)电化学中,将有转化关系的、含相同主要元素的氧化型物质和还原型物质称作一个电对(如MnO2/Mn2+、Cl2/Cl-等)。每个电对都有一个电极电势(φ),其数值越高,意味着电对中氧化型物质转化为还原型物质的能力越强;反之,其数值越低,意味着电对中还原型物质转化为氧化型物质的能力越强。两个不同电对可以构成一个氧化还原反应,其中电极电势高的电对发生还原反应,体现氧化性;电极电势低的电对发生氧化反应,体现还原性。例如强酸性条件下:φ(MnO2/Mn2+)>φ(Cl2/Cl-)
则可发生反应:MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O。
小组成员通过查阅资料得知:
①溶液中的c(H+)会影响电对的电极电势大小;
②溶液中的氧化型物质浓度越大,电极电势越高;溶液中的还原型物质浓度越大,电极电势越低;
③构成氧化还原反应的两个电对的电极电势差值越大,反应越易发生;反之则越难发生。小组成员发现,浓盐酸与MnO2混合加热生成氯气,当氯气不再逸出时,反应体系(固液混合物A)中仍存在盐酸和MnO2,根据以上资料,小组成员提出以下猜想:
i.随c(H+)降低,φ(MnO2/Mn2+)降低,MnO2氧化性减弱。
ii.随c(Cl-)降低,φ(Cl2/Cl-)___________ ,Cl-还原性___________ 。
iii.随c(Mn2+)升高,φ(MnO2/Mn2+)降低,MnO2氧化性减弱。
随后小组设计了下列实验验证了他们的猜想,补充完整下列实验表格:
根据以上实验结论,小组成员进一步设计实验,定量探究相同浓度卤素离子(Cl-、Br-、I-)的还原性强弱。实验可选药品及设备有:均为1mol/L的KCl溶液、KBr溶液和KI溶液,6mol/L的H2SO4溶液,12mol/L的HCl溶液,MnO2固体,蒸馏水,pH传感器,试管,胶头滴管。请设计实验方案(不考虑尾气处理和试管容积限制):___________ 。
(4)实验中得到一种卤素单质,将其提纯后得到紫色易升华晶体。它在生活中的一种用途为___________ ;它在CCl4中的溶解度大于在H2O或C2H5OH中的溶解度,请说出原因:___________ 。
(1)实验需要配制200mL 1.0mol·L-1的KCl溶液,下图所示的仪器中,配制溶液不需要的是

(3)电化学中,将有转化关系的、含相同主要元素的氧化型物质和还原型物质称作一个电对(如MnO2/Mn2+、Cl2/Cl-等)。每个电对都有一个电极电势(φ),其数值越高,意味着电对中氧化型物质转化为还原型物质的能力越强;反之,其数值越低,意味着电对中还原型物质转化为氧化型物质的能力越强。两个不同电对可以构成一个氧化还原反应,其中电极电势高的电对发生还原反应,体现氧化性;电极电势低的电对发生氧化反应,体现还原性。例如强酸性条件下:φ(MnO2/Mn2+)>φ(Cl2/Cl-)
则可发生反应:MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O。
小组成员通过查阅资料得知:
①溶液中的c(H+)会影响电对的电极电势大小;
②溶液中的氧化型物质浓度越大,电极电势越高;溶液中的还原型物质浓度越大,电极电势越低;
③构成氧化还原反应的两个电对的电极电势差值越大,反应越易发生;反之则越难发生。小组成员发现,浓盐酸与MnO2混合加热生成氯气,当氯气不再逸出时,反应体系(固液混合物A)中仍存在盐酸和MnO2,根据以上资料,小组成员提出以下猜想:
i.随c(H+)降低,φ(MnO2/Mn2+)降低,MnO2氧化性减弱。
ii.随c(Cl-)降低,φ(Cl2/Cl-)
iii.随c(Mn2+)升高,φ(MnO2/Mn2+)降低,MnO2氧化性减弱。
随后小组设计了下列实验验证了他们的猜想,补充完整下列实验表格:
| 组别 | 实验操作 | 滴加试剂 | 实验现象 | 实验结论 |
| I |
| 较浓H2SO4 | 猜想i正确 | |
| Ⅱ | KCl溶液 | 有氯气 | 猜想ii正确 | |
| Ⅲ | KCl溶液+MnSO4溶液 | 无氯气 | 猜想iii |
(4)实验中得到一种卤素单质,将其提纯后得到紫色易升华晶体。它在生活中的一种用途为
您最近一年使用:0次
名校
3 . 氮及其化合物在生活和生产中占有重要的地位。肼(N2H4)是高能燃料,具有强还原性,溶于水生成的水合肼是二元弱碱,常用作火箭发射的推进剂。常温下,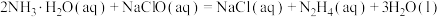 ,可用于生产N2H4。NO2有较强的氧化性,但对环境有影响,可以用碱性物质吸收。NH3是工业制备硝酸的重要原料。N2O5在HClO4中发生反应:
,可用于生产N2H4。NO2有较强的氧化性,但对环境有影响,可以用碱性物质吸收。NH3是工业制备硝酸的重要原料。N2O5在HClO4中发生反应: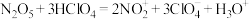 。N2O5的结构如图,可看作H2O分子中H原子被硝基取代而形成。下列说法不正确的是
。N2O5的结构如图,可看作H2O分子中H原子被硝基取代而形成。下列说法不正确的是
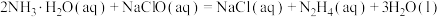 ,可用于生产N2H4。NO2有较强的氧化性,但对环境有影响,可以用碱性物质吸收。NH3是工业制备硝酸的重要原料。N2O5在HClO4中发生反应:
,可用于生产N2H4。NO2有较强的氧化性,但对环境有影响,可以用碱性物质吸收。NH3是工业制备硝酸的重要原料。N2O5在HClO4中发生反应: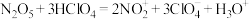 。N2O5的结构如图,可看作H2O分子中H原子被硝基取代而形成。下列说法不正确的是
。N2O5的结构如图,可看作H2O分子中H原子被硝基取代而形成。下列说法不正确的是
| A.N2O5是非极性分子 | B. 空间构型为正四面体形 空间构型为正四面体形 |
C. 中N杂化轨道类型为sp 中N杂化轨道类型为sp | D.H3O+的键角大于H2O的键角 |
您最近一年使用:0次
解题方法
4 . X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素,Y、Z、W为同周期相邻元素,Q、W同主族,五种元素形成的一种分子的结构如图所示,下列说法错误的是
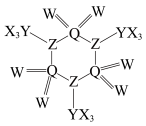
A.沸点: | B.简单氢化物的还原性: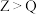 |
C.原子半径: | D.Z、Q的单质既有氧化性又有还原性 |
您最近一年使用:0次
名校
5 . 下列关于物质性质的比较正确的是
A.溶解度(水中): | B.还原性: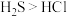 |
C.沸点: | D.氧化性: |
您最近一年使用:0次
6 . 火法冶炼是以黄铜矿(CuFeS2)为主要原料,下图是一种火法制备高纯度铜的工艺。

(1)黄铜矿熔炼过程中会发生反应:2CuFeS2+O2=Cu2S+2FeS+SO2.若2 mol CuFeS2参与反应,转移电子数目为_______ 。在上述反应中,SO2是_______ 。
A.氧化剂 B.还原剂 C.还原产物 D.氧化产物
(2)吹炼过程中,向熔融的冰铜中加入SiO2的目的是_______ 。
(3)粗铜经电解精炼可获得高纯度铜,下列说法正确的是
(4)关于SO2的说法正确的是
(5)煤中掺入一定量的生石灰,能减少煤燃烧排放的SO2,体现SO2具有
(6)冶铜烟气可以作为工业制硫酸为原料。下列的说法正确的是
(7)蔗糖遇浓硫酸会变成“黑面包”状,下列说法正确的是

(1)黄铜矿熔炼过程中会发生反应:2CuFeS2+O2=Cu2S+2FeS+SO2.若2 mol CuFeS2参与反应,转移电子数目为
A.氧化剂 B.还原剂 C.还原产物 D.氧化产物
(2)吹炼过程中,向熔融的冰铜中加入SiO2的目的是
(3)粗铜经电解精炼可获得高纯度铜,下列说法正确的是
| A.粗铜做阴极,发生氧化反应 |
| B.电解质溶液中铜离子向阴极移动 |
| C.利用阳极泥可回收Ag、Zn、Au等金属 |
| D.当电路中通过的电子数为NA时,阳极的质量变化一定是32 g |
(4)关于SO2的说法正确的是
| A.中心原子的杂化类型为sp2 | B.电负性:O<S |
| C.属于非极性分子 | D.价层电子对的空间结构为平面三角形 |
(5)煤中掺入一定量的生石灰,能减少煤燃烧排放的SO2,体现SO2具有
| A.漂白性 | B.酸性氧化物的性质 |
| C.氧化性 | D.还原性 |
(6)冶铜烟气可以作为工业制硫酸为原料。下列的说法正确的是
| A.500℃左右,转化器中反应的平衡转化率最大 |
| B.使用以铁为主的催化剂 |
| C.冶炼烟气在进入转化器之前,必须进行除尘、干燥等净化操作,防止催化剂中毒 |
| D.压强一般采用20~50MPa |
(7)蔗糖遇浓硫酸会变成“黑面包”状,下列说法正确的是
| A.蔗糖属于多糖 |
| B.在水浴条件下,蔗糖能与银氨溶液反应产生“银镜” |
| C.浓硫酸表现出脱水性、氧化性 |
| D.产生的气体通入品红溶液,溶液会褪色 |
您最近一年使用:0次
7 . 下列物质性质与用途或物质结构与性质具有对应关系的是
A. 可溶于水,可用作宇宙飞船中 可溶于水,可用作宇宙飞船中 吸收剂 吸收剂 |
| B.Mg有强还原性,可用于钢铁的电化学防护 |
| C.石墨晶体层间存在范德华力,石墨易导电 |
D. 是极性分子, 是极性分子, 有强氧化性 有强氧化性 |
您最近一年使用:0次
解题方法
8 . 氮是生命所需的重要元素,是蛋白质的重要组成部分。亚硝酸(HNO2)是一种亮蓝色的弱酸,电离平衡常数为4.6×10-4;亚硝酸既有氧化性,又有还原性。亚硝酸溶液微热即分解。亚硝酸钠(NaNO2)是肉制品生产中最常使用的一种食品添加剂。氨气的燃烧热316.25kJ·mol-1,肼(N2H4)为无色油状液体,有类似于氨的刺鼻气味,是一种强极性化合物。连二亚硝酸(HON=NOH)是一种重要的还原剂,可由亚硝酸和羟胺反应制备,其反应的化学方程式为HONO+H2NOH→HON=NOH+H2O。下列说法错误的是
A.亚硝酸根离子(NO )为V形结构 )为V形结构 | B.羟胺是极性分子 |
| C.1个HON=NOH中有6个σ键 | D.连二亚硝酸可能易溶于水 |
您最近一年使用:0次
解题方法
9 . 如图是元素周期表的一部分,根据元素在周期表中的位置,回答下列问题:_______ ,其最高能层的电子占据的原子轨道电子云轮廓为_______ 形。若将其最高价氧化物的水化物溶于氨水中可得到一种透明的深蓝色溶液,写出反应的化学方程式为:_______ 。
(2)第二周期所有元素中第一电离能介于⑤⑦之间的有_______ 种。由②③④形成的简单离子半径由小到大顺序是_______ (填化学用语)。
(3)元素⑦⑧可形成原子个数比为1:1的共价化合物,分子中各原子最外层均达到8电子的稳定结构,试写出其结构式_______ ,该分子为_______ (填“极性分子”或“非极性分子”。
(4)元素②⑥可形成的化合物是一种性质优良的无机非金属材料,根据元素周期律知识,写出其化学式_______ ,它的熔点高,硬度大,电绝缘性好,化学性质稳定,它的晶体类型是_______ 。
(5)下列有关性质的比较正确且能用元素周期律解释的是_______(填标号)。
(6)一种由②和⑤两种元素形成化合物的晶胞如图所示,该晶胞的化学式为_______ 。

(2)第二周期所有元素中第一电离能介于⑤⑦之间的有
(3)元素⑦⑧可形成原子个数比为1:1的共价化合物,分子中各原子最外层均达到8电子的稳定结构,试写出其结构式
(4)元素②⑥可形成的化合物是一种性质优良的无机非金属材料,根据元素周期律知识,写出其化学式
(5)下列有关性质的比较正确且能用元素周期律解释的是_______(填标号)。
| A.第一电离能:②>③ |
| B.单质的氧化性:⑦>⑧ |
| C.最高价氧化物对应的水化物的碱性:④>⑤ |
| D.氢化物的沸点:③>⑦ |
(6)一种由②和⑤两种元素形成化合物的晶胞如图所示,该晶胞的化学式为

您最近一年使用:0次
2022·江苏·模拟预测
10 . 蓝天保卫战—持续三年的大气治理之战,其中低成本、高效率处理SO2、NO2等大气污染物一直是化学研究的重点课题,研究它们的性质、制备在工业生产和环境保护中有着重要意义。下列有关二氧化硫的说法正确的是
| A.SO2属于电解质 |
| B.SO2为非极性分子 |
| C.SO2既有氧化性又有还原性 |
| D.SO2易溶于水是因为与水能形成分子间氢键 |
您最近一年使用:0次




