名校
1 . ECH(环氧氯丙烷,结构为 )是生产环氧树脂的中间体,工业上可由如图路线合成。
)是生产环氧树脂的中间体,工业上可由如图路线合成。

已知: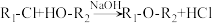
(1)A为丙烯,其分子中含有的官能团是____________ 。
(2)已知B→C为加成反应,A→B的反应类型是_________ 反应。
(3)B→C的反应中,B与次氯酸加成得到的C,有两种结构。
①C结构简式是i:ClCH2-CHCl-CH2OH和ii:_________ 。
②由分子中化学键的极性角度分析,i为B→C的主要产物的原因是_________ 。
(4)原料中的丙烯可由石油裂解得到。在裂解分离得到的含有三个碳原子的馏分中,除丙烯外,杂质气体中含有2种分子式均为C3H4的链烃D和E。
①D分子内含有sp3杂化的碳原子,则D结构简式为_________ 。
②E的核磁共振氢谱只有一组吸收峰,分子内无sp3杂化的碳原子。则
i.E中碳原子的杂化类型是_________ ;
ii.4个氢原子不在同一个平面内,由分子中碳原子的杂化解释其原因_________ 。
 )是生产环氧树脂的中间体,工业上可由如图路线合成。
)是生产环氧树脂的中间体,工业上可由如图路线合成。
已知:
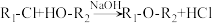
(1)A为丙烯,其分子中含有的官能团是
(2)已知B→C为加成反应,A→B的反应类型是
(3)B→C的反应中,B与次氯酸加成得到的C,有两种结构。
①C结构简式是i:ClCH2-CHCl-CH2OH和ii:
②由分子中化学键的极性角度分析,i为B→C的主要产物的原因是
(4)原料中的丙烯可由石油裂解得到。在裂解分离得到的含有三个碳原子的馏分中,除丙烯外,杂质气体中含有2种分子式均为C3H4的链烃D和E。
①D分子内含有sp3杂化的碳原子,则D结构简式为
②E的核磁共振氢谱只有一组吸收峰,分子内无sp3杂化的碳原子。则
i.E中碳原子的杂化类型是
ii.4个氢原子不在同一个平面内,由分子中碳原子的杂化解释其原因
您最近一年使用:0次
2024高三·全国·专题练习
解题方法
2 . 根据信息,回答下列问题。
I.铜及其化合物在生产、生活中有着广泛应用。最近科学家开发出石墨炔调控Cu单原子电催化剂(Cu1)实现CO2还原制备CH4,反应式为CO2(g)+4H2(g) CH4(g)+2H2O(g)。
CH4(g)+2H2O(g)。
(1)基态Cu原子的未成对电子占据原子轨道的形状为_______ 。
(2)上述反应涉及的化合物中,VSEPR模型和空间结构相同,且为非极性分子的是_______ (填分子式)。
Ⅱ.甘氨酸亚铁晶体是一种新型的固体螯合补铁剂。其实验室合成路线如下:
(3)写出上述合成路线中生成FeCO3沉淀的离子方程式:_______ 。
(4)甘氨酸亚铁晶体结构的分析。
步骤1:准确称取甘氨酸亚铁晶体纯品0.4800g于锥形瓶中,加3mol·L-1H2SO4溶液15mL将样品溶解完全后,加入指示剂,立即用0.1000mol·L-1(NH4)2Ce(SO4)3标准液滴定至终点,用去标准液20.20mL(离子方程式为Ce4++Fe2+=Ce3++Fe3+)。
步骤2:不加产品,重复步骤1操作,滴定至终点,用去标准液0.20mL。
①滴定时应选择_______ 滴定管。
②进一步分析表明:甘氨酸亚铁晶体中,阴阳离子只有H2NCH2COO-和Fe2+,且含2个结晶水;Fe2+的配位数为6,且存在五元螯合环;该配合物整体是中心对称,则甘氨酸亚铁晶体的结构示意图为_______ 。
③计算甘氨酸亚铁晶体中铁元素的质量分数____ (用百分数表示,保留小数点后一位,写出计算过程)。
I.铜及其化合物在生产、生活中有着广泛应用。最近科学家开发出石墨炔调控Cu单原子电催化剂(Cu1)实现CO2还原制备CH4,反应式为CO2(g)+4H2(g)
 CH4(g)+2H2O(g)。
CH4(g)+2H2O(g)。(1)基态Cu原子的未成对电子占据原子轨道的形状为
(2)上述反应涉及的化合物中,VSEPR模型和空间结构相同,且为非极性分子的是
Ⅱ.甘氨酸亚铁晶体是一种新型的固体螯合补铁剂。其实验室合成路线如下:
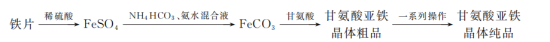
(3)写出上述合成路线中生成FeCO3沉淀的离子方程式:
(4)甘氨酸亚铁晶体结构的分析。
步骤1:准确称取甘氨酸亚铁晶体纯品0.4800g于锥形瓶中,加3mol·L-1H2SO4溶液15mL将样品溶解完全后,加入指示剂,立即用0.1000mol·L-1(NH4)2Ce(SO4)3标准液滴定至终点,用去标准液20.20mL(离子方程式为Ce4++Fe2+=Ce3++Fe3+)。
步骤2:不加产品,重复步骤1操作,滴定至终点,用去标准液0.20mL。
①滴定时应选择
②进一步分析表明:甘氨酸亚铁晶体中,阴阳离子只有H2NCH2COO-和Fe2+,且含2个结晶水;Fe2+的配位数为6,且存在五元螯合环;该配合物整体是中心对称,则甘氨酸亚铁晶体的结构示意图为
③计算甘氨酸亚铁晶体中铁元素的质量分数
您最近一年使用:0次
名校
解题方法
3 . O,O-二甲基-S-(N-甲基氨基甲酰甲基)硫代磷酸酯(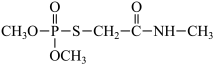 )是一种高效低毒的有机磷杀虫,杀螨剂,其合成路线如图所示:
)是一种高效低毒的有机磷杀虫,杀螨剂,其合成路线如图所示:
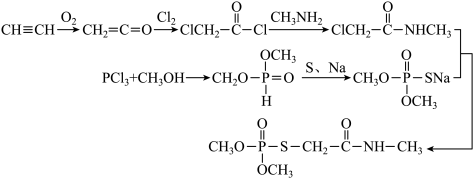
回答下列问题:
(1)CH≡CH分子中C原子与H原子以_____ (填“头碰头”或“肩并肩”)重叠形成C-Hσ键。
(2)熔、沸点比较:CH3NH2_____ (填“>”或“<”)CH3CH3,理由是_____ ;下列事实中,也能用该理由解释的是_____ (填标号)。
A.NH3极易溶于水 B.HF属于弱酸
C.冰的密度比干冰的小 D.H2O比CH4更难分解
(3)乙烯酮(CH2=C=O)生成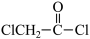 的过程中断裂的是
的过程中断裂的是_____ 键,理由是_____ 。
(4)已知P4(白磷)为正四面体结构,与氧气反应生成P4O10(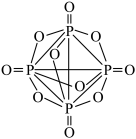 ),P4O10属于
),P4O10属于_____ (填“极性”或“非极性”)分子,该分子中σ键和π键的数目之比为_____ 。
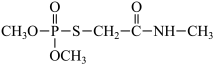 )是一种高效低毒的有机磷杀虫,杀螨剂,其合成路线如图所示:
)是一种高效低毒的有机磷杀虫,杀螨剂,其合成路线如图所示:
回答下列问题:
(1)CH≡CH分子中C原子与H原子以
(2)熔、沸点比较:CH3NH2
A.NH3极易溶于水 B.HF属于弱酸
C.冰的密度比干冰的小 D.H2O比CH4更难分解
(3)乙烯酮(CH2=C=O)生成
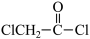 的过程中断裂的是
的过程中断裂的是(4)已知P4(白磷)为正四面体结构,与氧气反应生成P4O10(
 ),P4O10属于
),P4O10属于
您最近一年使用:0次
解题方法
4 . 环氧化物与 开环共聚反应是合成高附加值化学品的一种有效途径,两类
开环共聚反应是合成高附加值化学品的一种有效途径,两类 共聚物的合成路线如下(副产物为环状碳酸酯)。下列说法
共聚物的合成路线如下(副产物为环状碳酸酯)。下列说法不合理 的是

 开环共聚反应是合成高附加值化学品的一种有效途径,两类
开环共聚反应是合成高附加值化学品的一种有效途径,两类 共聚物的合成路线如下(副产物为环状碳酸酯)。下列说法
共聚物的合成路线如下(副产物为环状碳酸酯)。下列说法
A.E分子中 具有较强的极性 具有较强的极性 | B.可推测CTA中含有羟基 |
| C.高分子材料F、G有较强的耐酸碱性 | D.合成产品中含有副产物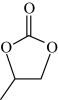 |
您最近一年使用:0次
名校
5 . 联碱法(侯氏制碱法)和氨碱法的生产流程简要表示如下图:_______ ,其中极性分子有________ ;属于离子化合物的是________ ,其中全部由非金属元素组成的离子化合物的电子式为_________ 。
(2)沉淀池中发生反应的化学方程式为___________ 。
(3)图中X是________ (填写化学式,下同),Y是________ ;Z中除了溶解的氨气和食盐外,其它溶质还有________ ;排出液W中的溶质除了Ca(OH)2外,还有___________ 。
(4)在氨碱法生产过程中氮可以循环使用而不需要补充,因此氨碱法总反应过程可用化学方程式表示为______ 。
(5)根据联碱法中从母液中提取氯化铵晶体的过程推测,所得结论正确的是______。
(6)联碱法中,每当通入NH344.8L(已折合成标准状况下)时可以得到纯碱100.0g,则NH3的利用率为______ ;相比于氨碱法,氯化钠的利用率从70%提高到90%以上,主要是设计了________ (填上述流程中的编号)。指出联碱法的另一项优点_______________ 。
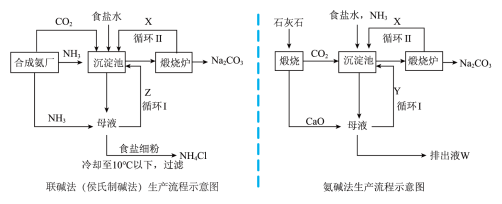
(2)沉淀池中发生反应的化学方程式为
(3)图中X是
(4)在氨碱法生产过程中氮可以循环使用而不需要补充,因此氨碱法总反应过程可用化学方程式表示为
(5)根据联碱法中从母液中提取氯化铵晶体的过程推测,所得结论正确的是______。
| A.常温时氯化铵的溶解度比氯化钠小 |
B.通入氨气能增大 的浓度,使氯化铵更多析出 的浓度,使氯化铵更多析出 |
C.加入食盐细粉能提高Na+的浓度,使 结晶析出 结晶析出 |
D.通入氨气能使 转化为 转化为 ,提高析出的NH4Cl纯度 ,提高析出的NH4Cl纯度 |
(6)联碱法中,每当通入NH344.8L(已折合成标准状况下)时可以得到纯碱100.0g,则NH3的利用率为
您最近一年使用:0次
解题方法
6 . 尿素 作为一种中性肥料,适用于各种土壤和植物。
作为一种中性肥料,适用于各种土壤和植物。
(1)十九世纪初,用氰酸银 与
与 在一定条件下反应制得
在一定条件下反应制得 ,实现了由无机物到有机物的合成。
,实现了由无机物到有机物的合成。
① 位于第五周期第ⅠB族,其基态原子的价层电子轨道表示式为
位于第五周期第ⅠB族,其基态原子的价层电子轨道表示式为______ 。
② 与
与 中的C原子杂化方式分别为
中的C原子杂化方式分别为______ 、______ 。
(2)二十世纪初,工业上以 和
和 为原料在一定温度和压强下合成
为原料在一定温度和压强下合成 :
: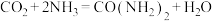 。
。
①上述物质中,属于非极性分子的是______ (填化学式)。
②键角比较:
______ (填“ ”或“
”或“ ”)
”) ,原因是
,原因是____________ 。
(3)尿素的结构和丙酮( )相似,相对分子质量相近,但常温下,丙酮是液体,尿素是固体,原因是
)相似,相对分子质量相近,但常温下,丙酮是液体,尿素是固体,原因是____________ 。
 作为一种中性肥料,适用于各种土壤和植物。
作为一种中性肥料,适用于各种土壤和植物。(1)十九世纪初,用氰酸银
 与
与 在一定条件下反应制得
在一定条件下反应制得 ,实现了由无机物到有机物的合成。
,实现了由无机物到有机物的合成。①
 位于第五周期第ⅠB族,其基态原子的价层电子轨道表示式为
位于第五周期第ⅠB族,其基态原子的价层电子轨道表示式为②
 与
与 中的C原子杂化方式分别为
中的C原子杂化方式分别为(2)二十世纪初,工业上以
 和
和 为原料在一定温度和压强下合成
为原料在一定温度和压强下合成 :
: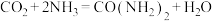 。
。①上述物质中,属于非极性分子的是
②键角比较:

 ”或“
”或“ ”)
”) ,原因是
,原因是(3)尿素的结构和丙酮(
 )相似,相对分子质量相近,但常温下,丙酮是液体,尿素是固体,原因是
)相似,相对分子质量相近,但常温下,丙酮是液体,尿素是固体,原因是
您最近一年使用:0次
名校
7 . 甲醇是易燃液体,能与水、乙醇、丙酮等混溶。甲醇燃烧热为 。工业使用原料气
。工业使用原料气 、
、 气相法合成甲醇的主反应:
气相法合成甲醇的主反应: 。有少量
。有少量 存在时,会发生副反应:
存在时,会发生副反应: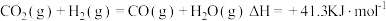 。甲醇是一种重要的工业原料,可用于制备二甲醚
。甲醇是一种重要的工业原料,可用于制备二甲醚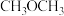 、甲醛、甲酸等有机物。下列说法正确的是
、甲醛、甲酸等有机物。下列说法正确的是
 。工业使用原料气
。工业使用原料气 、
、 气相法合成甲醇的主反应:
气相法合成甲醇的主反应: 。有少量
。有少量 存在时,会发生副反应:
存在时,会发生副反应: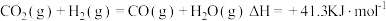 。甲醇是一种重要的工业原料,可用于制备二甲醚
。甲醇是一种重要的工业原料,可用于制备二甲醚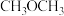 、甲醛、甲酸等有机物。下列说法正确的是
、甲醛、甲酸等有机物。下列说法正确的是A. 、 、 、 、 都属于非极性分子 都属于非极性分子 | B.用分液法分离甲醇和丙酮的二元混合物 |
| C.甲醇和二甲醚互为同分异构体 | D.甲醇和二氧化碳分子中碳原子杂化方式不同 |
您最近一年使用:0次
2024-04-02更新
|
300次组卷
|
2卷引用:江苏省海安高级中学2023-2024学年高三下学期开学考试化学试题
名校
解题方法
8 . 氮化硼(BN)是一种重要的功能陶瓷材料,以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如图所示,下列叙述正确的是


| A.NH3与BF3都是由极性键构成的极性分子 |
| B.六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,立方氮化硼晶胞中含有8个氮原子、8个硼原子 |
| C.NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一,1molNH4BF4含有配位键的数目为2NA |
| D.立方氮化硼和半导体材料氮化铝的结构均类似于金刚石,立方氮化硼的熔点小于氮化铝 |
您最近一年使用:0次
2024-03-21更新
|
242次组卷
|
2卷引用:河北省石家庄市第二十四中学2023-2024高二上学期期末考试化学试题
名校
9 . 氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如图所示。下列叙述正确的是
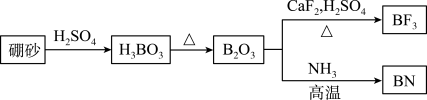
| A.NH3与BF3都是由极性键构成的极性分子 |
| B.六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,立方氮化硼晶胞中含有4个氮原子、4个硼原子 |
| C.NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一,lmolNH4BF4含有配位键的数目为NA |
| D.立方氮化硼和半导体材料氮化铝的结构均类似于金刚石,立方氮化硼的熔点小于氮化铝 |
您最近一年使用:0次
2022-05-16更新
|
1096次组卷
|
4卷引用:山东省肥城市2022届高考适应性训练(二)化学试题
名校
10 . 工业上,一氧化碳是一碳化学的基础,可用于物质的合成与纯化等。
(1)二氧化碳和木炭还原法是工业制备CO的方法之一,利用如图关系计算:C(石墨)

___________ 。

(2)羰基硫(COS)是一种粮食熏蒸剂,能防止某些昆虫和真菌的危害,一氧化碳可用于羰基硫的合成。在容积不变的密闭容器中,使CO和H2S发生下列反应并达到平衡: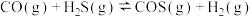

①若反应前CO物质的量为10mol,达到平衡时CO的物质的量为8mol,且化学平衡常数为0.1。下列说法正确的是___________ (填字母)。
a.通入CO后,正反应速率逐渐增大
b.反应前H2S物质的量为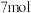
c.达到平衡时CO的转化率为80%
②画出在不同温度下达到化学平衡时,H2S的转化率随温度变化示意图___________ (画出变化趋势即可)。
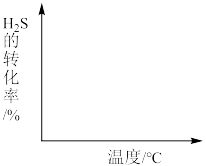
③已知羰基硫(COS)分子中所有原子的最外层都满足8电子结构,则下列有关说法正确的是________ 。
A.羰基硫属于非极性分子
B.羰基硫的沸点比CO2低
C.羰基硫分子中三个原子处于同一直线上
(3)羰化冶金工艺是气化冶金技术的重要分支,其原理是利用Ⅷ族过渡金属与一氧化碳反应,生成易挥发的羰基化合物进行分离提取金属的一种方法。以某镍合金为原料的羰基工艺流程如下图所示:

“热交换”步骤涉及的反应有:
I.
II.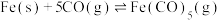
III.
IV.
①温度不变时提高反应I中Ni(CO)4的产率,可采取的措施___________ (答一条即可)。
②Ni(CO)4的沸点为:43℃,其分解温度也只有60℃,Fe(CO)5的沸点为:106℃,精馏的温度范围应控制在___________ ℃。
③实际生产中要调整合成原料中铜元素与硫元素的质量比为___________ 。
④Cu、Au不在VIII族,不易生成羰基化合物。在元素周期表中Au跟Cu处在同一列,则Au位于_____ 族。
(1)二氧化碳和木炭还原法是工业制备CO的方法之一,利用如图关系计算:C(石墨)



(2)羰基硫(COS)是一种粮食熏蒸剂,能防止某些昆虫和真菌的危害,一氧化碳可用于羰基硫的合成。在容积不变的密闭容器中,使CO和H2S发生下列反应并达到平衡:
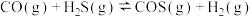

①若反应前CO物质的量为10mol,达到平衡时CO的物质的量为8mol,且化学平衡常数为0.1。下列说法正确的是
a.通入CO后,正反应速率逐渐增大
b.反应前H2S物质的量为
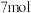
c.达到平衡时CO的转化率为80%
②画出在不同温度下达到化学平衡时,H2S的转化率随温度变化示意图

③已知羰基硫(COS)分子中所有原子的最外层都满足8电子结构,则下列有关说法正确的是
A.羰基硫属于非极性分子
B.羰基硫的沸点比CO2低
C.羰基硫分子中三个原子处于同一直线上
(3)羰化冶金工艺是气化冶金技术的重要分支,其原理是利用Ⅷ族过渡金属与一氧化碳反应,生成易挥发的羰基化合物进行分离提取金属的一种方法。以某镍合金为原料的羰基工艺流程如下图所示:

“热交换”步骤涉及的反应有:
I.

II.
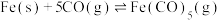
III.

IV.

①温度不变时提高反应I中Ni(CO)4的产率,可采取的措施
②Ni(CO)4的沸点为:43℃,其分解温度也只有60℃,Fe(CO)5的沸点为:106℃,精馏的温度范围应控制在
③实际生产中要调整合成原料中铜元素与硫元素的质量比为
④Cu、Au不在VIII族,不易生成羰基化合物。在元素周期表中Au跟Cu处在同一列,则Au位于
您最近一年使用:0次



