解题方法
1 . 研究元素周期表右上角区域元素,有利于研发新型绿色农药,如 等。
等。
 和
和 的混合气体经光解作用可生成一种新分子
的混合气体经光解作用可生成一种新分子
①
 中S
中S 键。
键。②下列分子中属于非极性分子的是
a. b.
b. c.
c. d.
d.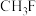 e.
e.
 、
、 中沸点较高的是
中沸点较高的是(3)下列物质变化,只与范德华力有关的是
A.干冰熔化 B.乙酸汽化 C.乙醇与HCHO混溶
D. 溶于水 E.碘溶于四氯化碳
溶于水 E.碘溶于四氯化碳
 。推测酸性:
。推测酸性:
 。
。(5)最近我国某科研团队用磷化钴纳米片催化合成氧化偶氯、偶氯、胺类芳香化合物,反应原理为
 。
。P与N属于同主族元素,但是 不能稳定存在的原因
不能稳定存在的原因
您最近一年使用:0次
解题方法
2 . 如图是元素周期表的一部分,根据元素在周期表中的位置,回答下列问题:_______ ,其最高能层的电子占据的原子轨道电子云轮廓为_______ 形。若将其最高价氧化物的水化物溶于氨水中可得到一种透明的深蓝色溶液,写出反应的化学方程式为:_______ 。
(2)第二周期所有元素中第一电离能介于⑤⑦之间的有_______ 种。由②③④形成的简单离子半径由小到大顺序是_______ (填化学用语)。
(3)元素⑦⑧可形成原子个数比为1:1的共价化合物,分子中各原子最外层均达到8电子的稳定结构,试写出其结构式_______ ,该分子为_______ (填“极性分子”或“非极性分子”。
(4)元素②⑥可形成的化合物是一种性质优良的无机非金属材料,根据元素周期律知识,写出其化学式_______ ,它的熔点高,硬度大,电绝缘性好,化学性质稳定,它的晶体类型是_______ 。
(5)下列有关性质的比较正确且能用元素周期律解释的是_______(填标号)。
(6)一种由②和⑤两种元素形成化合物的晶胞如图所示,该晶胞的化学式为_______ 。

(2)第二周期所有元素中第一电离能介于⑤⑦之间的有
(3)元素⑦⑧可形成原子个数比为1:1的共价化合物,分子中各原子最外层均达到8电子的稳定结构,试写出其结构式
(4)元素②⑥可形成的化合物是一种性质优良的无机非金属材料,根据元素周期律知识,写出其化学式
(5)下列有关性质的比较正确且能用元素周期律解释的是_______(填标号)。
| A.第一电离能:②>③ |
| B.单质的氧化性:⑦>⑧ |
| C.最高价氧化物对应的水化物的碱性:④>⑤ |
| D.氢化物的沸点:③>⑦ |
(6)一种由②和⑤两种元素形成化合物的晶胞如图所示,该晶胞的化学式为

您最近一年使用:0次
名校
3 . 使用铜基催化剂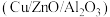 ,以
,以 和
和 合成
合成 是大规模实现低碳减排和清洁能源再生产的有效路径。回答下列问题:
是大规模实现低碳减排和清洁能源再生产的有效路径。回答下列问题:
(1) 的
的 模型名称是
模型名称是___________ , 分子中O的杂化轨道类型是
分子中O的杂化轨道类型是___________ 。
(2)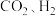 和
和 中,属于极性分子的是
中,属于极性分子的是___________ ,由非极性键结合成的非极性分子是___________ 。
(3) 的沸点
的沸点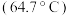 介于
介于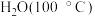 和
和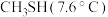 之间,其原因是
之间,其原因是___________ 。
(4) 属于
属于___________ 晶体, 属于
属于___________ 晶体。
(5) 的一种立方晶胞结构如图所示,每个
的一种立方晶胞结构如图所示,每个 周围与它最近且相等距离的
周围与它最近且相等距离的 有
有___________ 个。若该立方晶胞参数为 ,则正负离子的核间距最小为
,则正负离子的核间距最小为___________  ,晶体密度
,晶体密度
___________  (列出算式,阿伏加德罗常数的值为
(列出算式,阿伏加德罗常数的值为 )。
)。
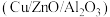 ,以
,以 和
和 合成
合成 是大规模实现低碳减排和清洁能源再生产的有效路径。回答下列问题:
是大规模实现低碳减排和清洁能源再生产的有效路径。回答下列问题:(1)
 的
的 模型名称是
模型名称是 分子中O的杂化轨道类型是
分子中O的杂化轨道类型是(2)
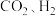 和
和 中,属于极性分子的是
中,属于极性分子的是(3)
 的沸点
的沸点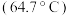 介于
介于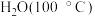 和
和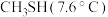 之间,其原因是
之间,其原因是(4)
 属于
属于 属于
属于(5)
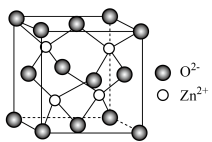
 的一种立方晶胞结构如图所示,每个
的一种立方晶胞结构如图所示,每个 周围与它最近且相等距离的
周围与它最近且相等距离的 有
有 ,则正负离子的核间距最小为
,则正负离子的核间距最小为 ,晶体密度
,晶体密度
 (列出算式,阿伏加德罗常数的值为
(列出算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
名校
解题方法
4 . 按要求回答下列问题:
(1)基态钛原子核外共有________ 种空间运动状态不相同的电子。Cu在周期表中的位置为________________________ ,基态Ni2+的价层电子排布式为________________________ ,Zn位于元素周期表的________________ 区。
(2)分子极性:CH4________ NH3(填“>”或“<”),熔沸点:CH4________ NH3(填“>”或“<”),键角:CH4________ NH3(填“>”或“<”)。
(3)组成为 ,配位数为6的晶体有两种。其中一种物质X呈绿色。实验表明,
,配位数为6的晶体有两种。其中一种物质X呈绿色。实验表明, 恰好与
恰好与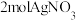 反应生成沉淀。则X的化学式为
反应生成沉淀。则X的化学式为________ 。(表示出内界和外界)
(1)基态钛原子核外共有
(2)分子极性:CH4
(3)组成为
 ,配位数为6的晶体有两种。其中一种物质X呈绿色。实验表明,
,配位数为6的晶体有两种。其中一种物质X呈绿色。实验表明, 恰好与
恰好与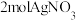 反应生成沉淀。则X的化学式为
反应生成沉淀。则X的化学式为
您最近一年使用:0次
名校
解题方法
5 . 一碳化学是 资源化利用中的重要部分。
资源化利用中的重要部分。
I. 合成甲醇是一种有效利用
合成甲醇是一种有效利用 的方式。研究发现,用钴氧化物负载的锰氧化物纳米粒子可在低压下较好地催化该反应。
的方式。研究发现,用钴氧化物负载的锰氧化物纳米粒子可在低压下较好地催化该反应。
(1) 元素位于周期表的第
元素位于周期表的第_________ 周期、第_________ 族、_________ (填“s”、“p”、“d”或“ds”)区。
(2)基态 原子的价电子排布式为
原子的价电子排布式为__________________ ,其所含的未成对电子数为_________ 。
II.甲醇空气氧化法是生产工业甲醛的常用方法。发生的反应为: 的空间结构为
的空间结构为_________ ,它是一个_________ (填“极性”或“非极性”)分子。
(4)甲醇氯化生成 时,会产生
时,会产生 等副产物。相间条件下,
等副产物。相间条件下, 的沸点比
的沸点比 的高,主要原因为
的高,主要原因为__________________ 。
 资源化利用中的重要部分。
资源化利用中的重要部分。I.
 合成甲醇是一种有效利用
合成甲醇是一种有效利用 的方式。研究发现,用钴氧化物负载的锰氧化物纳米粒子可在低压下较好地催化该反应。
的方式。研究发现,用钴氧化物负载的锰氧化物纳米粒子可在低压下较好地催化该反应。(1)
 元素位于周期表的第
元素位于周期表的第(2)基态
 原子的价电子排布式为
原子的价电子排布式为II.甲醇空气氧化法是生产工业甲醛的常用方法。发生的反应为:

 的空间结构为
的空间结构为(4)甲醇氯化生成
 时,会产生
时,会产生 等副产物。相间条件下,
等副产物。相间条件下, 的沸点比
的沸点比 的高,主要原因为
的高,主要原因为
您最近一年使用:0次
解题方法
6 . 已知 是原子序数依次增大的前四周期元素,其元素性质或原子结构如表:
是原子序数依次增大的前四周期元素,其元素性质或原子结构如表:
(1)A的最高价氧化物是___________ 分子。(填“极性”或“非极性”)
(2) 的空间结构为
的空间结构为___________ ,其中心原子的杂化方式为___________ 杂化。
(3)C的气态氢化物沸点是同族元素氢化物沸点中最高的,其原因是___________ 。
(4) 属于
属于___________ 区的元素,其基态原子的价层电子轨道表示式为___________ 。
(5) 的基态原子的电子排布式为
的基态原子的电子排布式为___________ ,在周期表中位置___________ 。
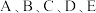 是原子序数依次增大的前四周期元素,其元素性质或原子结构如表:
是原子序数依次增大的前四周期元素,其元素性质或原子结构如表: | 原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
 | 原子最高能级的不同轨道都有电子,且自旋方向相同 |
 | 在周期表所有元素中电负性最大 |
 | 位于周期表中第4纵列 |
 | 基态原子 层全充满, 层全充满, 层只有一个电子 层只有一个电子 |
(2)
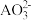 的空间结构为
的空间结构为(3)C的气态氢化物沸点是同族元素氢化物沸点中最高的,其原因是
(4)
 属于
属于(5)
 的基态原子的电子排布式为
的基态原子的电子排布式为
您最近一年使用:0次
解题方法
7 . 尿素 作为一种中性肥料,适用于各种土壤和植物。
作为一种中性肥料,适用于各种土壤和植物。
(1)十九世纪初,用氰酸银 与
与 在一定条件下反应制得
在一定条件下反应制得 ,实现了由无机物到有机物的合成。
,实现了由无机物到有机物的合成。
① 位于第五周期第ⅠB族,其基态原子的价层电子轨道表示式为
位于第五周期第ⅠB族,其基态原子的价层电子轨道表示式为______ 。
② 与
与 中的C原子杂化方式分别为
中的C原子杂化方式分别为______ 、______ 。
(2)二十世纪初,工业上以 和
和 为原料在一定温度和压强下合成
为原料在一定温度和压强下合成 :
: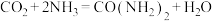 。
。
①上述物质中,属于非极性分子的是______ (填化学式)。
②键角比较:
______ (填“ ”或“
”或“ ”)
”) ,原因是
,原因是____________ 。
(3)尿素的结构和丙酮( )相似,相对分子质量相近,但常温下,丙酮是液体,尿素是固体,原因是
)相似,相对分子质量相近,但常温下,丙酮是液体,尿素是固体,原因是____________ 。
 作为一种中性肥料,适用于各种土壤和植物。
作为一种中性肥料,适用于各种土壤和植物。(1)十九世纪初,用氰酸银
 与
与 在一定条件下反应制得
在一定条件下反应制得 ,实现了由无机物到有机物的合成。
,实现了由无机物到有机物的合成。①
 位于第五周期第ⅠB族,其基态原子的价层电子轨道表示式为
位于第五周期第ⅠB族,其基态原子的价层电子轨道表示式为②
 与
与 中的C原子杂化方式分别为
中的C原子杂化方式分别为(2)二十世纪初,工业上以
 和
和 为原料在一定温度和压强下合成
为原料在一定温度和压强下合成 :
: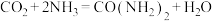 。
。①上述物质中,属于非极性分子的是
②键角比较:

 ”或“
”或“ ”)
”) ,原因是
,原因是(3)尿素的结构和丙酮(
 )相似,相对分子质量相近,但常温下,丙酮是液体,尿素是固体,原因是
)相似,相对分子质量相近,但常温下,丙酮是液体,尿素是固体,原因是
您最近一年使用:0次
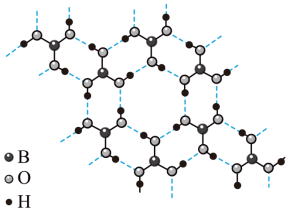
8 . 硼酸(H3BO3)在电子器件工业和医疗上有重要用途。它是一种白色片状晶体,具有类似于石墨的层状结构,有滑腻感。H3BO3的层内结构如下图所示。___________ (填“极性”或“非极性”)共价键。
(2)H3BO3层内结构中,虚线部分表示存在___________ (填序号)。
a.离子键 b.配位键 c.氢键
H3BO3在热水中溶解度增大,原因是___________ 。
(3)H3BO3可由BCl3水解得到。
①依据价电子对互斥理论(VSEPR)推测,BCl3的空间结构为___________ 。
②BCl3属于___________ (填“极性”或“非极性”)分子。
(4)H3BO3是一元酸,在水溶液中发生如下过程:H3BO3+H2O⇌ +H+。
+H+。
①[B(OH)4]-中硼原子的杂化方式为___________ 。
②用中和滴定法测定H3BO3纯度。
取agH3BO3样品(所含杂质不与NaOH反应),用0.5mol·L−1NaOH溶液滴定至终点,消耗NaOH溶液VmL,测得H3BO3的纯度为___________ (用质量分数表示)。
(2)H3BO3层内结构中,虚线部分表示存在
a.离子键 b.配位键 c.氢键
H3BO3在热水中溶解度增大,原因是
(3)H3BO3可由BCl3水解得到。
①依据价电子对互斥理论(VSEPR)推测,BCl3的空间结构为
②BCl3属于
(4)H3BO3是一元酸,在水溶液中发生如下过程:H3BO3+H2O⇌
 +H+。
+H+。①[B(OH)4]-中硼原子的杂化方式为
②用中和滴定法测定H3BO3纯度。
取agH3BO3样品(所含杂质不与NaOH反应),用0.5mol·L−1NaOH溶液滴定至终点,消耗NaOH溶液VmL,测得H3BO3的纯度为
您最近一年使用:0次
解题方法
9 . A、B、C、D、E为短周期的五种非金属元素,其中A、B、C的基态原子的价层电子排布式分别为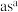 、
、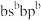 、
、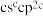 ,D与B同主族,E位于C的下一周期,且E是同周期元素中电负性最大的。试回答下列问题:
,D与B同主族,E位于C的下一周期,且E是同周期元素中电负性最大的。试回答下列问题:
(1)由A、B、C、D、E五种元素中的两种或三种元素可组成多种物质,分子① 、②
、②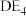 、③
、③ 、④
、④ 中,属于极性分子的是
中,属于极性分子的是_______ (填序号,下同),中心原子采取 杂化的是
杂化的是_______ 。
(2)A、B两元素能组成一种分子中原子个数比为1:1的常见溶剂,其分子式为_______ ,相同条件下,该物质在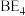 中的溶解度
中的溶解度_______ (填“大于”或“小于”)其在 中的溶解度。
中的溶解度。
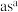 、
、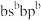 、
、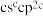 ,D与B同主族,E位于C的下一周期,且E是同周期元素中电负性最大的。试回答下列问题:
,D与B同主族,E位于C的下一周期,且E是同周期元素中电负性最大的。试回答下列问题:(1)由A、B、C、D、E五种元素中的两种或三种元素可组成多种物质,分子①
 、②
、②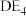 、③
、③ 、④
、④ 中,属于极性分子的是
中,属于极性分子的是 杂化的是
杂化的是(2)A、B两元素能组成一种分子中原子个数比为1:1的常见溶剂,其分子式为
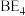 中的溶解度
中的溶解度 中的溶解度。
中的溶解度。
您最近一年使用:0次
10 . 某学习小组探究卤素单质参与氧化还原反应原理,试从电化学角度分析物质氧化性和还原性的变化规律。
(1)实验需要配制200mL 1.0mol·L-1的KCl溶液,下图所示的仪器中,配制溶液不需要的是___________ (填选项),配制上述溶液还需用到的玻璃仪器有烧杯、玻璃棒和___________ (填仪器名称)。___________ 。
(3)电化学中,将有转化关系的、含相同主要元素的氧化型物质和还原型物质称作一个电对(如MnO2/Mn2+、Cl2/Cl-等)。每个电对都有一个电极电势(φ),其数值越高,意味着电对中氧化型物质转化为还原型物质的能力越强;反之,其数值越低,意味着电对中还原型物质转化为氧化型物质的能力越强。两个不同电对可以构成一个氧化还原反应,其中电极电势高的电对发生还原反应,体现氧化性;电极电势低的电对发生氧化反应,体现还原性。例如强酸性条件下:φ(MnO2/Mn2+)>φ(Cl2/Cl-)
则可发生反应:MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O。
小组成员通过查阅资料得知:
①溶液中的c(H+)会影响电对的电极电势大小;
②溶液中的氧化型物质浓度越大,电极电势越高;溶液中的还原型物质浓度越大,电极电势越低;
③构成氧化还原反应的两个电对的电极电势差值越大,反应越易发生;反之则越难发生。小组成员发现,浓盐酸与MnO2混合加热生成氯气,当氯气不再逸出时,反应体系(固液混合物A)中仍存在盐酸和MnO2,根据以上资料,小组成员提出以下猜想:
i.随c(H+)降低,φ(MnO2/Mn2+)降低,MnO2氧化性减弱。
ii.随c(Cl-)降低,φ(Cl2/Cl-)___________ ,Cl-还原性___________ 。
iii.随c(Mn2+)升高,φ(MnO2/Mn2+)降低,MnO2氧化性减弱。
随后小组设计了下列实验验证了他们的猜想,补充完整下列实验表格:
根据以上实验结论,小组成员进一步设计实验,定量探究相同浓度卤素离子(Cl-、Br-、I-)的还原性强弱。实验可选药品及设备有:均为1mol/L的KCl溶液、KBr溶液和KI溶液,6mol/L的H2SO4溶液,12mol/L的HCl溶液,MnO2固体,蒸馏水,pH传感器,试管,胶头滴管。请设计实验方案(不考虑尾气处理和试管容积限制):___________ 。
(4)实验中得到一种卤素单质,将其提纯后得到紫色易升华晶体。它在生活中的一种用途为___________ ;它在CCl4中的溶解度大于在H2O或C2H5OH中的溶解度,请说出原因:___________ 。
(1)实验需要配制200mL 1.0mol·L-1的KCl溶液,下图所示的仪器中,配制溶液不需要的是

(3)电化学中,将有转化关系的、含相同主要元素的氧化型物质和还原型物质称作一个电对(如MnO2/Mn2+、Cl2/Cl-等)。每个电对都有一个电极电势(φ),其数值越高,意味着电对中氧化型物质转化为还原型物质的能力越强;反之,其数值越低,意味着电对中还原型物质转化为氧化型物质的能力越强。两个不同电对可以构成一个氧化还原反应,其中电极电势高的电对发生还原反应,体现氧化性;电极电势低的电对发生氧化反应,体现还原性。例如强酸性条件下:φ(MnO2/Mn2+)>φ(Cl2/Cl-)
则可发生反应:MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O。
小组成员通过查阅资料得知:
①溶液中的c(H+)会影响电对的电极电势大小;
②溶液中的氧化型物质浓度越大,电极电势越高;溶液中的还原型物质浓度越大,电极电势越低;
③构成氧化还原反应的两个电对的电极电势差值越大,反应越易发生;反之则越难发生。小组成员发现,浓盐酸与MnO2混合加热生成氯气,当氯气不再逸出时,反应体系(固液混合物A)中仍存在盐酸和MnO2,根据以上资料,小组成员提出以下猜想:
i.随c(H+)降低,φ(MnO2/Mn2+)降低,MnO2氧化性减弱。
ii.随c(Cl-)降低,φ(Cl2/Cl-)
iii.随c(Mn2+)升高,φ(MnO2/Mn2+)降低,MnO2氧化性减弱。
随后小组设计了下列实验验证了他们的猜想,补充完整下列实验表格:
| 组别 | 实验操作 | 滴加试剂 | 实验现象 | 实验结论 |
| I |
| 较浓H2SO4 | 猜想i正确 | |
| Ⅱ | KCl溶液 | 有氯气 | 猜想ii正确 | |
| Ⅲ | KCl溶液+MnSO4溶液 | 无氯气 | 猜想iii |
(4)实验中得到一种卤素单质,将其提纯后得到紫色易升华晶体。它在生活中的一种用途为
您最近一年使用:0次




