名校
1 . 类推的思维方法在化学学习中应用广泛,但类推出的结论需经过实践的检验才能确定其正确与否。下列几种类推结论错误的是
| A.Al(OH)3能与NaOH溶液反应,则Be(OH)2也能与NaOH溶液反应 |
| B.SO2是“V形”分子,则O3是“V形”分子 |
| C.第二周期元素氢化物稳定性:H2O>HF>NH3,则第三周期元素氢化物稳定性:H2S>HCl>PH3 |
| D.工业制Mg采用电解熔融MgCl2的方法,则工业制Al也可采用电解熔融AlCl3的方法 |
您最近一年使用:0次
2023高三·全国·专题练习
2 . X、Y、Z、W是短周期同一周期的主族元素,原子序数依次增大;基态X的价层电子轨道表示式为 ,Z最外层电子数是其次外层电子数的3倍;四种元素与锂组成的化合物结构如图(箭头表示配位键)。下列说法正确的是
,Z最外层电子数是其次外层电子数的3倍;四种元素与锂组成的化合物结构如图(箭头表示配位键)。下列说法正确的是
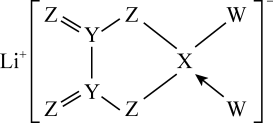
 ,Z最外层电子数是其次外层电子数的3倍;四种元素与锂组成的化合物结构如图(箭头表示配位键)。下列说法正确的是
,Z最外层电子数是其次外层电子数的3倍;四种元素与锂组成的化合物结构如图(箭头表示配位键)。下列说法正确的是
| A.四种元素中第一电离能最大的是W |
| B.Y和Z形成的化合物常温下均易溶于水 |
| C.X的最高价氧化物对应的水化物是一种强酸 |
| D.Z和W分别与氢元素形成的10电子化合物的沸点:前者高于后者 |
您最近一年使用:0次
名校
3 . 一种合成药物中间体的结构式如图所示,X、Y、Z、W为短周期主族元素,且X、Y、Z的原子序数之和等于W的原子序数。下列说法正确的是


| A.电负性W<X<Y |
| B.第一电离能Y<W<Z |
| C.简单气态氢化物的沸点W比Z的高 |
| D.W的基态原子的核外电子共占据8个轨道 |
您最近一年使用:0次
2023-04-28更新
|
123次组卷
|
2卷引用:山东省德州市2022-2023学年高二下学期4月期中考试化学试题
4 . 正硼酸(H3BO3)是一种片层状结构白色晶体,有与石墨相似的层状结构,受热易分解,层内的H3BO3分子通过氢键相连(如图所示),则下列有关说法中不正确的是


| A.正硼酸晶体属于分子晶体 |
| B.正硼酸分子的稳定性与氢键有关 |
| C.1molH3BO3晶体中含有3mol氢键 |
| D.B原子杂化轨道的类型为sp2,层间的H3BO3分子通过共价键相连 |
您最近一年使用:0次
名校
5 . 下列对一些实验事实的理论解释正确的是
| 选项 | 实验事实 | 理论解释 |
| A | N原子的第一电离能大于O原子 | N原子2p轨道半充满 |
| B |  为直线形分子 为直线形分子 |  分子中C=O之间的夹角为180° 分子中C=O之间的夹角为180° |
| C |  极易溶于水 极易溶于水 |  与 与 发生化学反应 发生化学反应 |
| D | HF的沸点高于HCl | HF相对分子质量小于HCl |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-03-17更新
|
203次组卷
|
2卷引用:山东省青岛第五十八中学2022-2023学年高二上学期期末考试化学试题
6 . 下列有关H2S和H2O2性质的解释合理的是
| 选项 | 性质 | 解释 |
| A | 常温下,H2O2呈液态,H2S呈气态 | H2O2分子间存在氢键,而H2S分子间不存在氢键 |
| B | 双氧水中存在[H3O2]+ | H2O2中氧有孤电子对,H+有空轨道,能形成配位键 |
| C | H2O2能氧化H2S | H2O2中氧的化合价只能降低 |
| D | H2S溶液中存在S2- | H2S是离子化合物 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
7 . 利用超分子可以对一些物质进行分离,例如利用杯酚(杯酚用“ ”表示)分离C60和C70的过程如图所示。下列说法错误的是
”表示)分离C60和C70的过程如图所示。下列说法错误的是
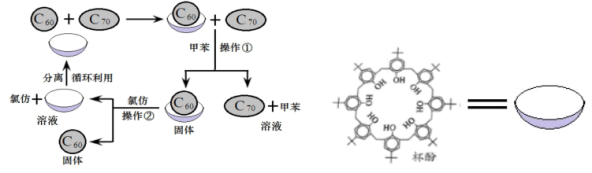
 ”表示)分离C60和C70的过程如图所示。下列说法错误的是
”表示)分离C60和C70的过程如图所示。下列说法错误的是
A.晶体熔点:杯酚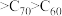 |
| B.操作①用到的玻璃仪器有分液漏斗和烧杯 |
| C.杯酚与C60分子之间形成分子间氢键 |
| D.杯酚易溶于氯仿,难溶于甲苯 |
您最近一年使用:0次
解题方法
8 . W、X、Y、Z为原子序数依次增大,且分属于三个不同周期的短周期主族元素,X、Y同周期。X、Y、Z可形成一种无色剧毒气体(结构如图所示),下列说法错误的是


| A.X、Y、Z形成的简单氢化物中Y的氢化物熔沸点最高 |
| B.Z元素形成的含氧酸均为强酸 |
| C.W与X、Y均能形成至少2种二元化合物 |
| D.原子半径X小于Y |
您最近一年使用:0次
名校
解题方法
9 . 下列对一些实验事实的理论解释正确的是
| 选项 | 实验事实 | 理论解释 |
| A |  、NH3空间构型为三角锥 、NH3空间构型为三角锥 |  、NH3中心原子均为sp3杂化且均有一对孤对电子 、NH3中心原子均为sp3杂化且均有一对孤对电子 |
| B | 白磷为正四面体分子 | 白磷分子中P—Р键间的夹角是109.5° |
| C | HF的沸点高于HCl | H—F的键能比H—Cl的键能大 |
| D | 硼酸固体难溶于水,加热溶解度增大 | 加热后,硼酸分子之间的氢键部分断裂,与水分子产生氢键作用 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-05-19更新
|
346次组卷
|
2卷引用:山东省青岛胶州市2020-2021学年高二下学期期中考试化学试题
名校
10 . 有下列两组命题
B组中命题正确,且能用A组命题加以正确解释的是
| A组 | B组 |
| Ⅰ.氢键比普通分子间作用力更强 | ①H2O比H2S稳定 |
| Ⅱ.N元素的电负性大于P元素 | ②NH3比PH3沸点高 |
| Ⅲ.等电子体某些性质相似 | ③N2、CO熔沸点相近 |
| Ⅳ.元素第一电离能大小与原子外围电子排布有关,不一定像电负性随原子序数递增而增大 | ④同周期元素第一电离能大的,电负性不一定大 |
| A.Ⅰ① | B.Ⅱ② | C.Ⅲ③ | D.Ⅳ④ |
您最近一年使用:0次



