1 . 黄铜矿(主要成分为CuFeS2)是一种天然矿石。中国在商代或更早就掌握了由它冶炼铜的技术。医药上,黄铜矿有促进骨折愈合的作用。请回答下列问题:
(1)基态Cu+比Cu2+稳定的原因是___ 。
(2)SO 的空间构型为
的空间构型为___ ,与SO 互为等电子体的离子是
互为等电子体的离子是___ (写出一种化学式即可)。
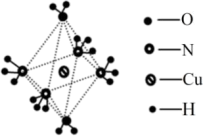
(3)图为某阳离子的结构,加热时该离子先失去的配位体是___ (填化学式),原因是___ 。
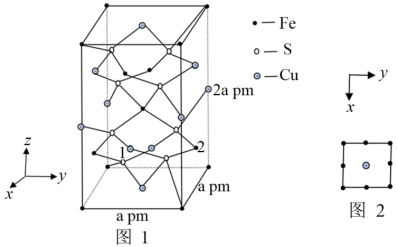
(4)四方晶系的CuFeS2晶胞结构如图1所示。
①CuFeS2中各元素电负性数值从小到大的顺序为___ ,晶胞中S原子的杂化方式为___ 。
②晶胞中Cu和Fe的投影位置如图2所示。设阿伏加德罗常数的值为NA,则该晶体的密度为___ g·cm-3。
③以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1的坐标为( ,
, ,
, ),则原子2的坐标为
),则原子2的坐标为___ 。晶体中距离Fe最近的S有___ 个。
(1)基态Cu+比Cu2+稳定的原因是
(2)SO
 的空间构型为
的空间构型为 互为等电子体的离子是
互为等电子体的离子是(3)图为某阳离子的结构,加热时该离子先失去的配位体是

(4)四方晶系的CuFeS2晶胞结构如图1所示。
①CuFeS2中各元素电负性数值从小到大的顺序为
②晶胞中Cu和Fe的投影位置如图2所示。设阿伏加德罗常数的值为NA,则该晶体的密度为
③以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1的坐标为(
 ,
, ,
, ),则原子2的坐标为
),则原子2的坐标为
您最近一年使用:0次
2021-10-05更新
|
926次组卷
|
8卷引用:2021年秋季高三化学开学摸底考试卷03(广东专用)
(已下线)2021年秋季高三化学开学摸底考试卷03(广东专用)河北省实验中学2022届高三年级上学期开学考试化学试题清华大学中学生标准学术能力诊断性测试2022届高三2021年7月诊断性测试化学试题(已下线)第十二章能力提升检测卷(精练)-2022年一轮复习讲练测河北省石家庄市第二中学2022届高三补偿诊断性考试(已下线)专题十一 能力提升检测卷 (测) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)备战2022年高考化学精准检测卷【全国卷】01(已下线)专题十 物质结构与性质(选择性必修2)能力提升检测卷(测)-2023年高考化学一轮复习讲练测(新教材新高考)
解题方法
2 .  、
、 、
、 、
、 四种元素,
四种元素, 最高能级电子排布式为
最高能级电子排布式为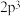 ,
, 元素的单质只能作氧化剂,
元素的单质只能作氧化剂, 是第三周期元素,其第1到第5电离能(
是第三周期元素,其第1到第5电离能( )数据如下:578、1817、2745、11575、14830,
)数据如下:578、1817、2745、11575、14830, 原子核外有14种不同的运动状态。回答下列问题:
原子核外有14种不同的运动状态。回答下列问题:
(1)基态 原子的电子排布式为
原子的电子排布式为_______ , 元素所在族第一电离能最大的前三种元素(按大→小顺序)分别是
元素所在族第一电离能最大的前三种元素(按大→小顺序)分别是_______ , 元素位于周期表中
元素位于周期表中_______ 区。
(2)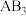 、
、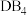 两种分子中,
两种分子中, 原子杂化轨道类型为
原子杂化轨道类型为_______ ,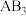 的分子构型为
的分子构型为_______ ;写出与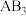 具有相同空间构型和键合形式的一种分子的化学式:
具有相同空间构型和键合形式的一种分子的化学式:_______ 。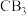 的熔点是1040℃,则该晶体中结构粒子间的相互作用类型为
的熔点是1040℃,则该晶体中结构粒子间的相互作用类型为_______ 。
(3) 、
、 两元素形成的常见氢化物的沸点
两元素形成的常见氢化物的沸点 ,其最主要的原因是
,其最主要的原因是_______ 。
(4) 与铜元素(黑球代表
与铜元素(黑球代表 )形成的某种化合物的晶胞结构如图所示,则该物质的化学式为
)形成的某种化合物的晶胞结构如图所示,则该物质的化学式为_______ ,若该晶体的密度为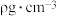 ,该晶体的晶胞参数
,该晶体的晶胞参数
_______  (设阿伏加德罗常数的值为
(设阿伏加德罗常数的值为 )。
)。

 、
、 、
、 、
、 四种元素,
四种元素, 最高能级电子排布式为
最高能级电子排布式为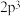 ,
, 元素的单质只能作氧化剂,
元素的单质只能作氧化剂, 是第三周期元素,其第1到第5电离能(
是第三周期元素,其第1到第5电离能( )数据如下:578、1817、2745、11575、14830,
)数据如下:578、1817、2745、11575、14830, 原子核外有14种不同的运动状态。回答下列问题:
原子核外有14种不同的运动状态。回答下列问题:(1)基态
 原子的电子排布式为
原子的电子排布式为 元素所在族第一电离能最大的前三种元素(按大→小顺序)分别是
元素所在族第一电离能最大的前三种元素(按大→小顺序)分别是 元素位于周期表中
元素位于周期表中(2)
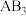 、
、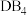 两种分子中,
两种分子中, 原子杂化轨道类型为
原子杂化轨道类型为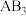 的分子构型为
的分子构型为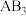 具有相同空间构型和键合形式的一种分子的化学式:
具有相同空间构型和键合形式的一种分子的化学式: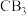 的熔点是1040℃,则该晶体中结构粒子间的相互作用类型为
的熔点是1040℃,则该晶体中结构粒子间的相互作用类型为(3)
 、
、 两元素形成的常见氢化物的沸点
两元素形成的常见氢化物的沸点 ,其最主要的原因是
,其最主要的原因是(4)
 与铜元素(黑球代表
与铜元素(黑球代表 )形成的某种化合物的晶胞结构如图所示,则该物质的化学式为
)形成的某种化合物的晶胞结构如图所示,则该物质的化学式为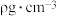 ,该晶体的晶胞参数
,该晶体的晶胞参数
 (设阿伏加德罗常数的值为
(设阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
3 . 近年来,科学家研究的以复合过渡金属镍的氢氧化物为催化剂、三乙醇胺为电子给体以及[Ru(bpy)3]Cl2·6H2O为光敏剂的催化体系,在可见光驱动下可高效催化还原CO2。
(1)下列有关Ni原子的叙述正确的是___________ (填标号)。
A.第一电离能比钙的大
B.基态Ni原子的核外价电子排布式为3d84s2
C.基态Ni原子形成基态Ni2+时,先失去3d轨道上的电子
(2)三乙醇胺的制备:3 +NH3
+NH3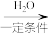 N(CH2CH2OH)3。
N(CH2CH2OH)3。
①三乙醇胺所含的元素中,电负性由小到大的顺序为___________ 。
②NH3的空间结构为___________ 。
③键角:NH3___________ (填“>”、“<”或“=”)H2O。
(3)CO2能转化为高价值化学品,如CH4、CH3OH、HCHO。上述3种物质中,沸点最高的是CH3OH,原因是____________ 。
(4)[Ru(bpy)3]Cl2·6H2O的结构如图1所示。N原子的杂化类型为____________ ,1mol配体bpy分子中含有σ键的数目为___________ NA。

(5)β-Nix(OH)y的晶胞结构如图2(氧、氢原子均位于晶胞内部)所示,已知晶胞的底边长为anm,高为cnm,阿伏加德罗常数的值为NA,则该晶胞的密度为____________ g·cm-3(列出表达式)。

(1)下列有关Ni原子的叙述正确的是
A.第一电离能比钙的大
B.基态Ni原子的核外价电子排布式为3d84s2
C.基态Ni原子形成基态Ni2+时,先失去3d轨道上的电子
(2)三乙醇胺的制备:3
 +NH3
+NH3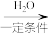 N(CH2CH2OH)3。
N(CH2CH2OH)3。①三乙醇胺所含的元素中,电负性由小到大的顺序为
②NH3的空间结构为
③键角:NH3
(3)CO2能转化为高价值化学品,如CH4、CH3OH、HCHO。上述3种物质中,沸点最高的是CH3OH,原因是
(4)[Ru(bpy)3]Cl2·6H2O的结构如图1所示。N原子的杂化类型为

(5)β-Nix(OH)y的晶胞结构如图2(氧、氢原子均位于晶胞内部)所示,已知晶胞的底边长为anm,高为cnm,阿伏加德罗常数的值为NA,则该晶胞的密度为

您最近一年使用:0次
2021-08-30更新
|
129次组卷
|
2卷引用:广东省大联考2022届高三上学期开学考试化学试题
4 . 氨酸络合剂指含有—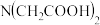 基团的有机化合物,它是一类具有广泛络合性能和强的络合能力的络合剂。
基团的有机化合物,它是一类具有广泛络合性能和强的络合能力的络合剂。
Ⅰ、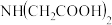 Ⅱ、
Ⅱ、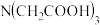 Ⅲ、
Ⅲ、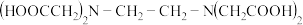
(1)基态氮原子价电子排布式为___________ 。
(2) 、
、 、
、 的沸点由高到低顺序为
的沸点由高到低顺序为___________ 。
(3)Ⅰ、Ⅱ、Ⅲ都可以与 形成络合物
形成络合物
①铜元素位于元素周期表第四周期第___________ 族。
②预测___________ (填编号“Ⅰ”、“Ⅱ”、“Ⅲ”)与 形成的络合物最稳定。
形成的络合物最稳定。
(4)下列说法正确的有___________ 。
A.在Ⅰ、Ⅱ、Ⅲ中N原子采取的都是 杂化
杂化
B.在Ⅱ中C元素的电负性最大
C.在Ⅲ中 键角是
键角是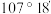
D.在Ⅲ中N元素的第一电离能最大。
E.在Ⅲ中碳氧键的键能均相等
(5)某杂志报道了一种磷化硼纳米颗粒作为高选择性 电化学还原为甲醇的非金属电催化剂。磷化硼熔点特别高,处于极高温的空气环境时也具有抗氧化作用。其晶胞结构如图所示:
电化学还原为甲醇的非金属电催化剂。磷化硼熔点特别高,处于极高温的空气环境时也具有抗氧化作用。其晶胞结构如图所示:
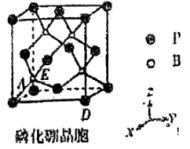
①磷化硼晶体中与硼原子距离最近且相等的硼原子数为___________ 。
②若图中A处磷原子坐标为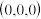 ,D处磷原子坐标为
,D处磷原子坐标为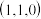 ,则E处的硼原子坐标为
,则E处的硼原子坐标为___________ 。
③已知磷化硼晶胞中A处磷原子与D处磷原子间的距离为a ,则硼原子与最近磷原子的核间距为
,则硼原子与最近磷原子的核间距为___________  。
。
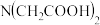 基团的有机化合物,它是一类具有广泛络合性能和强的络合能力的络合剂。
基团的有机化合物,它是一类具有广泛络合性能和强的络合能力的络合剂。Ⅰ、
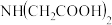 Ⅱ、
Ⅱ、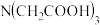 Ⅲ、
Ⅲ、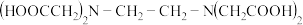
(1)基态氮原子价电子排布式为
(2)
 、
、 、
、 的沸点由高到低顺序为
的沸点由高到低顺序为(3)Ⅰ、Ⅱ、Ⅲ都可以与
 形成络合物
形成络合物①铜元素位于元素周期表第四周期第
②预测
 形成的络合物最稳定。
形成的络合物最稳定。(4)下列说法正确的有
A.在Ⅰ、Ⅱ、Ⅲ中N原子采取的都是
 杂化
杂化B.在Ⅱ中C元素的电负性最大
C.在Ⅲ中
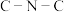 键角是
键角是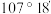
D.在Ⅲ中N元素的第一电离能最大。
E.在Ⅲ中碳氧键的键能均相等
(5)某杂志报道了一种磷化硼纳米颗粒作为高选择性
 电化学还原为甲醇的非金属电催化剂。磷化硼熔点特别高,处于极高温的空气环境时也具有抗氧化作用。其晶胞结构如图所示:
电化学还原为甲醇的非金属电催化剂。磷化硼熔点特别高,处于极高温的空气环境时也具有抗氧化作用。其晶胞结构如图所示:
①磷化硼晶体中与硼原子距离最近且相等的硼原子数为
②若图中A处磷原子坐标为
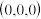 ,D处磷原子坐标为
,D处磷原子坐标为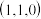 ,则E处的硼原子坐标为
,则E处的硼原子坐标为③已知磷化硼晶胞中A处磷原子与D处磷原子间的距离为a
 ,则硼原子与最近磷原子的核间距为
,则硼原子与最近磷原子的核间距为 。
。
您最近一年使用:0次
2021-08-17更新
|
190次组卷
|
2卷引用:广东省广州市四校2022届高三8月联考化学试题
5 . 晶体硅是制备太阳能电池板的主要原料,电池板中还含有硼、钛、钙等元素。回答下列问题:
(1)基态Ti原子的价层电子排布式为___ 。根据____ 规则可知硅、硼元素一些化学性质相似。
(2)NaBH4所含元素中第一电离能最小的是_______ (填元素符号)。 与NH3的VSEPR模型相似,
与NH3的VSEPR模型相似, 的键角大于NH3的键角的原因是
的键角大于NH3的键角的原因是___ ,任意写出一种 的等电子体
的等电子体___ (写粒子符号)。
(3)硅酸根有多种结构形式,一种无限长链状结构如图1所示,其化学式为_______ 。

(4)硼砂的构成为Na2[B4O5(OH)4]·8H2O,其阴离子[B4O5(OH)4]2-的结构如图2所示。B的杂化方式为___ 。硼砂中不存在___ (填标号)。
A.氢键 B.金属键 C.配位键 D.离子键
(5)钙钛矿晶体的结构如图3所示。假设把氧离子看作硬球接触模型,钛离子位于氧离子形成的正八面体中心,钙离子位于立方晶胞的体心。一个钙离子被___ 个氧离子包围。若钛离子与钙离子间最短距离为apm,则氧离子半径为___ pm。

(1)基态Ti原子的价层电子排布式为
(2)NaBH4所含元素中第一电离能最小的是
 与NH3的VSEPR模型相似,
与NH3的VSEPR模型相似, 的键角大于NH3的键角的原因是
的键角大于NH3的键角的原因是 的等电子体
的等电子体(3)硅酸根有多种结构形式,一种无限长链状结构如图1所示,其化学式为

(4)硼砂的构成为Na2[B4O5(OH)4]·8H2O,其阴离子[B4O5(OH)4]2-的结构如图2所示。B的杂化方式为
A.氢键 B.金属键 C.配位键 D.离子键
(5)钙钛矿晶体的结构如图3所示。假设把氧离子看作硬球接触模型,钛离子位于氧离子形成的正八面体中心,钙离子位于立方晶胞的体心。一个钙离子被

您最近一年使用:0次
名校
解题方法
6 . 硫、钒化合物在药物化学及催化化学等领域应用广泛。回答下列问题:
(1)基态钒原子的价层电子排布图为_______ ,钒有+2、+3、+4、+5等多种化合价,其中最稳定的化合价是_______ ,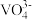 的空间构型为
的空间构型为_______ 。
(2)2-巯基烟酸氧钒配合物(图甲)是副作用小的有效调节血糖的新型药物:
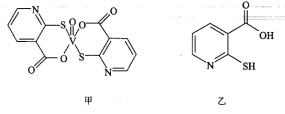
该药物中N原子的杂化方式是_______ ;2-巯基烟酸(图乙)水溶性优于2-巯基烟酸氧钒配合物(图甲)的原因是_______ 。
(3)某六方硫钒化合物晶体的晶胞如图丙所示,该晶胞的化学式为_______ 。图丁为该晶胞的俯视图,该晶胞的密度为_______  (列出计算式即可)。
(列出计算式即可)。

(1)基态钒原子的价层电子排布图为
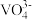 的空间构型为
的空间构型为(2)2-巯基烟酸氧钒配合物(图甲)是副作用小的有效调节血糖的新型药物:

该药物中N原子的杂化方式是
(3)某六方硫钒化合物晶体的晶胞如图丙所示,该晶胞的化学式为
 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
2021-03-22更新
|
329次组卷
|
3卷引用:广东省省名校联盟2021届高三下学期开学考试(新高考)化学试题



