名校
1 . 氮化铝(AlN)是一种新型无机非金属原料,结构与金刚石相似。常温下AlN+NaOH+H2O=NaAlO2+NH3↑。某课题小组利用下图所示装置测定样品AlN的含量(杂质不反应)。下列说法中正确的是
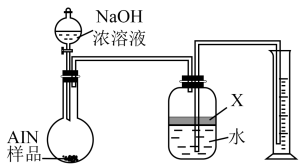

| A.氮化铝是共价晶体,晶体中N、Al原子配位数均为4 |
| B.X可以是CCl4,因为NH3不溶于CCl4而易溶于水 |
| C.若广口瓶中液体未装满,测得NH3的体积将偏大 |
D.若实验中测得样品的质量为w g,氨气的体积为a L(标况下),则样品中AlN的质量分数为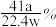 |
您最近半年使用:0次
名校
2 . 已知 是阿伏加德罗常数的值,下列说法正确的是
是阿伏加德罗常数的值,下列说法正确的是
 是阿伏加德罗常数的值,下列说法正确的是
是阿伏加德罗常数的值,下列说法正确的是A.1 mol SiC晶体中含 共价键 共价键 |
B.1 mol  和Fe(足量)充分反应后转移电子总数为 和Fe(足量)充分反应后转移电子总数为 |
C.100 g质量分数为17%的 溶液中极性键数目为 溶液中极性键数目为 |
D.3.36 L  中含有σ键 中含有σ键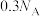 |
您最近半年使用:0次
3 . 2022年12月,首架国产大飞机C919正式交付,国之重器,世界瞩目。铼(Re)是生产飞机发动机叶片必不可少的材料。X、Y、Z、Q、W是原子序数依次增大且位于不同主族的短周期元素,其中X、Y、Z三种元素可与铼元素组成一种化合物(结构如图),该化合物与X的单质反应可得到铼。Q是地壳中含量最丰富的金属元素,Z与W形成的化合物为共价晶体。下列说法正确的是
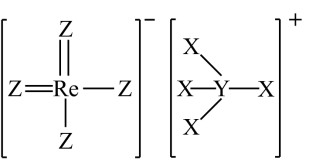
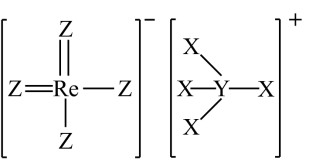
| A.电负性:Z>Y>Q>W |
| B.图中的阳离子存在配位键,但四个键的性质不同 |
| C.熔点:W晶体小于W、Y形成的晶体 |
| D.Q的氧化物可以和氨水反应 |
您最近半年使用:0次
4 . 下列关于 和金刚石的叙述正确的是
和金刚石的叙述正确的是
 和金刚石的叙述正确的是
和金刚石的叙述正确的是A. 是共价晶体,它是自然界含量最高的固态二元化合物 是共价晶体,它是自然界含量最高的固态二元化合物 |
B.通常状况下,1mol 晶体中含有 晶体中含有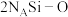 键( 键( 表示阿伏加德罗常数值) 表示阿伏加德罗常数值) |
| C.金刚石的网状结构中,由共价键形成的最小环上有6个碳原子,1个碳原子被6个六元环所共用 |
D.1mol金刚石中含有 个C-C键( 个C-C键( 表示阿伏加德罗常数的值) 表示阿伏加德罗常数的值) |
您最近半年使用:0次
2023-03-30更新
|
238次组卷
|
3卷引用:山西省太原师范附属中学、太原市师苑中学校2022-2023学年高二下学期第一次月考化学(理)试题
2023高三·全国·专题练习
解题方法
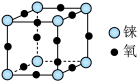
5 . “天问一号”着陆火星,“嫦娥五号”采回月壤,探索宇宙离不开化学。镍铼合金是制造喷气发动机的燃烧室、涡轮叶片及排气喷嘴的重要材料。75号元素铼Re,熔点仅次于钨,是稀有金属之一,地壳中铼的含量极低,多伴生于铜、锌、铅等矿物中。
(1)镍原子价电子表示式为___________ ,在元素周期表中,铼与锰在同族,铼在元素周期表中的位置是___________ 。
(2)铼易形成高配位数的化合物如Re2(CO)10,该配合物中___________ (填元素符号)提供孤对电子与铼成键,原因是___________ ,1mol Re2(CO)10中有___________ mol配位键。
(3)锌在潮湿的空气中极易生成一层紧密的碱式碳酸锌[ZnCO3·3Zn(OH)2]薄膜,使其具有抗腐蚀性。碱式碳酸锌中非金属元素的电负性由大到小的顺序为___________ ,CO 的空间构型为
的空间构型为___________ (用文字描述)。与CO 互为等电子体的分子是
互为等电子体的分子是___________ (写一种即可)。
(4)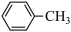 分子中碳原子的杂化类型为
分子中碳原子的杂化类型为___________ ,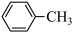 比
比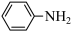 的熔点沸点
的熔点沸点___________ (填“高”或“低”),原因是___________ 。
(5)三氧化铼晶胞如图所示,摩尔质量为Mg/mol,晶胞密度为bg/cm3,铼原子填在___________ 个氧原子围成的___________ (填“四面体”“立方体”或“八面体”)空隙中,该晶胞的空间利用率为___________ (铼的原子半径为rRepm,氧原子半径为rOpm,列出计算式)。
(1)镍原子价电子表示式为
(2)铼易形成高配位数的化合物如Re2(CO)10,该配合物中
(3)锌在潮湿的空气中极易生成一层紧密的碱式碳酸锌[ZnCO3·3Zn(OH)2]薄膜,使其具有抗腐蚀性。碱式碳酸锌中非金属元素的电负性由大到小的顺序为
 的空间构型为
的空间构型为 互为等电子体的分子是
互为等电子体的分子是(4)
 分子中碳原子的杂化类型为
分子中碳原子的杂化类型为 比
比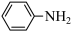 的熔点沸点
的熔点沸点(5)三氧化铼晶胞如图所示,摩尔质量为Mg/mol,晶胞密度为bg/cm3,铼原子填在

您最近半年使用:0次
解题方法
6 . 设 为阿伏加德罗常数的值,下列说法错误的是
为阿伏加德罗常数的值,下列说法错误的是
 为阿伏加德罗常数的值,下列说法错误的是
为阿伏加德罗常数的值,下列说法错误的是A.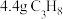 中含 中含 键的数目为 键的数目为 |
B.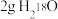 和 和 的混合物中含中子的数目为 的混合物中含中子的数目为 |
C.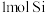 中含有 中含有 键的数目为 键的数目为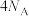 |
D.100g质量分数为46%的乙醇水溶液中,氧原子的数目为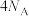 |
您最近半年使用:0次
名校
解题方法
7 . 现有A、B、C、D、E、F六种短周期元素,其相关性质信息如下。请回答下列问题:
(1)元素B在周期表中的位置为_______ ;D与F原子按个数比为1:1形成物质的结构式为_______
(2)A、C、D对应的简单离子的半径由大到小的排序是_______ (用离子符号表示)。
(3)B元素和A元素能够形成一种超硬物质,沸点为2249℃。该化合物的晶体类型为_______ ;若将C元素最高价氧化物的水化物溶于水,需要破坏的作用力为_______ 。
(4)在含有A的氯化物溶液中滴加过量氨水的离子方程式为_______ 。
(5)用电子式表示化合物FE的形成过程_______ 。
(6)已知CED2是一种强氧化性漂白剂。请写出在碱性条件下,CED2和BD2反应的离子方程式_______ 。
| 元素 | 特征 | 元素 | 特征 |
| A | 常见金属,其最高价氧化物对应的水化物可以溶于强碱 | D | 在地壳中含量最多 |
| B | 常见化肥的主要元素,单质常温下呈气态 | E | 单质为黄绿色有毒气体 |
| C | 在短周期主族元素中,原子半径最大 | F | 原子的核外电子只有1个 |
(2)A、C、D对应的简单离子的半径由大到小的排序是
(3)B元素和A元素能够形成一种超硬物质,沸点为2249℃。该化合物的晶体类型为
(4)在含有A的氯化物溶液中滴加过量氨水的离子方程式为
(5)用电子式表示化合物FE的形成过程
(6)已知CED2是一种强氧化性漂白剂。请写出在碱性条件下,CED2和BD2反应的离子方程式
您最近半年使用:0次
解题方法
8 . A、B、C、D、E、F六种元素均位于元素周期表的前四周期,且原子序数依次增大。元素A是原子半径最小的元素;B元素基态原子的核外电子占据四个原子轨道;D元素原子的成对电子总数是未成对电子总数的3倍;E与D位于同一主族;F位于第Ⅷ族,在地壳中含量排金属中第二位。
(1)F2+的价电子排布图为_______ 。
(2)B、C、D元素的第一电离能由大到小的顺序是_______ (用元素符号表示)。
(3)B、C、D的某些氢化物的分子中都含有18个电子,B的这种氢化物的中心原子杂化方式为_______ ,等物质的量B、C、D的这种氢化物的分子中含有σ键的个数之比为_______ 。
(4)D常见的两种单质D2和D3,其中_______ (填化学式)在水中的溶解度更大。
(5)B、E可形成分子式为BE2的化合物,其电子式为_______ 。
(6)实验室合成一种由B和C两种元素形成的化合物,该化合物具有三维骨架结构,其中每个B原子与4个C原子形成共价键,每个C原子与3个B原子形成共价键。其化学式为_______ , 预测该化合物熔点_______ 金刚石(填“高于”或“低于”)。
(1)F2+的价电子排布图为
(2)B、C、D元素的第一电离能由大到小的顺序是
(3)B、C、D的某些氢化物的分子中都含有18个电子,B的这种氢化物的中心原子杂化方式为
(4)D常见的两种单质D2和D3,其中
(5)B、E可形成分子式为BE2的化合物,其电子式为
(6)实验室合成一种由B和C两种元素形成的化合物,该化合物具有三维骨架结构,其中每个B原子与4个C原子形成共价键,每个C原子与3个B原子形成共价键。其化学式为
您最近半年使用:0次
解题方法
9 . X、Y、Z为三种元素,X能与氢形成气态XH4,其中X的质量分数为75%;且X与Y能形成XY2型化合物。Y的原子核内质子数和中子数相等,在Y的氢化物中,Y的质量分数为88.9%。Z的最高价氧化物的水化物是酸性最强的酸。
(1)X的单质叫做______ ,它属于______ 晶体。
(2)Y的氢化物属于______ 晶体,它的电子式是______ 。
(3)Z元素位于周期表的第______ 周期______ 族,它的氢化物是______ 性分子。
(4)X与Z形成的化合物可用电子式表示为______ ,其分子的空间构型是______ 体,属于______ 性分子,它的晶体属于______ 晶体。
(1)X的单质叫做
(2)Y的氢化物属于
(3)Z元素位于周期表的第
(4)X与Z形成的化合物可用电子式表示为
您最近半年使用:0次
名校
解题方法
10 . 已知A、B、C、D、E、F六种元素的原子序数依次增大,其中A元素的原子半径在短周期元素中最小,B原子核外电子有6种不同的运动状态;D原子L层上有2对成对电子。E元素在地壳中含量居第二位,F与E位于同一周期,且是该周期元素中电负性最大的元素。根据以上信息回答下列问题:
(1)E元素可分别与D元素、F元素形成两种常见化合物,这两种化合物的熔沸点高低顺序为__ (用化学式表示),原因是___ 。
(2)C的氢化物比下周期同族元素的氢化物沸点还要高,其原因是__ 。
(3)1molB2A2分子中含σ键的数目是__ 。
(4)图(Ⅰ)是B元素的单质晶体的一个晶胞,该晶胞中含有__ 个原子,若设晶胞的棱长为acm,阿伏加德罗常数的值为NA则该晶体的密度表达式为__ 。
(5)E单质存在与金刚石结构类似的晶体,晶体中原子之间以__ 相结合,其晶胞中共有8个原子,其中在面心位置贡献__ 个原子。
(6)BD2在高温高压下所形成的晶体其晶胞如图(Ⅱ)所示。该晶体的类型属于__ (填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子轨道的杂化类型为__ 。

(1)E元素可分别与D元素、F元素形成两种常见化合物,这两种化合物的熔沸点高低顺序为
(2)C的氢化物比下周期同族元素的氢化物沸点还要高,其原因是
(3)1molB2A2分子中含σ键的数目是
(4)图(Ⅰ)是B元素的单质晶体的一个晶胞,该晶胞中含有
(5)E单质存在与金刚石结构类似的晶体,晶体中原子之间以
(6)BD2在高温高压下所形成的晶体其晶胞如图(Ⅱ)所示。该晶体的类型属于

您最近半年使用:0次



