名校
解题方法
1 . 现有A、B、C、D、E、F六种短周期元素,其相关性质信息如下。请回答下列问题:
(1)元素B在周期表中的位置为_______ ;D与F原子按个数比为1:1形成物质的结构式为_______
(2)A、C、D对应的简单离子的半径由大到小的排序是_______ (用离子符号表示)。
(3)B元素和A元素能够形成一种超硬物质,沸点为2249℃。该化合物的晶体类型为_______ ;若将C元素最高价氧化物的水化物溶于水,需要破坏的作用力为_______ 。
(4)在含有A的氯化物溶液中滴加过量氨水的离子方程式为_______ 。
(5)用电子式表示化合物FE的形成过程_______ 。
(6)已知CED2是一种强氧化性漂白剂。请写出在碱性条件下,CED2和BD2反应的离子方程式_______ 。
| 元素 | 特征 | 元素 | 特征 |
| A | 常见金属,其最高价氧化物对应的水化物可以溶于强碱 | D | 在地壳中含量最多 |
| B | 常见化肥的主要元素,单质常温下呈气态 | E | 单质为黄绿色有毒气体 |
| C | 在短周期主族元素中,原子半径最大 | F | 原子的核外电子只有1个 |
(2)A、C、D对应的简单离子的半径由大到小的排序是
(3)B元素和A元素能够形成一种超硬物质,沸点为2249℃。该化合物的晶体类型为
(4)在含有A的氯化物溶液中滴加过量氨水的离子方程式为
(5)用电子式表示化合物FE的形成过程
(6)已知CED2是一种强氧化性漂白剂。请写出在碱性条件下,CED2和BD2反应的离子方程式
您最近半年使用:0次
2 . A、B、C、X、Y、Z是元素周期表中的前20号元素,且原子序数依次增大。已知它们的部分化合物的性质如下:
回答下列问题:
(1)写出对应元素的名称 :A__________ 、B__________ 、C__________ 、X__________ 、Y__________ 、Z__________
(2)X、Y、Z三种元素原子半径由大到小的顺序是(用元素符号和“>”表示):__________
(3)写出B的氢化物与C的氢化物反应后生成物的电子式:__________ 。
(4)已知C的单质能在水中产生一种常见的氧化性单质,试写出该反应的化学方程式:
__________ 。
(5)试比较A和Y的最高价氧化物熔点的高低(用具体物质化学式和">"、"<"或"="表示:)__________ 并说明理由__________ 。
A的 氢化物 | B的 氢化物 | C的 氢化物 | X的 氧化物 | Y的氢化物 分子构型 | Z原子 |
含氢量最高 的有机物 | 水溶液 呈碱性 | 水溶液 呈酸性 | 两性 氧化物 | 正四面体 | 价电子排布为4s2 |
(1)写出对应元素的
(2)X、Y、Z三种元素原子半径由大到小的顺序是(用元素符号和“>”表示):
(3)写出B的氢化物与C的氢化物反应后生成物的电子式:
(4)已知C的单质能在水中产生一种常见的氧化性单质,试写出该反应的化学方程式:
(5)试比较A和Y的最高价氧化物熔点的高低(用具体物质化学式和">"、"<"或"="表示:)
您最近半年使用:0次
3 . 长征五号B运载火箭中使用了耐热性佳,导热性好的氮化铝陶瓷。已知:Al4C3+4NH3=4AlN+3CH4。回答下列问题:
(1)碳原子核外电子中未成对电子数是_____ ,氨气的电子式是_____ 。
(2)AlN是由共价键直接形成的晶体,硬度大、熔点高,它是_____ 晶体。上述反应中形成相同电子层结构离子的元素,其简单离子半径由大到小的顺序是_____ 。
(3)比较非金属性N>C正确的是_____
a.HNO3酸性大于H2CO3
b.N最高价为+5,C最高价为+4
c.HNO3氧化性大于H2CO3
d.H3C﹣NH2中C﹣N共用电子对偏向N
(4)AlN遇水会发生水解,反应的化学方程式为:_____ ,AlN在80℃和90℃水中完全水解,测得水解后溶液的pH(80℃)>pH(90℃),试从平衡移动角度解释其原因:_____ 。 (不考虑水的离子积变化和Al(OH)3电离)。
(5)向Al(OH)3悬浊液中加入NaOH溶液至沉淀恰好完全溶解,写出反应的离子方程式:_____ 。溶液中c(Na+)_____ c(AlO ) (填“>”或“<”),欲使c(Na+):c(AlO
) (填“>”或“<”),欲使c(Na+):c(AlO )=1:1,可加入
)=1:1,可加入_____ 。
(1)碳原子核外电子中未成对电子数是
(2)AlN是由共价键直接形成的晶体,硬度大、熔点高,它是
(3)比较非金属性N>C正确的是
a.HNO3酸性大于H2CO3
b.N最高价为+5,C最高价为+4
c.HNO3氧化性大于H2CO3
d.H3C﹣NH2中C﹣N共用电子对偏向N
(4)AlN遇水会发生水解,反应的化学方程式为:
(5)向Al(OH)3悬浊液中加入NaOH溶液至沉淀恰好完全溶解,写出反应的离子方程式:
 ) (填“>”或“<”),欲使c(Na+):c(AlO
) (填“>”或“<”),欲使c(Na+):c(AlO )=1:1,可加入
)=1:1,可加入
您最近半年使用:0次
2011·浙江杭州·一模
4 . 2010年诺贝尔物理学奖被两位英国科学家盖姆和诺沃肖格夫摘得,他们用普通胶带成功地从铅笔芯地石墨中分离出了石墨烯(分子式设为Cx),突破性地创造了撕裂法:他们将石墨分离成小的碎片,从碎片中剥离出较薄的石墨薄片,然后用胶带粘住薄片的两侧,撕开胶带,薄片也随之一分为二,不断重复这一过程,最终得到了截面约100微米的、只有单层碳原子的石墨烯。这种“只有一层碳原子厚的碳薄片”,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料。这种比最好的钢铁还要硬100倍、比钻石坚硬的石墨烯其实就是石墨的二维结构。其超强硬度、韧性和出色的导电性使得制造超级防弹衣、超轻型火箭、超级计算机不再是科学狂想。
⑴下列说法不正确的是_____ 。
A.石墨烯被公认为目前世界上已知的最薄、最坚硬的新型材料,所以属于原子晶体
B. 石墨烯与金刚石互为同素异形体
C. 若该撕裂法可看做是将石墨结构内层与层间分离开,则此过程中必有共价键被破坏
D. 石墨烯晶体内最小环上有6个原子
E. 石墨烯可看做是芳香烃类的物质
F. 石墨烯晶体在一定条件下可发生加成反应
⑵石墨烯可能具有较强的_____ (填“氧化性”或“还原性”),因此在足量空气中煅烧可能发生的反应方程式为_____________________ 。
⑶石墨烯之所以能导电,可认为主要是因为其每个碳原子成键后还有一个单电子,这些单电子均可与最近的3个碳原子中任意一个碳原子形成共价键,也就是说具有该结构的物质一般具有导电性,据此类推下列物质不具有导电性的是_____ 。
A. 石墨 B. 聚乙炔 C. 聚1,3-丁二烯 D. 聚苯乙炔
⑷ 18g石墨烯晶体内含有的碳原子数为_____ ,所含的碳碳单键数为_____ 。
⑴下列说法不正确的是
A.石墨烯被公认为目前世界上已知的最薄、最坚硬的新型材料,所以属于原子晶体
B. 石墨烯与金刚石互为同素异形体
C. 若该撕裂法可看做是将石墨结构内层与层间分离开,则此过程中必有共价键被破坏
D. 石墨烯晶体内最小环上有6个原子
E. 石墨烯可看做是芳香烃类的物质
F. 石墨烯晶体在一定条件下可发生加成反应
⑵石墨烯可能具有较强的
⑶石墨烯之所以能导电,可认为主要是因为其每个碳原子成键后还有一个单电子,这些单电子均可与最近的3个碳原子中任意一个碳原子形成共价键,也就是说具有该结构的物质一般具有导电性,据此类推下列物质不具有导电性的是
A. 石墨 B. 聚乙炔 C. 聚1,3-丁二烯 D. 聚苯乙炔
⑷ 18g石墨烯晶体内含有的碳原子数为
您最近半年使用:0次
名校
解题方法
5 . 下表为元素周期表的一部分,其中 、
、 、
、 、
、 为短周期元素,
为短周期元素, 元素的核电荷数为
元素的核电荷数为 元素的2倍。下列说法正确的是
元素的2倍。下列说法正确的是
 、
、 、
、 、
、 为短周期元素,
为短周期元素, 元素的核电荷数为
元素的核电荷数为 元素的2倍。下列说法正确的是
元素的2倍。下列说法正确的是 | ||
 |  |  |
 |
A. 、 、 、 、 元素的原子半径及它们的气态氢化物的热稳定性均依次递增 元素的原子半径及它们的气态氢化物的热稳定性均依次递增 |
B. 、 、 、 、 元素在自然界均能以游离态存在 元素在自然界均能以游离态存在 |
C. 晶体熔化、液态 晶体熔化、液态 气化均需克服分子间作用力 气化均需克服分子间作用力 |
D.根据元素周期律,推测 元素的单质可能具有半导体特性, 元素的单质可能具有半导体特性, 具有氧化性和还原性 具有氧化性和还原性 |
您最近半年使用:0次
6 . 结构决定性质。下列有关物质的结构与性质不对应的是
| 选项 | 物质的结构 | 性质 |
| A | 金刚石为空间网状结构 | 金刚石的硬度大 |
| B | 石墨为层状结构 | 石墨的质地比较柔软 |
| C | CaO由Ca和O组成 | CaO具有强氧化性 |
| D | 金属晶体中含有自由电子和金属阳离子 | 金属晶体能够导电 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2023-11-27更新
|
231次组卷
|
4卷引用:河北省邢台市五岳联盟2023-2024学年高三上学期11月月考化学试题
2012·上海·零模
解题方法
7 . 氮化硅(Si3N4)是一种新型陶瓷材料,它可用石英与焦炭在高温的氮气流中反应制得: ___ SiO2+ ___ C+___ N2
___ Si3N4+___ CO,根据题意完成下列各题:
(1)配平上述化学反应方程式。
(2)为了保证石英和焦炭尽可能的转化,氮气要适当过量。某次反应用了20mol氮气,反应生成了5mol一氧化碳,则反应中转移电子为_____ NA,此时混合气体的平均相对分子质量是_____ 。
(3)分析反应可推测碳、氮气的氧化性____ >_____ (填化学式)。
(4)氮化硅陶瓷的机械强度高,硬度接近于刚玉(Al2O3),热稳定性好,化学性质稳定。以下用途正确的是____ 。
A 可以在冶金工业上制成坩埚、铝电解槽衬里等热工设备上
B 在电子工业上制成耐高温的电的良导体
C 研发氮化硅的全陶发动机替代同类型金属发动机
D 氮化硅陶瓷的开发,将受到资源的限制,发展前途暗淡

(1)配平上述化学反应方程式。
(2)为了保证石英和焦炭尽可能的转化,氮气要适当过量。某次反应用了20mol氮气,反应生成了5mol一氧化碳,则反应中转移电子为
(3)分析反应可推测碳、氮气的氧化性
(4)氮化硅陶瓷的机械强度高,硬度接近于刚玉(Al2O3),热稳定性好,化学性质稳定。以下用途正确的是
A 可以在冶金工业上制成坩埚、铝电解槽衬里等热工设备上
B 在电子工业上制成耐高温的电的良导体
C 研发氮化硅的全陶发动机替代同类型金属发动机
D 氮化硅陶瓷的开发,将受到资源的限制,发展前途暗淡
您最近半年使用:0次
解题方法
8 . 下列关于二氧化硅的叙述中正确的是( )
| A.硅原子和碳原子最外层电子数相同,二氧化硅和二氧化碳分子结构也相同 |
| B.二氧化硅能与氢氧化钠溶液和氢氟酸反应,所以二氧化硅是两性氧化物 |
| C.二氧化硅中硅元素为+4价,二氧化硅具有氧化性 |
| D.在二氧化硅中,每个硅原子结合2个氧原子 |
您最近半年使用:0次
2020-02-05更新
|
461次组卷
|
5卷引用:云南省普洱市普洱第二中学2019—2020学年高一上学期期末考试化学试题
云南省普洱市普洱第二中学2019—2020学年高一上学期期末考试化学试题广西壮族自治区河池市环江县第三中学2019-2020学年高一上学期期末考试化学试题(已下线)专题03 无机非金属材料(核心素养卷)-【新教材精创】2019-2020学年高一化学新教材知识讲学(必修第二册)(人教版2019)选择性必修2 第三章 晶体结构与性质 第二节 分子晶体与共价晶体 第2课时 共价晶体鲁科版2019选择性必修2第3章 不同聚集状态的物质与性质 第2节 几种简单的晶体结构模型 第3课时 共价晶体
名校
9 . 短周期元素X、Y、Z、W的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数,且X、Y、W原子最外层电子数之和恰好等于Z元素的核电荷数,X与W的最高化合价之和为8.常见元素Z的单质是目前使用量最大的主族金属元素单质,下列说法中不正确的是
| A.因为Z的氧化物熔点很高。不适宜于电解,故工业上常用电解Z与W的化合物的方法制取单质Z |
| B.化合物YW3遇水能强烈水解,产物之一具有强氧化性 |
| C.离子化合物YX5假如存在。该物质与水反应必然生成气体X2,同时得到一种弱碱溶液 |
| D.Y、Z形成的一种化合物强度高,热膨胀系数小,是良好的耐热冲击材料,该化合物属于原子晶体 |
您最近半年使用:0次
2020-08-15更新
|
60次组卷
|
5卷引用:【全国百强校】华中师范大学第一附属中学2018届高三5月押题考试理综化学试题
解题方法
10 . N、P、As及其化合物在工农业生产中用途非常广泛。回答下列问题:
(1)写出基态N原子的核外电子排布式___________ , 与N同周期的主族元素中,第一电离能比N大的元素是___________ (填元素符号) 。
(2)NH3是制造HNO3、化肥、炸药的重要原料,还可用于制冷。NH3的立体构型为___________ , 在工业合成NH3 (N2 + 3H2 2NH3)的反应所涉及的3种物质中,沸点从高到低的顺序为
2NH3)的反应所涉及的3种物质中,沸点从高到低的顺序为___________ , 原因是___________ 。
(3)H3PO2是一种重要的化工原料。已知:无机含氧酸分子中非羟基氧越多,酸性越强。1个非羟基氧是中强酸,2个非羟基氧是强酸。如H3PO4为中强酸,其结构简式为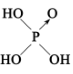 ;H3PO2也是一种中强酸,则H3PO2的结构简式为
;H3PO2也是一种中强酸,则H3PO2的结构简式为___________ ,写出H3PO2与足量NaOH溶液反应的化学方程式____________ 。
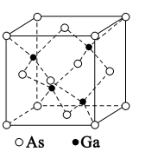
(4)GaAs 的熔点为1 238 °C,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为___________ 。已知:阿伏加德罗常数的值为NA,GaAs的摩尔质量为145g·mol-1,则GaAs的晶胞边长为___________ pm。
(1)写出基态N原子的核外电子排布式
(2)NH3是制造HNO3、化肥、炸药的重要原料,还可用于制冷。NH3的立体构型为
 2NH3)的反应所涉及的3种物质中,沸点从高到低的顺序为
2NH3)的反应所涉及的3种物质中,沸点从高到低的顺序为(3)H3PO2是一种重要的化工原料。已知:无机含氧酸分子中非羟基氧越多,酸性越强。1个非羟基氧是中强酸,2个非羟基氧是强酸。如H3PO4为中强酸,其结构简式为
 ;H3PO2也是一种中强酸,则H3PO2的结构简式为
;H3PO2也是一种中强酸,则H3PO2的结构简式为(4)GaAs 的熔点为1 238 °C,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为

您最近半年使用:0次



