1 . A、B、D、E四种元素均为短周期元素,原子序数逐渐增大。A元素原子的核外电子数、电子层数和最外层电子数均相等。B、D、E三种元素在周期表中的相对位置如表①所示,只有E元素的单质能与水反应生成两种酸,甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素:W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子。它们之间的转化关系如图②所示。
表①
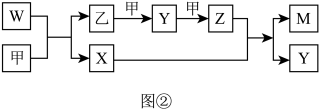
请回答下列问题:
(1)Z的化学式为___________ ;X分子的空间构型为___________ 。
(2)E的单质与水反应的离子方程式为___________ 。 D、E元素可分别与硅(Si)、钛(Ti)元素形成化合物,其中SiD2的熔点为1723℃,沸点2230℃,TiE4的熔点为-24.1℃,沸点为136.4℃,两者熔沸点差别很大的原因是___________ 。
(3)W-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。W-空气燃料电池放电时负极反应式为___________ 。
(4)将一定量的A2、B2的混合气体放入1L恒容密闭容器中,在200℃下达到平衡。测得平衡气体的总物质的量为0.4mol,其中A2为0.1mol,B2为0.1mol。则该条件下A2的平衡转化率为___________ ,该温度下的平衡常数为___________ 。
表①
| B | D | |
| E |

请回答下列问题:
(1)Z的化学式为
(2)E的单质与水反应的离子方程式为
(3)W-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。W-空气燃料电池放电时负极反应式为
(4)将一定量的A2、B2的混合气体放入1L恒容密闭容器中,在200℃下达到平衡。测得平衡气体的总物质的量为0.4mol,其中A2为0.1mol,B2为0.1mol。则该条件下A2的平衡转化率为
您最近一年使用:0次
2023高三·全国·专题练习
名校
解题方法
2 . 下列物质的熔、沸点高低顺序正确的是
| A.金刚石>晶体硅>碳化硅 | B.CI4>CBr4>CCl4>CF4 |
| C.MgO>CO2>H2O | D.金刚石>生铁>钠>纯铁 |
您最近一年使用:0次
2023-02-17更新
|
839次组卷
|
7卷引用:江西省南昌市第十九中学2022-2023学年高二下学期3月第一次月考化学试卷
江西省南昌市第十九中学2022-2023学年高二下学期3月第一次月考化学试卷 (已下线)题型94 晶体微粒间作用力及晶体熔、沸点高低比较宁夏青铜峡市宁朔中学2022-2023学年高二下学期3月月考化学试题山东省滨州市惠民县2022-2023学年高二下学期4月期中质量检测化学试题山西省运城市康杰中学2022-2023学年高二下学期3月月考化学试题(已下线)热点07 分子晶体与共价晶体吉林省长春市第二实验中学2023-2024学年高二下学期4月月考化学试题
名校
3 . 我国科学家合成了富集11B的非碳导热材料立方氮化硼晶体,晶胞结构如图。下列说法不正确的是


| A.氮化硼晶体有较高的熔沸点 |
| B.该晶体具有良好的导电性 |
| C.该晶胞中含有4个B原子,4个N原子 |
| D.N原子周围等距且最近的N原子数为12 |
您最近一年使用:0次
2021-04-13更新
|
325次组卷
|
5卷引用:江西省宜春市宜丰中学2023-2024学年高三上学期10月月考化学试题
江西省宜春市宜丰中学2023-2024学年高三上学期10月月考化学试题辽宁省实验中学东戴河分校两校2020-2021学年高二4月联考化学试题吉林省延边第二中学2020-2021学年高二下学期期中考试化学试题(已下线)3.2 分子晶体与共价晶体(B级能力练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)甘肃省武威第十八中学2020-2021学年高二下学期期中考试化学试题
4 . 下列关于C、Si及其化合物结构与性质的论述错误的是
A.键能 、 、 ,因此C2H6稳定性大于Si2H6 ,因此C2H6稳定性大于Si2H6 |
| B.立方型SiC是与金刚石成键、结构均相似的共价晶体,因此具有很高的硬度 |
| C.SiH4中Si的化合价为+4,CH4中C的化合价为-4,因此SiH4还原性小于CH4 |
D.Si原子间难形成双键而C原子间可以,是因为Si的原子半径大于C,难形成 键 键 |
您最近一年使用:0次
2020-07-11更新
|
7547次组卷
|
38卷引用:江西省景德镇一中2022-2023学年高二上学期期中考试化学试题
江西省景德镇一中2022-2023学年高二上学期期中考试化学试题2020年山东省高考化学试卷(新高考)(已下线)专题17 物质结构与性质(选修)-2020年高考真题和模拟题化学分项汇编河南省长葛市第一高级中学2021届高三上学期10月阶段性测试化学试题山东省淄博市般阳中学2020-2021学年高二上学期期中考试化学试题四川省乐山十校2020-2021学年高二上学期半期联考化学试题(已下线)小题必刷22 元素周期表(律)及其应用——2021年高考化学一轮复习小题必刷(通用版)河北省石家庄市第二十四中学2021届高三上学期月考化学试卷(人教版2019)选择性必修2 第三章 晶体结构与性质 C 高考挑战区(已下线)热点4 物质结构与性质(选择题)-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)专题11 物质结构与性质——备战2021年高考化学纠错笔记(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练山东省夏津第一中学2020-2021学年高二下学期3月月考化学试题(已下线)押山东卷第04题 物质结构与性质选择题-备战2021年高考化学临考题号押题(山东卷)福建省福州第一中学2020-2021学年高二下学期期中考试化学试题(已下线)考点35 晶体结构与性质-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)专题13 物质结构与性质基础-备战2022年高考化学真题及地市好题专项集训【山东专用】(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)福建省厦门集美中学2021-2022学年高二下学期第一次月考化学试题(已下线)卷14 物质结构与性质选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)押新高考卷08题 物质结构与性质-备战2022年高考化学临考题号押题(新高考通版)(已下线)卷03 小题素养卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)2020年山东卷化学高考真题变式题1-10抚顺市第一中学2021-2022学年高二下学期开学考试化学试题河南省南阳市第六完全学校高级中学2021-2022学年高二下学期4月月考化学试题四川省安岳县兴隆中学2021-2022学年高二上学期期中测试化学试题江苏省苏州市2022-2023学年高二上学期期中调研化学试卷四川省乐山沫若中学2022-2023学年高二上学期第二次月考(期中考试)化学试题福建省厦门市湖滨中学2022-2023学年高三上学期期中考试化学试题山东省菏泽市单县二中2021-2022学年高二下学期开学考试 化学试题(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第五章 物质结构与性质 元素周期律 第31讲 晶体结构与性质北京市第八十中学2023届高三下学期二模适应考试化学试题广东广雅中学2022-2023学年高二下学期期中考试化学试题广东省湛江市第二中学2021-2022学年高二下学期第17周(6.11)周练化学试题(已下线)第3讲 化学键 共价键的类型及键参数宁夏回族自治区银川市贺兰县第一中学2023-2024学年高三第三阶段化学考试北京市第十四中学2023-2024学年高三下学期三模化学试题
10-11高二·江西上饶·阶段练习
名校
5 . 下列对一些实验事实的理论解释正确的是
| 选项 | 实验事实 | 理论解释 |
| A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
| B | CO2为直线形分子 | CO2分子中C=O之间的夹角为109°28′ |
| C | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是原子晶体 |
| D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-01-20更新
|
383次组卷
|
9卷引用:2011-2012学年江西省上饶县中学高二第一次月考化学试卷
(已下线)2011-2012学年江西省上饶县中学高二第一次月考化学试卷2017-2018学年人教版高中化学选修三 模块综合质量检测山西省忻州实验中学2018-2019学年高二下学期期中考试化学试题四川省绵阳市三台中学实验学校2019-2020学年高二上学期9月月考化学试题山东省东营市广饶县第一中学2019-2020学年高二下学期3月线上考试化学试题四川省成都市简阳市阳安中学2020-2021学年高二上学期11月月考化学试题新疆哈密市第八中学2019-2020学年高二下学期期末考试化学试题陕西省宝鸡市渭滨区2020-2021学年高二下学期期末考试化学试题辽宁省朝阳市建平县高级中学2021-2022学年高二4月月考化学试题
名校
6 . 下面的排序不正确的是( )
| A.晶体熔点由低到高:F2<Cl2<Br2<I2 |
| B.熔点由高到低: Na>Mg>Al |
| C.硬度由大到小: 金刚石>碳化硅>晶体硅 |
| D.晶格能由大到小: MgO>CaO>NaF> NaCl |
您最近一年使用:0次
2017-12-12更新
|
484次组卷
|
12卷引用:江西省九江市柴桑区第一中学2020-2021学年高二下学期5月月考化学试题
江西省九江市柴桑区第一中学2020-2021学年高二下学期5月月考化学试题四川省凉山木里中学2017-2018学年高二上学期期中考试化学试卷人教版2017-2018学年高二化学选修三同步训练:第三章 晶体结构与性质2云南省盐津县第一中学2018-2019学年高二上学期12月份考试化学试题云南省昭通水田新区中学2018-2019学年高二上学期12月月考化学试题云南省玉溪市元江县第一中学2018-2019学年高二下学期开学考试化学试题山东省泰安市宁阳一中2018-2019学年高二下学期期中考试化学试题云南省普洱市孟连县一中2018-2019学年高二下学期期末考试化学试题云南省普洱市澜沧县第一中学2018-2019学年高二下学期期末考试化学试题云南省玉溪市新平三中2019-2020学年高二上学期12月份月考化学试题四川省宜宾市叙州区第一中学校2019-2020学年高二下学期期中考试化学试题吉林省长春市第二十九中学2020-2021学年高二下学期第一学程考试化学试题
10-11高三上·河北唐山·期中
名校
7 . 下列物质性质的变化规律,与共价键的键能大小无关的是
①F2、Cl2、Br2、I2的熔点、沸点逐渐升高
②HF、HCl、HBr、HI的热稳定性依次减弱
③金刚石、碳化硅、晶体硅熔点逐渐降低
④NaF、NaCl、NaBr、NaI的熔点依次降低
①F2、Cl2、Br2、I2的熔点、沸点逐渐升高
②HF、HCl、HBr、HI的热稳定性依次减弱
③金刚石、碳化硅、晶体硅熔点逐渐降低
④NaF、NaCl、NaBr、NaI的熔点依次降低
| A.仅② | B.①④ | C.②③ | D.①②③ |
您最近一年使用:0次
2016-12-09更新
|
770次组卷
|
4卷引用:2014届江西省余江一中高三第四次模考化学试卷
(已下线)2014届江西省余江一中高三第四次模考化学试卷(已下线)2010年河北省唐山一中高三上学期期中考试化学卷2014届河北衡水中学高三上学期期中考试化学试卷广东省江门市新会陈经纶中学2022-2023学年高二下学期期中考试化学试题
9-10高二下·吉林·期末
名校
8 . 下列说法中,正确的是( )
| A.冰熔化时,分子中H﹣O键发生断裂 |
| B.原子晶体中,共价键的键长越短,通常熔点就越高 |
| C.分子晶体中,共价键键能越大,该分子的熔沸点就越高 |
| D.分子晶体中,分子间作用力越大,则分子越稳定 |
您最近一年使用:0次
2016-12-09更新
|
1367次组卷
|
15卷引用:江西省九江市柴桑区第一中学2020-2021学年高二下学期5月月考化学试题
江西省九江市柴桑区第一中学2020-2021学年高二下学期5月月考化学试题(已下线)吉林一中2009--2010学年度下学期期末考试第一次质量检测高二化学试卷(已下线)2012-2013年湖北省仙桃市毛嘴高中高二上学期学业水平监测试化学卷2015-2016学年贵州省思南中学高二下期中化学试卷云南省华宁二中2018-2019学年高二下学期开学考试化学试题黑龙江省哈尔滨市呼兰一中、阿城二中、宾县三中、尚志五中四校2018-2019学年高二下学期期中考试化学试题新疆乌鲁木齐市第四中学2018-2019学年高二下学期期末考试化学试题云南省陇川县第一中学2019-2020学年高二上学期期末考试化学试题新疆昌吉市教育共同体2019-2020学年高二下学期期中考试化学试题吉林省长春市实验中学2019-2020高二下学期期中考试化学试题福建省龙岩市武平县第一中学2020-2021学年高二上学期10月月考化学试题江苏宿迁泗阳县众兴中学2021届高三上学期调研考试化学试题四川省内江市威远中学2020-2021学年高二上学期期中考试化学试题吉林省长春市第二十九中学2020-2021学年高二下学期第一学程考试化学试题新疆阿克苏市实验中学2022-2023学年高二下学期第三次月考化学试题



