名校
解题方法
1 . 下列叙述中正确的是
| A.共价晶体(原子晶体)中,共价键的键能越大,熔沸点越高 |
| B.分子晶体中,分子间的作用力越大,该分子越稳定 |
| C.分子晶体中,共价键的键能越大,熔沸点越高 |
| D.共价晶体(原子晶体)中,构成晶体的微粒一定是相同的原子 |
您最近一年使用:0次
2 . 硅、锗(Ge)及其化合物广泛应用于光电材料领域。回答下列问题:
(1)基态硅原子最外层的电子排布图为___________ ,晶体硅和碳化硅熔点较高的是___________ (填化学式);
(2) 与N-甲基咪唑
与N-甲基咪唑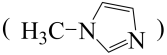 反应可以得到
反应可以得到 ,其结构如图所示:
,其结构如图所示:

N-甲基咪唑分子中碳原子的杂化轨道类型为___________ ,1个 中含有
中含有___________ 个 键;
键;
(3)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为( ,
, ,
, )。已知Xe—F键长为rpm,则B点原子的分数坐标为
)。已知Xe—F键长为rpm,则B点原子的分数坐标为___________ ;晶胞中A、B间距离d=___________ pm。

(1)基态硅原子最外层的电子排布图为
(2)
 与N-甲基咪唑
与N-甲基咪唑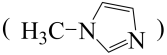 反应可以得到
反应可以得到 ,其结构如图所示:
,其结构如图所示:
N-甲基咪唑分子中碳原子的杂化轨道类型为
 中含有
中含有 键;
键;(3)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为(
 ,
, ,
, )。已知Xe—F键长为rpm,则B点原子的分数坐标为
)。已知Xe—F键长为rpm,则B点原子的分数坐标为
您最近一年使用:0次
名校
解题方法
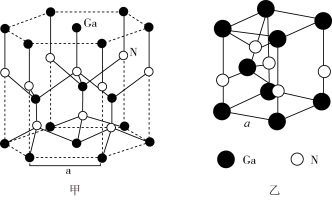
3 . 镓(Ga)、锗(Ge)、硅(Si)、硒(Se)的单质及某些化合物如砷化镓、磷化镓等都是常用的半导体材料,应用于航空航天测控、光纤通讯等领域。回答下列问题:
(1)硒常用作光敏材料,基态硒原子的核外电子排布式为_______ ;与硒同周期的p区元素中第一电离能大于硒的元素有_______ 种; 的空间构型是
的空间构型是_______ 。
(2)水晶的主要成分是二氧化硅,在水晶中硅原子的配位数是_______ 。硅与氢结合能形成一系列的二元化合物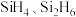 等,与氯、溴结合能形成
等,与氯、溴结合能形成 ,上述四种物质沸点由高到低顺序为
,上述四种物质沸点由高到低顺序为_______ ,丁硅烯 中
中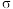 键与
键与 键个数之比为
键个数之比为_______ 。
(3)GaN、GaP、GaAs都是原子晶体,熔点如表所示,分析其熔点变化的原因_______ 。
(4)GaN晶胞结构如图甲所示。已知六棱柱底边边长为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。从GaN晶体中分割出的平行六面体如图乙,该平行六面体的高为
。从GaN晶体中分割出的平行六面体如图乙,该平行六面体的高为 ,GaN晶体的密度为
,GaN晶体的密度为_______  (用
(用 表示)。
表示)。
(1)硒常用作光敏材料,基态硒原子的核外电子排布式为
 的空间构型是
的空间构型是(2)水晶的主要成分是二氧化硅,在水晶中硅原子的配位数是
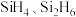 等,与氯、溴结合能形成
等,与氯、溴结合能形成 ,上述四种物质沸点由高到低顺序为
,上述四种物质沸点由高到低顺序为 中
中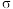 键与
键与 键个数之比为
键个数之比为(3)GaN、GaP、GaAs都是原子晶体,熔点如表所示,分析其熔点变化的原因
| GaN | GaP | GaAs | |
| 熔点 | 1700℃ | 1480℃ | 1238℃ |
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。从GaN晶体中分割出的平行六面体如图乙,该平行六面体的高为
。从GaN晶体中分割出的平行六面体如图乙,该平行六面体的高为 ,GaN晶体的密度为
,GaN晶体的密度为 (用
(用 表示)。
表示)。
您最近一年使用:0次
2021-03-08更新
|
904次组卷
|
4卷引用:2021年湖南省高考化学试卷变式题11-19
解题方法
4 . N、P、As、Ga、Cr、Cu等元素化合物种类繁多,具有重要的研究价值和应用价值。
请回答下列问题:
(1)Cu原子的价电子排布式为________________________ 。
(2)PCl5是磷元素的重要化合物,在固态时的结构单元可以写成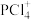 、
、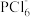 ,根据价电子互斥理论推测这两种阳离子的空间构型分别为
,根据价电子互斥理论推测这两种阳离子的空间构型分别为________________________ 、________________________ 。
(3)As的核外电子排布式中不同类型(s、p、d)的电子比是________________________ 。
(4)N、P氢化物的沸点较高的是________________________ (填化学式),其理由是________________________ 。
(5)已知N2F2分子中每个原子的最外层都达到8电子稳定结构,则氮原子的杂化轨道类型为________________________ ,画出N2F2可能的结构式________________________ 。
(6)砷化镓以第三代半导体著称,熔点为1230℃,具有空间网状结构,性能比硅更优良,广泛用于雷达、电子计算机、人造卫星、宇宙飞船等尖端技术中,据此可知砷化镓属于________________________ 晶体。已知氮化硼与砷化镓属于同种晶体类型。则两种晶体熔点较高的是________________________ (填化学式),其理由是________________________ 。
(7)铜的化合物种类很多,如图是氧化亚铜的晶胞结构,若最近的Cu与O的核间距离为anm,用NA表示阿伏加德罗常数,则氧化亚铜晶体的密度是________________________ g/cm3(列式即可)。

请回答下列问题:
(1)Cu原子的价电子排布式为
(2)PCl5是磷元素的重要化合物,在固态时的结构单元可以写成
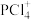 、
、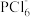 ,根据价电子互斥理论推测这两种阳离子的空间构型分别为
,根据价电子互斥理论推测这两种阳离子的空间构型分别为(3)As的核外电子排布式中不同类型(s、p、d)的电子比是
(4)N、P氢化物的沸点较高的是
(5)已知N2F2分子中每个原子的最外层都达到8电子稳定结构,则氮原子的杂化轨道类型为
(6)砷化镓以第三代半导体著称,熔点为1230℃,具有空间网状结构,性能比硅更优良,广泛用于雷达、电子计算机、人造卫星、宇宙飞船等尖端技术中,据此可知砷化镓属于
(7)铜的化合物种类很多,如图是氧化亚铜的晶胞结构,若最近的Cu与O的核间距离为anm,用NA表示阿伏加德罗常数,则氧化亚铜晶体的密度是

您最近一年使用:0次
名校
5 . 短周期元素X、Y、Z、W的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数,且X、Y、W原子最外层电子数之和恰好等于Z元素的核电荷数,X与W的最高化合价之和为8.常见元素Z的单质是目前使用量最大的主族金属元素单质,下列说法中不正确的是
| A.因为Z的氧化物熔点很高。不适宜于电解,故工业上常用电解Z与W的化合物的方法制取单质Z |
| B.化合物YW3遇水能强烈水解,产物之一具有强氧化性 |
| C.离子化合物YX5假如存在。该物质与水反应必然生成气体X2,同时得到一种弱碱溶液 |
| D.Y、Z形成的一种化合物强度高,热膨胀系数小,是良好的耐热冲击材料,该化合物属于原子晶体 |
您最近一年使用:0次
2020-08-15更新
|
60次组卷
|
5卷引用:【校级联考】湖南湖北八市十二校(湖南师范大学附属中学、衡阳八中等)2019届高三下学期第二次调研联考理科综合化学试题
6 . 下列说法正确的是( )
| A.金刚石与晶体硅都是原子晶体 |
| B.分子晶体中一定含有共价键 |
| C.离子晶体中一定不存在非极性键 |
| D.离子晶体中可能含有共价键,但一定含有金属元素 |
您最近一年使用:0次
2019-10-24更新
|
260次组卷
|
2卷引用:湖南省永州市祁阳县2021-2022学年高三下学期一模联考化学试题
名校
7 . 下列说法正确的是
| A.Na2S2、NaClO 中所含化学键类型完全相同 |
| B.白磷和食盐晶体熔化需克服相同类型的作用力 |
| C.碳化铝的熔点达到 2000℃以上,由于熔融状态不导电,所以属于原子晶体 |
| D.CCl4 和 HCl 都是共价化合物,并且都属于电解质 |
您最近一年使用:0次
2018高二下·全国·专题练习
名校
解题方法
8 . 下列晶体性质的比较中错误的是
| A.熔点:金刚石>碳化硅>晶体硅 | B.沸点:NH3>PH3 |
| C.硬度:白磷>冰>二氧化硅 | D.熔点:SiI4>SiBr4>SiCl4 |
您最近一年使用:0次
2018-06-11更新
|
946次组卷
|
13卷引用:湖南省长沙市雅礼中字2022-2023学年高二下学期第一次月考化学试题
湖南省长沙市雅礼中字2022-2023学年高二下学期第一次月考化学试题(已下线)2018年5月23日 原子晶体与分子晶体的比较——《每日一题》2017-2018学年高二化学人教选修3(已下线)2019年5月8日 《每日一题》选修3-原子晶体与分子晶体的比较四川省雅安市2019-2020学年高二上学期期末检测化学试题(人教版2019)选择性必修2 第三章 晶体结构与性质 第二节 分子晶体与共价晶体河北省沧州市第一中学2020-2021学年高二下学期第一次月考化学试题陕西省宝鸡市金台区2020-2021学年高二下学期期末考试化学试题(已下线)课时56 晶体结构与性质-2022年高考化学一轮复习小题多维练(全国通用)专题强化练5 分子晶体与共价晶体专题强化练7 晶体熔、沸点高低的比较四川省广安市第二中学校2022-2023学年高二下学期期中考试化学试题广东省惠州市华罗庚中学2022-2023学年高二下学期3月月考化学试题(已下线)第6讲 晶体结构与性质



