1 . 立方晶系二元合金
有一立方晶系二元合金,单胞参数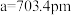 。单胞中的金属A原子与金刚石中碳原子位置相同,原子处于密堆积状态。在单胞中有若干金属B原子,每4个B原子构成一个正四面体
。单胞中的金属A原子与金刚石中碳原子位置相同,原子处于密堆积状态。在单胞中有若干金属B原子,每4个B原子构成一个正四面体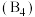 ,已知晶胞中
,已知晶胞中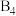 的位置可看成填充于A原子堆积形成的四面体孔隙中,沿轴向的单胞投影示意图如图所示:
的位置可看成填充于A原子堆积形成的四面体孔隙中,沿轴向的单胞投影示意图如图所示:
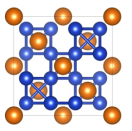
(1)写出二元合金的化学式_______ 。
(2)已知金属A和B的原子量分别为24.31和53.55,计算合金的理论密度_______ 。
(3)晶胞的单位点阵型式_______ 。
(4)实际上,大部分该类结构二元合金的原子半径比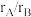 处于1.1~1.4之间,假设沿单胞面对角线方向上的B原子在整个结构紧密接触,计算金属B的原子半径和
处于1.1~1.4之间,假设沿单胞面对角线方向上的B原子在整个结构紧密接触,计算金属B的原子半径和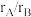 值
值_______ 、_______ 。
有一立方晶系二元合金,单胞参数
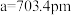 。单胞中的金属A原子与金刚石中碳原子位置相同,原子处于密堆积状态。在单胞中有若干金属B原子,每4个B原子构成一个正四面体
。单胞中的金属A原子与金刚石中碳原子位置相同,原子处于密堆积状态。在单胞中有若干金属B原子,每4个B原子构成一个正四面体 ,已知晶胞中
,已知晶胞中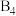 的位置可看成填充于A原子堆积形成的四面体孔隙中,沿轴向的单胞投影示意图如图所示:
的位置可看成填充于A原子堆积形成的四面体孔隙中,沿轴向的单胞投影示意图如图所示:
(1)写出二元合金的化学式
(2)已知金属A和B的原子量分别为24.31和53.55,计算合金的理论密度
(3)晶胞的单位点阵型式
(4)实际上,大部分该类结构二元合金的原子半径比
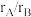 处于1.1~1.4之间,假设沿单胞面对角线方向上的B原子在整个结构紧密接触,计算金属B的原子半径和
处于1.1~1.4之间,假设沿单胞面对角线方向上的B原子在整个结构紧密接触,计算金属B的原子半径和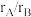 值
值
您最近一年使用:0次
21-22高二下·全国·单元测试
解题方法
2 . 金属晶体
(1)在金属晶体中,原子间以_____________ 相结合。
(2)金属晶体的性质:优良的_____________ 、_____________ 和_____________ 。
(1)在金属晶体中,原子间以
(2)金属晶体的性质:优良的
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
3 . 氮元素在农药生产及工业、制造业等领域用途非常广泛。已知氨在一定条件下可形成一种立方晶系,其立方晶胞沿x、y、z轴的投影图均如图所示。回答下列问题:
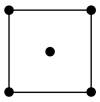
(1)晶胞的棱长为 ,设
,设 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为_______  (写出含
(写出含 、a的表达式)。
、a的表达式)。
(2)请画出该立方晶胞沿体对角线方向的投影图:_______ 。

(1)晶胞的棱长为
 ,设
,设 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为 (写出含
(写出含 、a的表达式)。
、a的表达式)。(2)请画出该立方晶胞沿体对角线方向的投影图:
您最近一年使用:0次
名校
解题方法
4 . X、Y、Z、M为原子序数依次增大的四种短周期主族元素,Y与M同主族,X的一种1∶2型氢化物分子中既有 键又有π键,且所有原子共平面;Y的基态原子L层上有2个未成对电子;Z元素的原子在同周期原子中半径最大。下列说法正确的是
键又有π键,且所有原子共平面;Y的基态原子L层上有2个未成对电子;Z元素的原子在同周期原子中半径最大。下列说法正确的是
 键又有π键,且所有原子共平面;Y的基态原子L层上有2个未成对电子;Z元素的原子在同周期原子中半径最大。下列说法正确的是
键又有π键,且所有原子共平面;Y的基态原子L层上有2个未成对电子;Z元素的原子在同周期原子中半径最大。下列说法正确的是A.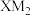 中心原子的杂化方式为sp 中心原子的杂化方式为sp | B.晶体Z的堆积方式为简单立方堆积 |
C.与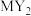 互为等电子体的分子有 互为等电子体的分子有 | D.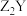 和 和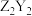 中化学键类型完全相同 中化学键类型完全相同 |
您最近一年使用:0次
2021-07-09更新
|
560次组卷
|
2卷引用:广东省肇庆市2020-2021学年高二下学期末教学质量检测化学(物质结构与性质)试题
解题方法
5 . 金属晶体的堆积方式___________ 堆积,配位数为___________ 。实例:钋。
(2)图④所示的堆积方式为___________ 堆积,配位数为___________ 。实例:钠、钾、铬、钼、钨等。
(3)图⑤所示的堆积方式为___________ 堆积,配位数为___________ 。实例:金、银、铜、铅等。
(4)图⑥所示的堆积方式为___________ 堆积,配位数为___________ 。实例:镁、锌、钛等。
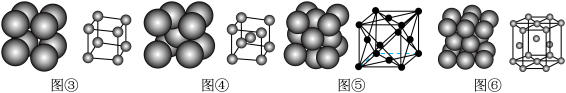
(2)图④所示的堆积方式为
(3)图⑤所示的堆积方式为
(4)图⑥所示的堆积方式为
您最近一年使用:0次
6 . 下列有关说法不正确 的是
 氢原子的电子云 |  金属Cu的晶胞结构 | 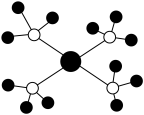 四氨合铜离子 |  CaF2晶胞结构 |
| A.电子云密度大的区域电子数目多 | B.晶胞中每个Cu原子周围有12个紧邻的原子 | C.铜离子与氨分子中的氮原子形成4个配位键 | D.每个CaF2晶胞平均占有4个Ca2+ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
7 . 煤电工业产生的烟气或汽车尾气中常含有NOx、CO等污染大气的气体,其中的NOx来源于如下反应:
反应Ⅰ:
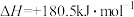
反应Ⅱ:
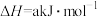
(1)反应Ⅱ在常温下就能自发进行,则a_______ 0。(填“>”或“<”)
(2)煤电工业烟气中的NO可利用“氨法脱硝”处理,其反应为
①反应中,生成 时,被
时,被 氧化的
氧化的 的质量为
的质量为_______ 。
②工业上可利用尿素[ ]水解制得
]水解制得 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
(3)为避免汽车尾气中的NOx和CO直接排放到大气中,可利用“三元催化转换器”将其转化为 和
和 。
。
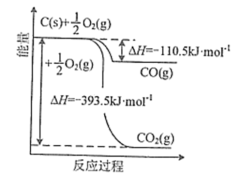
①已知含碳物质参与反应的能量变化如所示,则NO(g)和CO(g)转化为 和
和 的热化学方程式为
的热化学方程式为_______ 。
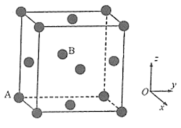
②“三元催化转换器”中用到了金属铂,如图为金属铂的晶胞结构示意图。金属铂晶体中,铂原子周围与之紧邻的其他铂原子数目为_______ 。若A原子的分数坐标为(0,0,0),则B原子的分数坐标为_______ 。
反应Ⅰ:

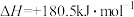
反应Ⅱ:

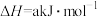
(1)反应Ⅱ在常温下就能自发进行,则a
(2)煤电工业烟气中的NO可利用“氨法脱硝”处理,其反应为

①反应中,生成
 时,被
时,被 氧化的
氧化的 的质量为
的质量为②工业上可利用尿素[
 ]水解制得
]水解制得 ,该反应的化学方程式为
,该反应的化学方程式为(3)为避免汽车尾气中的NOx和CO直接排放到大气中,可利用“三元催化转换器”将其转化为
 和
和 。
。①已知含碳物质参与反应的能量变化如所示,则NO(g)和CO(g)转化为
 和
和 的热化学方程式为
的热化学方程式为
②“三元催化转换器”中用到了金属铂,如图为金属铂的晶胞结构示意图。金属铂晶体中,铂原子周围与之紧邻的其他铂原子数目为

您最近一年使用:0次
名校
8 . I.有下列8种晶体,用序号回答下列问题:
A.水晶B.冰醋酸C.白磷D.固态氩E.氯化铵F.铝G.金刚石
(1)属于原子晶体的化合物是____ ,属于离子晶体的是____ ,不含化学键的分子晶体是____ 。
(2)由极性分子构成的晶体是____ ,含有共价键的离子晶体是____ 。
II.含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O。
(3)Cu+基态核外电子排布式为____ 。
(4)含有NaOH的Cu(OH)2悬浊液与乙醛反应的化学方程式为____ 。
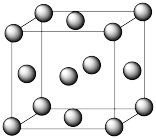
(5)Cu2O在稀硫酸中生成Cu和CuSO4。铜晶胞结构如图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为_____ 。
III.臭氧(O3)在[Fe(H2O)6]2+催化下能将烟气中的SO2、NOx氧化为SO和NO,NOx也可在其他条件下被还原为N2。
(6)SO 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为_____ ;NO 的空间构型为
的空间构型为_____ (用文字描述)。
(7)与O3分子互为等电子体的一种阴离子为_____ (填化学式)。
(8)N2分子中σ键与π键的数目比n(σ)∶n(π)=_____ 。
A.水晶B.冰醋酸C.白磷D.固态氩E.氯化铵F.铝G.金刚石
(1)属于原子晶体的化合物是
(2)由极性分子构成的晶体是
II.含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O。
(3)Cu+基态核外电子排布式为
(4)含有NaOH的Cu(OH)2悬浊液与乙醛反应的化学方程式为
(5)Cu2O在稀硫酸中生成Cu和CuSO4。铜晶胞结构如图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为

III.臭氧(O3)在[Fe(H2O)6]2+催化下能将烟气中的SO2、NOx氧化为SO和NO,NOx也可在其他条件下被还原为N2。
(6)SO
 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为 的空间构型为
的空间构型为(7)与O3分子互为等电子体的一种阴离子为
(8)N2分子中σ键与π键的数目比n(σ)∶n(π)=
您最近一年使用:0次
名校
解题方法
9 . “愚人金”因在野外很容易被误认为黄金而得名,其中一种主要成分是 ,可用于炼铜,流程如图:
,可用于炼铜,流程如图:

以下说法正确的是
 ,可用于炼铜,流程如图:
,可用于炼铜,流程如图:
以下说法正确的是
| A.铜元素在元素周期表中位于第四周期IB族 |
| B.冰铜中主要金属元素的化合价都是+2 |
| C.基态S原子核外电子的运动状态有5种 |
| D.铜晶胞类型为面心立方晶胞,晶胞中Cu的配位数是8 |
您最近一年使用:0次
解题方法
10 . 已知W、X、Y、Z为短周期元素,R外围电子的电子排布式为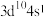 。常温下,W、X、Y、Z的最高价氧化物对应的水化物溶液(浓度均为
。常温下,W、X、Y、Z的最高价氧化物对应的水化物溶液(浓度均为 )的pH和原子半径、原子序数的关系如图所示。回答下列问题。
)的pH和原子半径、原子序数的关系如图所示。回答下列问题。
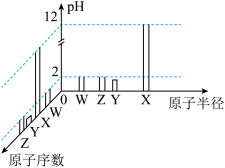
(1)R位于元素周期表中第_______ 周期第_______ 族。
(2)写出化合物 的电子式
的电子式_______ 。
(3)基态Z原子中存在未成对电子的能级,画出Z原子该能级的轨道表示式_______ 。
(4)XZ晶体中,其化学键的牢固程度可用_______ 衡量。
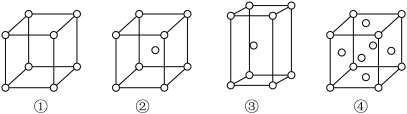
(5)有四种不同堆积方式的金属晶体的晶胞如下图所示,单质R晶体的堆积方式是_______ (填序号),其二维空间的排列方式为_______ (填“非密置层”或“密置层”)。
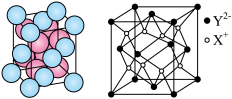
(6) 的晶胞如下图所示,设
的晶胞如下图所示,设 的半径为
的半径为 ,
, 的半径为
的半径为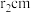 。该晶体中每个
。该晶体中每个 周围与它最接近且距离相等的
周围与它最接近且距离相等的 共有
共有_______ 个, 的配位数为
的配位数为_______ 。 晶体的密度为
晶体的密度为_______  。(阿伏加德罗常数的值用
。(阿伏加德罗常数的值用 表示,写表达式,不化简)。
表示,写表达式,不化简)。
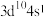 。常温下,W、X、Y、Z的最高价氧化物对应的水化物溶液(浓度均为
。常温下,W、X、Y、Z的最高价氧化物对应的水化物溶液(浓度均为 )的pH和原子半径、原子序数的关系如图所示。回答下列问题。
)的pH和原子半径、原子序数的关系如图所示。回答下列问题。
(1)R位于元素周期表中第
(2)写出化合物
 的电子式
的电子式(3)基态Z原子中存在未成对电子的能级,画出Z原子该能级的轨道表示式
(4)XZ晶体中,其化学键的牢固程度可用
(5)有四种不同堆积方式的金属晶体的晶胞如下图所示,单质R晶体的堆积方式是

(6)
 的晶胞如下图所示,设
的晶胞如下图所示,设 的半径为
的半径为 ,
, 的半径为
的半径为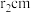 。该晶体中每个
。该晶体中每个 周围与它最接近且距离相等的
周围与它最接近且距离相等的 共有
共有 的配位数为
的配位数为 晶体的密度为
晶体的密度为 。(阿伏加德罗常数的值用
。(阿伏加德罗常数的值用 表示,写表达式,不化简)。
表示,写表达式,不化简)。
您最近一年使用:0次



