名校
1 . 下列有关晶体的叙述中,错误的是
A.氯化钠晶体中,每个 周围距离最近且相等的 周围距离最近且相等的 共有6个 共有6个 |
| B.金属晶体中,通过密置层叠放得到最密堆积 |
C.干冰晶体中,每个 分子周围距离最近且相等的 分子周围距离最近且相等的 分子共有12个 分子共有12个 |
| D.金刚石网状结构中,每个碳原子与4个碳原子形成共价键 |
您最近一年使用:0次
2021-02-07更新
|
262次组卷
|
2卷引用:鲁科版2019选择性必修2阶段性综合评估测试卷(二)
名校
解题方法
2 . 下列有关晶体的叙述中,错误的是
| A.干冰晶体中,每个CO2分子周围距离相等且最近的CO2分子共有12个 |
| B.金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子 |
| C.金属Cu晶体(面心立方晶胞)中,Cu的配位数为8 |
| D.氯化钠晶胞中,阴、阳离子的配位数均为6 |
您最近一年使用:0次
2021-02-06更新
|
610次组卷
|
6卷引用:四川省内江市2020-2021学年度第一学期高二期末检测化学试题
四川省内江市2020-2021学年度第一学期高二期末检测化学试题(已下线)第03章 不同聚集状态的物质与性质(B卷能力提升篇)-2020-2021学年高二化学同步单元AB卷(鲁科版2019选择性必修2)四川省内江市2020-2021学年高二上学期期末考试化学试题专题3 综合检测(提升卷)(已下线)【知识图鉴】单元讲练测选择性必修2第三章03单元测四川省射洪中学校2022-2023学年高二上学期11月期中考试化学试题
解题方法
3 . 下列为几种晶体或晶胞的示意图:
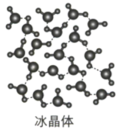
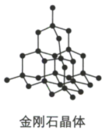
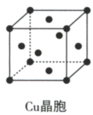
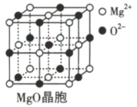
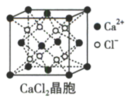
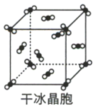
请回答下列问题:
(1)上述晶体中,粒子之间以共价键结合形成晶体的是________ 。
(2)冰、金刚石、 、
、 、干冰5种晶体的熔点由高到低的顺序为
、干冰5种晶体的熔点由高到低的顺序为____________ 。
(3)每个 晶胞中实际占有
晶胞中实际占有_____ 个 原子;
原子; 晶体中
晶体中 的配位数为
的配位数为_______ 。
(4)冰的熔点远高于干冰,除 是极性分子、
是极性分子、 是非极性分子外,还有一个重要的原因是
是非极性分子外,还有一个重要的原因是___ 。






请回答下列问题:
(1)上述晶体中,粒子之间以共价键结合形成晶体的是
(2)冰、金刚石、
 、
、 、干冰5种晶体的熔点由高到低的顺序为
、干冰5种晶体的熔点由高到低的顺序为(3)每个
 晶胞中实际占有
晶胞中实际占有 原子;
原子; 晶体中
晶体中 的配位数为
的配位数为(4)冰的熔点远高于干冰,除
 是极性分子、
是极性分子、 是非极性分子外,还有一个重要的原因是
是非极性分子外,还有一个重要的原因是
您最近一年使用:0次
21-22高三上·江苏常州·期末
解题方法
4 . 铁元素被称为“人类第一元素”,其化合物应用广泛。
Ⅰ.硫化亚铁(FeS)是一种常见的还原剂。用FeS处理模拟含铬废水的流程如下:
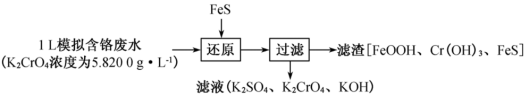
(1)“还原”过程发生反应的离子方程式为______ 。
(2)为测定模拟废水中铬元素的去除率,进行如下实验:将滤渣用蒸馏水洗净后,在低温条件下干燥,称得质量为2.2100g。将上述2.2100g固体在空气中加热,测得固体质量随温度的变化如图所示。

说明:780℃以上的残留固体为Fe2O3、Cr2O3的化合物
① A→B固体质量增加是由滤渣中______ (填化学式)发生反应引起的。
② 在空气中FeO稳定性小于Fe2O3,从电子排布的角度分析,其主要原因是______ 。
③ 根据以上实验数据计算上述模拟废水中铬元素的去除率______ (写出计算过程)。
Ⅱ.铁元素是构成人体的必不可少的元素之一,补铁剂种类繁多,其中一种有效成分是琥珀酸亚铁(图1)。

(1) 琥珀酸亚铁中碳原子的杂化轨道类型为______ ,1mol琥珀酸亚铁中含σ键______ mol。
(2) 用邻二氮菲(phen,如图2)与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应:Fe2++3phen=[Fe(phen)3]2+。[Fe(phen)3]2+中,Fe2+的配位数为______ 。用邻二氮菲测定Fe2+浓度时应控制pH在2~9适宜范围,原因是______ 。
Ⅰ.硫化亚铁(FeS)是一种常见的还原剂。用FeS处理模拟含铬废水的流程如下:

(1)“还原”过程发生反应的离子方程式为
(2)为测定模拟废水中铬元素的去除率,进行如下实验:将滤渣用蒸馏水洗净后,在低温条件下干燥,称得质量为2.2100g。将上述2.2100g固体在空气中加热,测得固体质量随温度的变化如图所示。

说明:780℃以上的残留固体为Fe2O3、Cr2O3的化合物
① A→B固体质量增加是由滤渣中
② 在空气中FeO稳定性小于Fe2O3,从电子排布的角度分析,其主要原因是
③ 根据以上实验数据计算上述模拟废水中铬元素的去除率
Ⅱ.铁元素是构成人体的必不可少的元素之一,补铁剂种类繁多,其中一种有效成分是琥珀酸亚铁(图1)。

(1) 琥珀酸亚铁中碳原子的杂化轨道类型为
(2) 用邻二氮菲(phen,如图2)与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应:Fe2++3phen=[Fe(phen)3]2+。[Fe(phen)3]2+中,Fe2+的配位数为
您最近一年使用:0次
5 . 元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成晶体的晶胞结构如下图所示。下列说法错误 的是


| A.该晶体的阳离子与阴离子个数比为3:1 |
| B.该晶体中Xn+离子中n=3 |
| C.该晶体中每个N3-被6个等距离的Xn+离子包围 |
| D.X元素的原子序数是19 |
您最近一年使用:0次
2021-01-29更新
|
297次组卷
|
4卷引用:第03章 不同聚集状态的物质与性质(A卷基础强化篇)-2020-2021学年高二化学同步单元AB卷(鲁科版2019选择性必修2)
(已下线)第03章 不同聚集状态的物质与性质(A卷基础强化篇)-2020-2021学年高二化学同步单元AB卷(鲁科版2019选择性必修2)江苏省木渎高级中学等三校2020-2021学年高二上学期12月联合调研化学试题山东省滕州市第一中学2020-2021学年高二下学期3月份阶段检测化学试题湖南省常德市临澧县第一中学2021-2022学年高二下学期第一次阶段性考试化学试题
解题方法
6 . 下列关于Na、Cs的化合物结构与性质的说法错误的是
| A.NaCl为离子化合物,可推知CsCl也为离子化合物 |
| B.NaCl与CsCl相比,熔点更高 |
| C.NaCl与CsCl晶胞中Cl-的配位数均为8 |
| D.Cs+容易形成配合物而Na+一般不会形成配合物的原因与微粒半径有关 |
您最近一年使用:0次
7 . 钡在氧气中燃烧时得到一种钡的氧化物晶体,其晶胞的结构如图所示,下列有关说法中正确的是


| A.该晶体属于离子晶体 |
| B.晶体的化学式为Ba2O2 |
| C.该晶体的晶胞结构与CsCl相似 |
| D.与每个Ba2+距离相等且最近的Ba2+共有8个 |
您最近一年使用:0次
2021-01-26更新
|
296次组卷
|
4卷引用:海南省华中师范大学海南附属中学2021届高三上学期第四次月考化学试题
8 . 铅及其化合物用途广泛,请回答下列相关问题:
(1)铅元素(82Pb)位于周期表中第_______ 周期,基态价电子排布式为_______ 。相同温度下,同浓度的Na2PbO3溶液碱性比Na2CO3溶液碱性_______ (填“强”或“弱”)。
(2)工业上利用铅浮渣(主要成分是PbO2、Pb,含有少量Ag、CaO和其他不溶于硝酸的杂质)生产硫酸铅和硫化铅纳米粒子,流程如图所示:
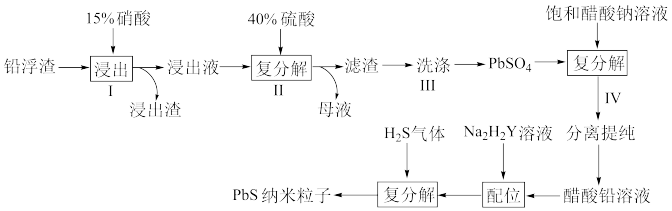
已知:25℃时,Ksp(CaSO4)=4.9×10−5,Ksp(PbSO4)=1.6×10−8,Ksp(PbS)=1.0×10−28。
①已知步骤Ⅰ有NO产生,Pb被稀硝酸氧化成Pb2+。写出Pb参加反应的离子方程式:_______ 。
②步骤Ⅰ需控制硝酸的用量并使Pb稍有剩余,浸出渣的成分除了不溶于硝酸的杂质和铅外,还主要有_______ 。
③步骤Ⅲ需用Pb(NO3)2溶液多次洗涤硫酸铅的原因是_______ 。
④EDTA二钠简写成Na2H2Y,可以与Pb2+形成稳定的配离子,其结构如图,此配离子内所含作用力除σ键外,还有_______ 。
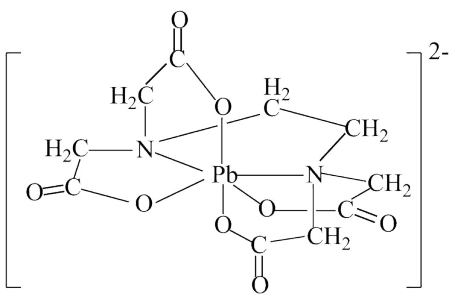
⑤PbS晶胞与NaCl晶胞相同,则S2−的配位数是_______ 。
(1)铅元素(82Pb)位于周期表中第
(2)工业上利用铅浮渣(主要成分是PbO2、Pb,含有少量Ag、CaO和其他不溶于硝酸的杂质)生产硫酸铅和硫化铅纳米粒子,流程如图所示:

已知:25℃时,Ksp(CaSO4)=4.9×10−5,Ksp(PbSO4)=1.6×10−8,Ksp(PbS)=1.0×10−28。
①已知步骤Ⅰ有NO产生,Pb被稀硝酸氧化成Pb2+。写出Pb参加反应的离子方程式:
②步骤Ⅰ需控制硝酸的用量并使Pb稍有剩余,浸出渣的成分除了不溶于硝酸的杂质和铅外,还主要有
③步骤Ⅲ需用Pb(NO3)2溶液多次洗涤硫酸铅的原因是
④EDTA二钠简写成Na2H2Y,可以与Pb2+形成稳定的配离子,其结构如图,此配离子内所含作用力除σ键外,还有

⑤PbS晶胞与NaCl晶胞相同,则S2−的配位数是
您最近一年使用:0次
9 . K2S的晶胞结构如图所示。其中K+的配位数为___________ ,S2-的配位数为___________ ;若晶胞中距离最近的两个S2-核间距为acm,则K2S晶体的密度为___________ g·cm-3(列出计算式,不必计算出结果)。


您最近一年使用:0次
10 . 类比推理是化学中常用的思维方法,下列推理正确的是( )
| A.氯化钠晶体的阳离子配位数是6,推测氯化铯晶体的阳离子的配位数也是6 |
| B.CO2是直线型分子,推测SiO2也是直线型分子 |
| C.金刚石中原子之间以共价键结合,推测晶体硅中原子之间也是以共价键结合 |
| D.SiH4的沸点高于CH4,推测HCl的沸点高于HF |
您最近一年使用:0次
2020-11-17更新
|
265次组卷
|
2卷引用:河北省张家口市2021届高三上学期第一阶段检测化学试题



