1 . 不同尺寸的冠醚可以装载不同大小的金属离子,偶氮苯在紫外光与可见光的作用下会发生顺式与反式结构的转变。如下分子的结构中都包含冠醚和偶氮苯片段,请你想象这些分子具有怎样的性质特点、可能会有怎样的应用________ 。


您最近一年使用:0次
2 . 下列关于晶体的说法一定正确的是


| A.分子晶体中都存在共价键 |
| B.CaTiO3晶体中每个Ti4+与12个O2-相邻 |
| C.SiO2晶体中每个硅原子与两个氧原子以共价键相结合 |
| D.金属晶体的熔点都比分子晶体的熔点高 |
您最近一年使用:0次
3 . 过渡金属元素铬 是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
(1)对于基态Cr原子,下列叙述正确的是_______ (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为
B.4s轨道上电子能量较高,总是在比3s轨道上电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(2)三价铬离子能形成多种配位化合物。 中提供电子对形成配位键的原子是
中提供电子对形成配位键的原子是_______ ,中心离子的配位数为_______ 。
(3) 中配体分子
中配体分子 、
、 以及分子
以及分子 的空间结构和相应的键角如图所示。
的空间结构和相应的键角如图所示。
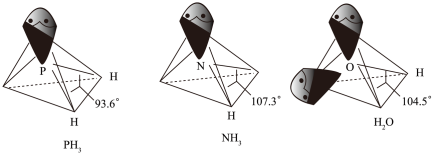
 中P的杂化类型是
中P的杂化类型是_______ 。 的沸点比
的沸点比 的
的_______ ,原因是_______ , 的键角小于
的键角小于 的,分析原因
的,分析原因_______ 。
(4)在金属材料中添加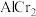 颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。
颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。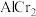 具有体心四方结构,如图所示,处于顶角位置的是
具有体心四方结构,如图所示,处于顶角位置的是_______ 原子。设Cr和Al原子半径分别为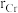 和
和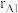 ,则金属原子空间占有率为
,则金属原子空间占有率为_______ %(列出计算表达式)。

 是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:(1)对于基态Cr原子,下列叙述正确的是
A.轨道处于半充满时体系总能量低,核外电子排布应为

B.4s轨道上电子能量较高,总是在比3s轨道上电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(2)三价铬离子能形成多种配位化合物。
 中提供电子对形成配位键的原子是
中提供电子对形成配位键的原子是(3)
 中配体分子
中配体分子 、
、 以及分子
以及分子 的空间结构和相应的键角如图所示。
的空间结构和相应的键角如图所示。
 中P的杂化类型是
中P的杂化类型是 的沸点比
的沸点比 的
的 的键角小于
的键角小于 的,分析原因
的,分析原因(4)在金属材料中添加
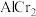 颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。
颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。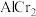 具有体心四方结构,如图所示,处于顶角位置的是
具有体心四方结构,如图所示,处于顶角位置的是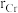 和
和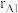 ,则金属原子空间占有率为
,则金属原子空间占有率为
您最近一年使用:0次
2021-06-09更新
|
20277次组卷
|
19卷引用:2021年高考全国乙卷化学真题
2021年高考全国乙卷化学真题吉林省长春外国语学校2020-2021学年高二下学期第二次月考化学试题(已下线)专题14 物质结构与性质-备战2022年高考化学学霸纠错(全国通用)(已下线)2021年高考全国乙卷化学试题变式题(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题19 物质结构与性质-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)回归教材重难点11 物质结构与性质(选考)-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)押全国卷理综第35题 物质结构与性质-备战2022年高考化学临考题号押题(课标全国卷)(已下线)专题18物质结构与性质(选修)-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题18物质结构与性质(选修)-五年(2018~2022)高考真题汇编(全国卷)吉林省汪清县汪清四中2020-2021学年高二下学期期末考试化学试题(已下线)专题02 物质结构专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)广东省广州市真光中学2022-2023学年高二下学期期中考试化学试题(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)新疆柯坪县柯坪湖州国庆中学2021-2022学年高二下学期期末考试化学试题广东省茂名市电白区2021-2022学年高二下学期期中(选择性)考试化学试题
4 . “原子坐标参数”可以表示晶胞内部各原子的相对位置。 是典型的离子晶体,A、B两点坐标如图所示,晶胞边长为
是典型的离子晶体,A、B两点坐标如图所示,晶胞边长为 。下列说法错误的是
。下列说法错误的是

 是典型的离子晶体,A、B两点坐标如图所示,晶胞边长为
是典型的离子晶体,A、B两点坐标如图所示,晶胞边长为 。下列说法错误的是
。下列说法错误的是
A. 周围最近且等距离的 周围最近且等距离的 为4个 为4个 | B. 和 和 最近核间距为 最近核间距为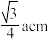 |
C.C点的坐标参数为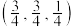 | D. 的熔点高于 的熔点高于 |
您最近一年使用:0次
2021-05-31更新
|
506次组卷
|
3卷引用:辽宁省协作校2020-2021学年高二下学期期中考试化学试题
5 . Cu2ZnSnS4是太阳能薄膜电池的重要成分,其晶胞结构(棱边夹角均为90°)如图所示,下列说法错误的是


| A.第一电离能:Cu<Zn |
| B.1个晶胞中含有Cu2ZnSnS4单元数为2个 |
| C.距离每个Zn原子最近的S原子数为2个 |
| D.四种元素基态原子中,核外电子空间运动状态最多的为Sn原子 |
您最近一年使用:0次
6 . 亚铁氰化钾属于欧盟批准使用的食品添加剂,受热易分解: 3K4[Fe(CN)6]  12KCN+Fe3C+2(CN)2↑+N2↑+C,下列关于该反应说法错误的是
12KCN+Fe3C+2(CN)2↑+N2↑+C,下列关于该反应说法错误的是
 12KCN+Fe3C+2(CN)2↑+N2↑+C,下列关于该反应说法错误的是
12KCN+Fe3C+2(CN)2↑+N2↑+C,下列关于该反应说法错误的是| A.Fe2+的最高能级电子排布为3d6 |
| B.(CN)2分子中σ键和π键数目比为 3∶4 |
| C.已知 Fe3C 晶胞中每个碳原子被 6 个铁原子包围,则铁的配位数是3 |
| D.配合物K4[Fe(CN)6]中提供空轨道的粒子是Fe2+ |
您最近一年使用:0次
7 .  是第四周期元素,其原子最外层只有
是第四周期元素,其原子最外层只有 个电子,次外层的所有原子轨道均充满电子。元素
个电子,次外层的所有原子轨道均充满电子。元素 的负一价离子的最外层电子数与次外层电子数相同。下列说法
的负一价离子的最外层电子数与次外层电子数相同。下列说法错误 的是

 是第四周期元素,其原子最外层只有
是第四周期元素,其原子最外层只有 个电子,次外层的所有原子轨道均充满电子。元素
个电子,次外层的所有原子轨道均充满电子。元素 的负一价离子的最外层电子数与次外层电子数相同。下列说法
的负一价离子的最外层电子数与次外层电子数相同。下列说法
A.单质 的晶体类型为金属晶体 的晶体类型为金属晶体 |
B.已知单质 是面心立方最密堆积,其中 是面心立方最密堆积,其中 原子的配位数为 原子的配位数为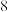 |
C.元素 的基态原子的核外电子排布式为 的基态原子的核外电子排布式为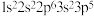 |
D. 与 与 形成的一种化合物的立方晶胞如图所示。该化合物的化学式为 形成的一种化合物的立方晶胞如图所示。该化合物的化学式为 |
您最近一年使用:0次
8 . 锆( )和镉(
)和镉( )是目前光电材料广泛使用的元素。
)是目前光电材料广泛使用的元素。 和
和 的晶胞分别如图甲、图乙所示:
的晶胞分别如图甲、图乙所示:
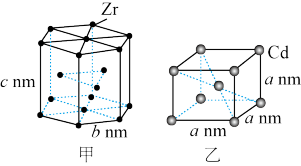
下列说法正确的是
 )和镉(
)和镉( )是目前光电材料广泛使用的元素。
)是目前光电材料广泛使用的元素。 和
和 的晶胞分别如图甲、图乙所示:
的晶胞分别如图甲、图乙所示:
下列说法正确的是
A.每个锆晶胞中含 原子个数为8 原子个数为8 |
B.在镉晶胞中两个镉原子最近核间距为  |
C.在镉晶胞中 的配位数为4 的配位数为4 |
D.锆晶体的密度为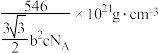 |
您最近一年使用:0次
2021-05-17更新
|
540次组卷
|
4卷引用:湖北省2020-2021学年高三下学期新高考模拟联考化学试题
湖北省2020-2021学年高三下学期新高考模拟联考化学试题(已下线)专题讲座(十二) 晶胞参数、坐标参数的分析与应用(精练)-2022年一轮复习讲练测浙江省诸暨市海亮高级中学2021-2022学年高二上学期期中考试化学试题甘肃省张掖市高台县第一中学2022-2023学年高二上学期12月月考化学试题
9 . 萤石( )晶胞结构如图所示,晶胞边长为apm,
)晶胞结构如图所示,晶胞边长为apm, 和
和 半径大小分别为
半径大小分别为 和
和 。下列说法中正确的是
。下列说法中正确的是
 )晶胞结构如图所示,晶胞边长为apm,
)晶胞结构如图所示,晶胞边长为apm, 和
和 半径大小分别为
半径大小分别为 和
和 。下列说法中正确的是
。下列说法中正确的是
A.该晶胞中 的配位数为4 的配位数为4 |
B.半径大小关系为 |
C.该晶胞中含有的 数目为12 数目为12 |
D.该晶胞中 和 和 的最近距离为 的最近距离为 |
您最近一年使用:0次
2021-05-16更新
|
525次组卷
|
3卷引用:辽宁省沈阳市2021届高三年级教学质量监测(三)化学试题
辽宁省沈阳市2021届高三年级教学质量监测(三)化学试题(已下线)专题讲座(十二) 晶胞参数、坐标参数的分析与应用(精练)-2022年一轮复习讲练测广东省梅州市梅雁中学2023-2024学年高二下学期3月月考化学试题
解题方法
10 . 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1,在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,原理为:2XCl+2CO+2H2O=X2Cl2·2CO·2H2O
(1)C、H、O三种元素的电负性由大到小的顺序为_______ ;
(2)H2O中氧原子的轨道杂化类型为_______ ;
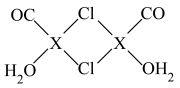
(3)X2Cl2·2CO·2H2O是一种配合物,结构如图所示,每个X原子能与其他原子形成3个配位键,在下图中用“→”标出相应的配位键__ 。
(4)CO与N2分子的结构相似,则1molX2Cl2·2CO·2H2O含有σ键的物质的量为_____ mol。
(5)化合物XCl晶体的晶胞如图所示,距离每个X离子最近的Cl-的个数为____ 。
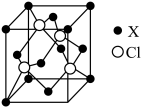
(1)C、H、O三种元素的电负性由大到小的顺序为
(2)H2O中氧原子的轨道杂化类型为
(3)X2Cl2·2CO·2H2O是一种配合物,结构如图所示,每个X原子能与其他原子形成3个配位键,在下图中用“→”标出相应的配位键

(4)CO与N2分子的结构相似,则1molX2Cl2·2CO·2H2O含有σ键的物质的量为
(5)化合物XCl晶体的晶胞如图所示,距离每个X离子最近的Cl-的个数为

您最近一年使用:0次



