1 . 某笼形络合物Ni(CN)x(NH3)y(C6H6)z结构中,金属离子与CN-连接形成平面层,两个平面层通过NH3分子连接,中间的空隙填充大小合适的分子(如C6H6),其基本结构如图(H原子未画出)。下列说法正确的是


| A.该结构是晶胞结构单元 |
| B.x:y:z=2:1:1 |
| C.金属离子的配位数都是4 |
D.该笼形络合物A的晶胞密度为 g/cm3 g/cm3 |
您最近一年使用:0次
2023-05-05更新
|
281次组卷
|
2卷引用:江西省九江市德安县第一中学2022-2023学年高二下学期5月期中考试化学试题
名校
解题方法
2 . 金属钴广泛应用于航空航天、电器制造等领域,是一种重要的战略金属,我国钴资源匮乏,绝大多数属于伴生矿。一种以进口水钴矿(主要成分为 ,杂质中
,杂质中 含量较高,还有少量
含量较高,还有少量 、
、 、
、 、
、 、
、 等)为原料提取钴和铜的工艺流程如图所示。
等)为原料提取钴和铜的工艺流程如图所示。
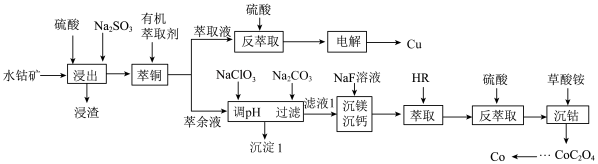
已知:①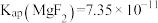 、
、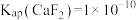
②部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
回答下列问题:
(1) 在元素周期表中的位置为
在元素周期表中的位置为_______ 。
(2)电解 溶液提取铜剩余的电解贫液(
溶液提取铜剩余的电解贫液( 稀溶液)可返回到
稀溶液)可返回到_______ 工序中循环利用。
(3) 仅用硫酸很难浸出,加入
仅用硫酸很难浸出,加入 后发生“还原浸出”,该反应的离子方程式为
后发生“还原浸出”,该反应的离子方程式为_______ 。
(4)沉淀1的主要成分有_______ ,用 调溶液的pH范围是
调溶液的pH范围是_______ 。
(5)① 的作用是将溶液中的
的作用是将溶液中的 、
、 转化为
转化为 、
、 沉淀,若过滤后“滤液1”中
沉淀,若过滤后“滤液1”中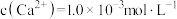 ,当除钙率达到90%时,溶液中
,当除钙率达到90%时,溶液中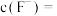
_______  。
。
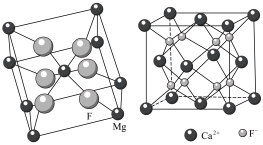
②下图为 晶胞和
晶胞和 晶胞,两种晶胞中
晶胞,两种晶胞中 与
与 的配位数之比为
的配位数之比为_______ 。
(6) 萃取的反应原理为
萃取的反应原理为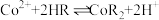 ,向有机萃取剂中加入
,向有机萃取剂中加入 能进行反萃取的原因是
能进行反萃取的原因是_______ (结合平衡移动原理解释)。
 ,杂质中
,杂质中 含量较高,还有少量
含量较高,还有少量 、
、 、
、 、
、 、
、 等)为原料提取钴和铜的工艺流程如图所示。
等)为原料提取钴和铜的工艺流程如图所示。
已知:①
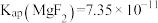 、
、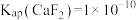
②部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
| 金属离子 |  |  |  |  |  |
| 开始沉淀的pH | 2.3 | 7.5 | 7.6 | 3.4 | 7.6 |
| 完全沉淀的pH | 2.8 | 8.3 | 9.2 | 5.2 | 9.8 |
(1)
 在元素周期表中的位置为
在元素周期表中的位置为(2)电解
 溶液提取铜剩余的电解贫液(
溶液提取铜剩余的电解贫液( 稀溶液)可返回到
稀溶液)可返回到(3)
 仅用硫酸很难浸出,加入
仅用硫酸很难浸出,加入 后发生“还原浸出”,该反应的离子方程式为
后发生“还原浸出”,该反应的离子方程式为(4)沉淀1的主要成分有
 调溶液的pH范围是
调溶液的pH范围是(5)①
 的作用是将溶液中的
的作用是将溶液中的 、
、 转化为
转化为 、
、 沉淀,若过滤后“滤液1”中
沉淀,若过滤后“滤液1”中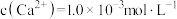 ,当除钙率达到90%时,溶液中
,当除钙率达到90%时,溶液中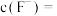
 。
。②下图为
 晶胞和
晶胞和 晶胞,两种晶胞中
晶胞,两种晶胞中 与
与 的配位数之比为
的配位数之比为
(6)
 萃取的反应原理为
萃取的反应原理为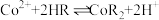 ,向有机萃取剂中加入
,向有机萃取剂中加入 能进行反萃取的原因是
能进行反萃取的原因是
您最近一年使用:0次
2023-05-05更新
|
162次组卷
|
2卷引用:江西省湖口中学2022-2023学年高二下学期5月期中考试化学试题
名校
解题方法
3 . 碳化钙(CaC2)是电石的主要成分,主要用于生产乙炔。其晶胞如图所示,已知晶胞参数a=39nm,c=64nm,晶胞中A原子的分数坐标为(0,0,0.406)。下列说法错误的是

| A.碳化钙晶体中含有离子键、σ键、π键 |
| B.B原子的分数坐标为(0,0.5,0.906) |
C.C 中两个碳原子中心距离约为7.3nm 中两个碳原子中心距离约为7.3nm |
D.与Ca2+距离最近的C 有6个 有6个 |
您最近一年使用:0次
2023-04-28更新
|
256次组卷
|
3卷引用:江西省安福中学2022-2023学年高二下学期5月期中考试化学试题
名校
4 . Ⅰ.下图为几种晶体或晶胞的示意图,请回答下列问题:___________ 。
(2)冰、金刚石、MgO、干冰4种晶体的熔点由高到低的顺序为___________ 。
(3)MgO晶胞中,每个MgO晶胞中平均占有___________ 个 ,由与
,由与 最近的
最近的 围成的空间几何构型为
围成的空间几何构型为___________ 。
(4)铜晶体中一个Cu周围紧邻的Cu有___________ 个, 晶体中
晶体中 的配位数是
的配位数是___________ 。
(5)冰的熔点远高于干冰,除 是
是___________ 分子外(填“极性”或“非极性”),还有一个重要的原因是___________ 。
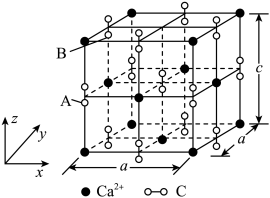
Ⅱ.以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。
___________ 个Sn,找出距离Cd(0,0,0)最近的Sn___________ (用分数坐标表示)。 晶体中与单个Sn键合的As有
晶体中与单个Sn键合的As有___________ 个。
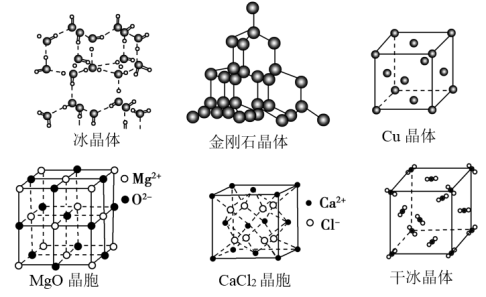
(2)冰、金刚石、MgO、干冰4种晶体的熔点由高到低的顺序为
(3)MgO晶胞中,每个MgO晶胞中平均占有
 ,由与
,由与 最近的
最近的 围成的空间几何构型为
围成的空间几何构型为(4)铜晶体中一个Cu周围紧邻的Cu有
 晶体中
晶体中 的配位数是
的配位数是(5)冰的熔点远高于干冰,除
 是
是Ⅱ.以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。
| 坐标原子 | x | y | z |
| Cd | 0 | 0 | 0 |
| Sn | 0 | 0 | 0.5 |
| As | 0.25 | 0.25 | 0.125 |
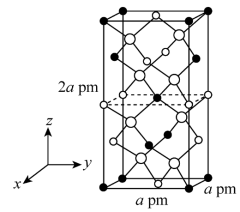
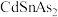 晶体中与单个Sn键合的As有
晶体中与单个Sn键合的As有
您最近一年使用:0次
2023-03-30更新
|
261次组卷
|
2卷引用:江西省南昌市第十九中学2022-2023学年高二下学期期中考试化学试卷
名校
解题方法
5 . 铂(Pt)的单质又称白金,是常用的催化剂和电极材料,顺二氨环丁羧酸铂(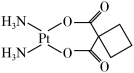 )又名卡铂,是一种低毒性抗癌药,遇光易分解。请回答下列问题:
)又名卡铂,是一种低毒性抗癌药,遇光易分解。请回答下列问题:
(1)用酒精把铂丝润湿点燃,酒精剧烈燃烧,使铂丝温度达到炽热程度,同时伴有很亮的光。产生上述现象可能的原因是___________ 。
(2)卡铂分子中非金属元素的电负性由大到小的顺序为___________ ,碳原子的杂化轨道类型有___________ 。
(3)卡铂静脉注射时需要注意的事项是___________ 。
(4)卡铂分子中存在的作用力有___________(填标号)。
(5)合成卡铂的中间体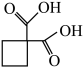 沸点比图1中化合物沸点低,原因是
沸点比图1中化合物沸点低,原因是___________ 。
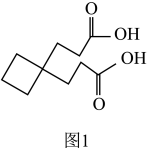
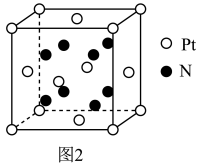
(6)超硬材料(仅次于金刚石)氮化铂的一种晶胞如图2所示,N的配位数是___________ 。
 )又名卡铂,是一种低毒性抗癌药,遇光易分解。请回答下列问题:
)又名卡铂,是一种低毒性抗癌药,遇光易分解。请回答下列问题:(1)用酒精把铂丝润湿点燃,酒精剧烈燃烧,使铂丝温度达到炽热程度,同时伴有很亮的光。产生上述现象可能的原因是
(2)卡铂分子中非金属元素的电负性由大到小的顺序为
(3)卡铂静脉注射时需要注意的事项是
(4)卡铂分子中存在的作用力有___________(填标号)。
| A.离子键 | B.配位键 | C.金属键 | D.非极性键 |
 沸点比图1中化合物沸点低,原因是
沸点比图1中化合物沸点低,原因是
(6)超硬材料(仅次于金刚石)氮化铂的一种晶胞如图2所示,N的配位数是

您最近一年使用:0次
名校
解题方法
6 . 过渡金属及其化合物在化工、医药、材料等领域有着广泛的应用。
(1)金属钛是一种新兴的结构材料,其硬度比金属镁和铝大的原因是_____ 。与钛同周期的过渡元素中,基态原子的成对电子数与钛相同的有_____ 种。
(2)在浓的TiCl3的盐酸中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3•6H2O的晶体,该晶体中两种配体的物质的量之比为2∶4,则由该配合离子组成的晶体化学式还可以写为_____ 。
(3)单晶衍射实验证实,配合物[Cr3O(CH3COO)6(H2O)3]Cl•8H2O的阳离子的结构如图甲所示:
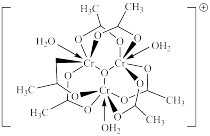
该配合物中中心离子的配位数是_____ ,铬元素的化合价为_____ 。
(4)某科研小组发现了在5K下呈现超导性的晶体,该晶体具有CoO2的层状结构(如图所示,小球表示Co原子,大球表示O原子)。下列用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是_____ (填字母)。
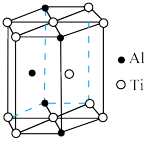
(5)“嫦娥五号”某核心部件主要成分为纳米钛铝合金,其结构单元如图所示(Al、Ti原子各有一个原子在结构单元内部),写出该合金的化学式:_____ 。
(1)金属钛是一种新兴的结构材料,其硬度比金属镁和铝大的原因是
(2)在浓的TiCl3的盐酸中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3•6H2O的晶体,该晶体中两种配体的物质的量之比为2∶4,则由该配合离子组成的晶体化学式还可以写为
(3)单晶衍射实验证实,配合物[Cr3O(CH3COO)6(H2O)3]Cl•8H2O的阳离子的结构如图甲所示:

该配合物中中心离子的配位数是
(4)某科研小组发现了在5K下呈现超导性的晶体,该晶体具有CoO2的层状结构(如图所示,小球表示Co原子,大球表示O原子)。下列用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是
A. | B. | C.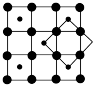 | D. |

您最近一年使用:0次
2022-12-16更新
|
199次组卷
|
3卷引用:江西省丰城中学2022-2023学年高二下学期开学考试化学试题
7 . 如图所示,铁有δ、γ、α三种晶体,三种晶体在不同温度下能发生转化。下列说法正确的是
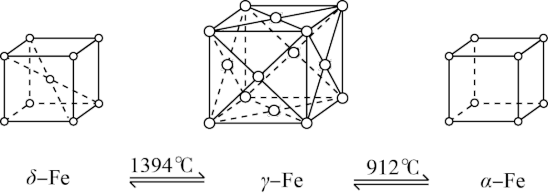

| A.γ-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个 |
| B.α-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个 |
| C.将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体类型相同 |
| D.若α-Fe晶胞边长为acm,γ-Fe晶胞边长为bcm,则两种晶体的密度比为b3∶a3 |
您最近一年使用:0次
2022-08-24更新
|
658次组卷
|
7卷引用:江西师范大学附属中学2023-2024学年高三上学期期中考试化学试题
名校
8 . 某镁铝尖晶石的晶胞由立方体M区和N区组成,结构如图。
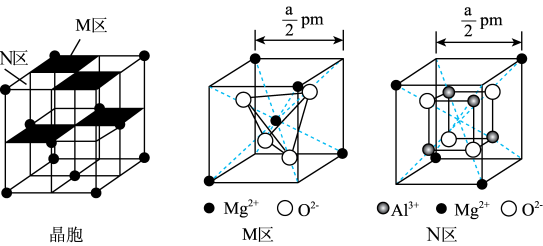
下列说法正确的是

下列说法正确的是
A.该晶胞的体积为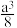 ×10-30cm3 ×10-30cm3 |
| B.与O2-最邻近的Al3+离子数为4 |
C.Mg2+和Mg2+之间的最短距离为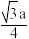 pm pm |
| D.该物质的化学式为MgAl2O4 |
您最近一年使用:0次
2022-07-11更新
|
239次组卷
|
3卷引用:江西省抚州市资溪县第一中学2022-2023学年高二下学期7月期末考试化学试题
9 . 一种从照相底片中回收单质银的方法如下:
步骤1:用Na2S2O3溶液浸泡照相底片,未曝光的AgBr转化成Na3[Ag(S2O3)2]而溶解。
步骤2:在步骤1所得溶液中加稍过量Na2S溶液,充分反应后过滤出黑色沉淀。
步骤3:将黑色沉淀在空气中灼烧,回收单质银。
下列说法正确的是
步骤1:用Na2S2O3溶液浸泡照相底片,未曝光的AgBr转化成Na3[Ag(S2O3)2]而溶解。
步骤2:在步骤1所得溶液中加稍过量Na2S溶液,充分反应后过滤出黑色沉淀。
步骤3:将黑色沉淀在空气中灼烧,回收单质银。
下列说法正确的是

| A.步骤1所得[Ag(S2O3)2]3-中Ag+提供孤电子对 |
B.步骤2所得滤液中大量存在的离子:Na+、Ag+、S2O 、S2- 、S2- |
| C.步骤3灼烧时可用足量NaOH溶液吸收尾气 |
| D.Na2S晶胞(如图所示)中每个Na+周围距离最近的S2-有8个 |
您最近一年使用:0次
2022-05-07更新
|
687次组卷
|
9卷引用:江西省抚州市第一中学2022-2023学年高二下学期第一次月考化学试题
江西省抚州市第一中学2022-2023学年高二下学期第一次月考化学试题江苏省南京市2022届高三下学期第二次(5月)模拟考试化学试题湖南省湘潭市第一中学2022届高三下学期第三次模拟考试化学试题江苏省十一校2021-2022学年高二下学期阶段联测化学试题江苏省泰州中学2021-2022学年高二下学期第二次质量检测化学试题江苏省华罗庚中学2023-2024学年高三夏令营学习能力测试化学试题江苏省镇江市丹阳市吕叔湘中学2023-2024学年高三上学期10月月考化学试题辽宁省沈阳市东北育才学校2023-2024学年高二下学期4月月考化学试题黑龙江省哈尔滨工业大学附属中学校2024届高三下学期五模化学试题
解题方法
10 . 磷酸亚铁锂(LiFePO4)电池是新能源汽车动力电池之一。
(1)写出基态Fe2+的核外电子排布式_______ ,请从原子结构角度解释Fe为何能呈+2价_______ ,与Fe同周期元素中,与Fe最外层电子数相等的副族元素有_______ 种。
(2)PO 的立体构型
的立体构型_______ ,由两种短周期同主族元素构成且与磷酸根互为等电子体的粒子为_______ ,P的杂化轨道与O的2p轨道形成_______ 。
(3)Li2O具有反萤石结构,为立方晶系晶体,其晶胞参数为apm。该晶胞中离子的分数坐标为:
氧离子:(0,0,0);( ,
, ,0);(
,0);( ,0,
,0, );(0,
);(0, ,
, );……
);……
锂离子:( ,
, ,
, );(
);( ,
, ,
, );(
);( ,
, ,
, );(
);( ,
, ,
, );……
);……
①在图上画出氧化锂晶胞沿x轴投影的俯视图_______ 。
②锂离子的配位数为_______ 。
③设NA为阿伏加德罗常数的值,氧化锂的晶体密度为_______ g·cm-3(列出计算表达式)。

(1)写出基态Fe2+的核外电子排布式
(2)PO
 的立体构型
的立体构型(3)Li2O具有反萤石结构,为立方晶系晶体,其晶胞参数为apm。该晶胞中离子的分数坐标为:
氧离子:(0,0,0);(
 ,
, ,0);(
,0);( ,0,
,0, );(0,
);(0, ,
, );……
);……锂离子:(
 ,
, ,
, );(
);( ,
, ,
, );(
);( ,
, ,
, );(
);( ,
, ,
, );……
);……①在图上画出氧化锂晶胞沿x轴投影的俯视图
②锂离子的配位数为
③设NA为阿伏加德罗常数的值,氧化锂的晶体密度为

您最近一年使用:0次



