名校
1 . 高纯二氧化硅可用来制造光导纤维。某稻壳灰的成分为
通过如下流程可由稻壳灰制备较纯净的二氧化硅。

请回答下列问题:
(1)根据氧化物的性质进行分类,稻壳灰中涉及的氧化物最多有____ 类,其中SiO2属于____ 。
(2)步骤①中涉及SiO2反应的离子方程式为____ 。
(3)滤渣A的成分有____ (填化学式)。
(4)步骤③反应的化学方程式为____ 。
(5)步骤②中的过量盐酸是否可以用过量CO2来替代:____ 。(用文字简要描述原因)
| 组分 | SiO2 | C | Na2O | K2O | Al2O3 | Fe2O3 |
| 质量分数 | 59.20 | 38.80 | 0.25 | 0.50 | 0.64 | 0.61 |
通过如下流程可由稻壳灰制备较纯净的二氧化硅。

请回答下列问题:
(1)根据氧化物的性质进行分类,稻壳灰中涉及的氧化物最多有
(2)步骤①中涉及SiO2反应的离子方程式为
(3)滤渣A的成分有
(4)步骤③反应的化学方程式为
(5)步骤②中的过量盐酸是否可以用过量CO2来替代:
您最近一年使用:0次
2 . 海洋是一个巨大的宝藏,海水淡化是重要的化学研究课题。
(1)蒸馏法获取淡水,历史悠久,操作简单,图中符合模拟蒸馏海水的装置是___ (填序号)。
a.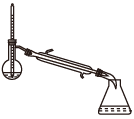 b.
b.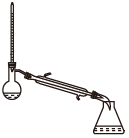
c.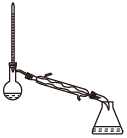 d.
d.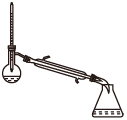
蒸馏前,应向烧瓶中加入沸石或碎瓷片,目的是___ ,冷凝水一般不采用“上进下出”,其原因是____ 。
(2)电渗析法的技术原理如图(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过):
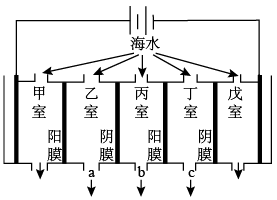
某地海水中主要含Na+、K+、Ca2+、Mg2+、Cl-、HCO 、SO
、SO 等,则淡化过程中,甲室的电极反应式为
等,则淡化过程中,甲室的电极反应式为___ ,产生水垢最多的是___ 室,淡水的出口为____ (填“a”、“b”或“c”)。
(3)离子交换法获取淡水模拟图如图:

经过阳离子交换树脂后水中阳离子数目____ (填“增加”“不变”或“减少”),阴离子交换树脂中发生了离子反应,其离子方程式为___ 。
(1)蒸馏法获取淡水,历史悠久,操作简单,图中符合模拟蒸馏海水的装置是
a.
 b.
b.
c.
 d.
d.
蒸馏前,应向烧瓶中加入沸石或碎瓷片,目的是
(2)电渗析法的技术原理如图(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过):

某地海水中主要含Na+、K+、Ca2+、Mg2+、Cl-、HCO
 、SO
、SO 等,则淡化过程中,甲室的电极反应式为
等,则淡化过程中,甲室的电极反应式为(3)离子交换法获取淡水模拟图如图:

经过阳离子交换树脂后水中阳离子数目
您最近一年使用:0次
2021-09-06更新
|
1252次组卷
|
5卷引用:安徽省A10联盟2022届高三上学期摸底考试化学试题
安徽省A10联盟2022届高三上学期摸底考试化学试题(已下线)3.3.1 粗盐提纯 从海水中提取溴-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)(已下线)专题35 物质的检验、分离和提纯(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练(已下线)第八章 化学与可持续发展(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)(已下线)第八章 化学与可持续发展【单元测试B卷】
解题方法
3 . I.除去括号中的杂质(填试剂)
(1)CuCl2溶液(FeCl3)_________________________ ;
(2)Fe2(SO4) 3溶液( FeSO4)_______________________ ;
(3)NaHCO3溶液(Na2CO3)___________________ ;
(4)CO2(HCl)_________________________ ;
Ⅱ写出下列反应的离子方程式
(5)二氧化硫使溴水褪色的原理_________________________________ ;
(6)将NaHCO3溶液与澄清石灰水等物质的量混合_________________________________ ;
(7)向NaAlO2溶液中通入过量CO2气体__________________________________________ ;
(8)FeBr2溶液和等物质的量的Cl2反应_________________________________________ 。
(1)CuCl2溶液(FeCl3)
(2)Fe2(SO4) 3溶液( FeSO4)
(3)NaHCO3溶液(Na2CO3)
(4)CO2(HCl)
Ⅱ写出下列反应的离子方程式
(5)二氧化硫使溴水褪色的原理
(6)将NaHCO3溶液与澄清石灰水等物质的量混合
(7)向NaAlO2溶液中通入过量CO2气体
(8)FeBr2溶液和等物质的量的Cl2反应
您最近一年使用:0次
4 . 我国“蛟龙号多次刷新“中国深度”,为我国深海矿物资源的开发奠定了坚实的基础。黄铜矿(主要成分为CuReS2)是海洋矿物中的一种,它是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。请回答下列问题:
(1)“蛟龙”号外壳用特殊的钛合金材料制成,它可以在7000米的深海中承受710吨的重量。下列说法正确的是___ 。
A.金属钛属于主族元素
B.钛合金强度不是很大
C.制备钛铝合金时可在空气中将两种金属熔化后混合而成
D.已知金属钛能与H2O反应,可用电解熔融二氧化钛冶炼金属钛
(2)利用黄铜矿冶炼铜的反应为8CuReS2+21O2 8Cu+4FeO+2Fe2O3+16SO2若CuReS2中Fe的化合价为+2,反应中被还原的元素是
8Cu+4FeO+2Fe2O3+16SO2若CuReS2中Fe的化合价为+2,反应中被还原的元素是___ 。(填元素符号),生成1molFe2O3时转移电子的物质的量为___ 。
(3)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,方法为①用过量稀盐酸浸取炉渣,过滤。②先将滤液氰化,再向其中加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煆烧得Fe2O3。据以上信息回答下列问题:
a.①中过滤的目的是___ ,过滤需要的仪器有___ 。
b.除去A13+的化学方程式为___ 。
c.②中将滤液氧化常常选用H2O2,其反应的离子方程式为___ 。
(4)将Cu放入0.1mol•L-1FeCl3溶液中,反应一定时间后取出Cu片,溶液中c(Fe3+):c(Fe2+)=2:3,则Cu2+与Fe3+的物质的量之比为___ 。
(1)“蛟龙”号外壳用特殊的钛合金材料制成,它可以在7000米的深海中承受710吨的重量。下列说法正确的是
A.金属钛属于主族元素
B.钛合金强度不是很大
C.制备钛铝合金时可在空气中将两种金属熔化后混合而成
D.已知金属钛能与H2O反应,可用电解熔融二氧化钛冶炼金属钛
(2)利用黄铜矿冶炼铜的反应为8CuReS2+21O2
 8Cu+4FeO+2Fe2O3+16SO2若CuReS2中Fe的化合价为+2,反应中被还原的元素是
8Cu+4FeO+2Fe2O3+16SO2若CuReS2中Fe的化合价为+2,反应中被还原的元素是(3)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,方法为①用过量稀盐酸浸取炉渣,过滤。②先将滤液氰化,再向其中加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煆烧得Fe2O3。据以上信息回答下列问题:
a.①中过滤的目的是
b.除去A13+的化学方程式为
c.②中将滤液氧化常常选用H2O2,其反应的离子方程式为
(4)将Cu放入0.1mol•L-1FeCl3溶液中,反应一定时间后取出Cu片,溶液中c(Fe3+):c(Fe2+)=2:3,则Cu2+与Fe3+的物质的量之比为
您最近一年使用:0次
名校
5 . 据统计,我国每年报废的手机超过1亿部,若不进行有效回收利用,会造成巨大的浪费和污染。某种手机电路板中含有以下金属:Sn、Pb、Fe、Cu、Au、Ag、Ni(镍,银白色)、Pd (钯,银白色)。如图是某工厂回收其中部分金属的流程图.(假设流程图中各反应均恰好完全反应.已知:2Cu+O2+2H2SO4 2CuSO4+2H2O)
2CuSO4+2H2O)

(1)步骤②中产生的气体是________ (写化学式)。
(2)滤渣2中含有的金属是________
(3)步骤⑤反应的化学方程式________ 。
(4)步骤⑥回收的纯净物B是________ (写化学式)•.
(5)金属Fe、Ni、Pd在溶液中的活动性由强到弱的顺序依次是________ 。
 2CuSO4+2H2O)
2CuSO4+2H2O)
(1)步骤②中产生的气体是
(2)滤渣2中含有的金属是
(3)步骤⑤反应的化学方程式
(4)步骤⑥回收的纯净物B是
(5)金属Fe、Ni、Pd在溶液中的活动性由强到弱的顺序依次是
您最近一年使用:0次
2017-08-31更新
|
123次组卷
|
2卷引用:安徽省合肥一中、马鞍山二中等六校教育研究会2017-2018学年高一上学期入学考试化学试题
名校
6 . 铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料.工业上提取氧化铝的工艺流程如下:
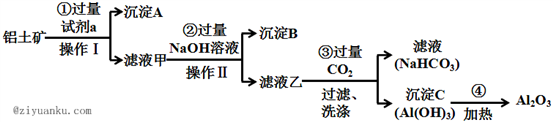
(1)沉淀A的成分是(填化学式)_________ 。
(2) 步骤②中加入过量NaOH溶液发生反应的离子方程式,除了H++OH﹣=H2O还有:
_____________________________ 、________________________________ ;
(3) 步骤③中通入过量CO2气体而不加入过量盐酸的理由是___________________ ;
(4) 准确称取8g铝土矿样品,加入一定量试剂a的溶液,使其中的Al2O3、Fe2O3恰好溶解;然后,向滤液中加入10mol·L-1的NaOH溶液,产生沉淀的质量与加入NaOH溶液的体积关系如图所示,则样品中Al2O3的百分含量为_________ 。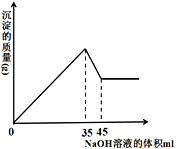

(1)沉淀A的成分是(填化学式)
(2) 步骤②中加入过量NaOH溶液发生反应的离子方程式,除了H++OH﹣=H2O还有:
(3) 步骤③中通入过量CO2气体而不加入过量盐酸的理由是
(4) 准确称取8g铝土矿样品,加入一定量试剂a的溶液,使其中的Al2O3、Fe2O3恰好溶解;然后,向滤液中加入10mol·L-1的NaOH溶液,产生沉淀的质量与加入NaOH溶液的体积关系如图所示,则样品中Al2O3的百分含量为

您最近一年使用:0次
2017-05-04更新
|
970次组卷
|
6卷引用:安徽省合肥市第三中学2017-2018学年高二分班考试化学试题
名校
解题方法
7 . Ⅰ.世界环保联盟即将全面禁止在自来水中加氯气(Cl2,黄绿色气体),推广采用光谱高效消毒剂二氧化氯,目前欧洲和我国主采用Kesting法[原料为氯酸钠(NaClO3)与盐酸]制取ClO2,该法的缺点是同时会产生Cl2。该法制ClO2的化学方程式为:
2 NaClO3+4 HCl=2 ClO2↑+Cl2↑+2 NaCl+2 H2O
(1)该反应中,氧化剂为_______________ ,氧化产物为___________________ 。
(2)若反应生成0.1mol Cl2,则转移的电子的物质的量为___________________ 。
(3)盐酸在反应中显示出来的性质是:(填写编号)________________________ 。
①还原性②还原性、酸性③氧化性④氧化性、酸性
(4)已知过氧化钙(CaO2)的性质与过氧化钠相似。若在一定体积的饱和石灰水中加入少量的过氧化钙,可以看到的现象_________________________________________ ,反应的化学方程式是_____________________________ 。
(5)为彻底除去KCl溶液中的混有的Ba(OH)2杂质,若只准加一种试剂,则这种试剂最好选择______ (写化学式),反应的离子方程式是_______________________ 。
2 NaClO3+4 HCl=2 ClO2↑+Cl2↑+2 NaCl+2 H2O
(1)该反应中,氧化剂为
(2)若反应生成0.1mol Cl2,则转移的电子的物质的量为
(3)盐酸在反应中显示出来的性质是:(填写编号)
①还原性②还原性、酸性③氧化性④氧化性、酸性
(4)已知过氧化钙(CaO2)的性质与过氧化钠相似。若在一定体积的饱和石灰水中加入少量的过氧化钙,可以看到的现象
(5)为彻底除去KCl溶液中的混有的Ba(OH)2杂质,若只准加一种试剂,则这种试剂最好选择
您最近一年使用:0次
2017-04-19更新
|
447次组卷
|
2卷引用:安徽省定远县第三中学2018-2019学年高一下学期开学检测化学试题
名校
8 . 醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:

相关离子生成氢氧化物的pH和相关物质的溶解性如下表:

(1)调节pH步骤中,溶液pH的调节范围是____________ 。
(2)滤渣1和滤渣3主要成分的化学式分别是____________ 、_____________ 。
(3)酸浸过程中,lmol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式_____________________________ 。
(4)沉镍前c(Ni2+)=2.0 mol· L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5mol·L-1],则需要加入Na2CO3固体的质量最少为______ g。(保留小数点后1位)

相关离子生成氢氧化物的pH和相关物质的溶解性如下表:

(1)调节pH步骤中,溶液pH的调节范围是
(2)滤渣1和滤渣3主要成分的化学式分别是
(3)酸浸过程中,lmol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式
(4)沉镍前c(Ni2+)=2.0 mol· L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5mol·L-1],则需要加入Na2CO3固体的质量最少为
您最近一年使用:0次
名校
9 . 某化学小组试利用废铝屑(含杂质铁)制备硫酸铝晶体,并对硫酸铝晶体进行热重分析,其主要实验流程如下:

(1)向溶液A中通入过量的CO2,发生反应的离子方程式为________________________ 。
(2) 操作II所包含的实验操作的名称依次为_________ 、冷却结晶、_____________ 、洗涤、干燥。
(3)若开始时称取的废铝屑的质量为5.00g,得到固体A的质量为0.95g,硫酸铝晶体的质量为49.95g(假设每一步的转化率均为100%),则所得硫酸铝晶体(含有结晶水)的化学式为_________________ 。
(4)取以上制得的硫酸铝晶体进行热重分析,其热分解主要分为三个阶段:第一阶段失重40.54%,第二阶段失重48.65%,第三阶段失重84.68%,以后不再失重。其热分解的曲线如下图所示。
已知:失重﹪= ×100%
×100%

则失重第一阶段的化学方程式为________________________ 。

(1)向溶液A中通入过量的CO2,发生反应的离子方程式为
(2) 操作II所包含的实验操作的名称依次为
(3)若开始时称取的废铝屑的质量为5.00g,得到固体A的质量为0.95g,硫酸铝晶体的质量为49.95g(假设每一步的转化率均为100%),则所得硫酸铝晶体(含有结晶水)的化学式为
(4)取以上制得的硫酸铝晶体进行热重分析,其热分解主要分为三个阶段:第一阶段失重40.54%,第二阶段失重48.65%,第三阶段失重84.68%,以后不再失重。其热分解的曲线如下图所示。
已知:失重﹪=
 ×100%
×100% 
则失重第一阶段的化学方程式为
您最近一年使用:0次
真题
名校
10 . 请回答氯碱工业的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______ (要求计算表达式和结果);
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________ (填序号);
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
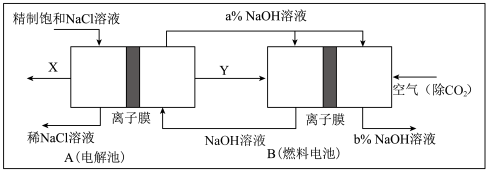
①图中X、Y分别是_____ 、_______ (填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________ ;
②分别写出燃料电池B中正极、负极上发生的电极反应正极:______ ;负极:_____ ;
③这样设计的主要节(电)能之处在于(写出2处)____________ 、____________ 。
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。

①图中X、Y分别是
②分别写出燃料电池B中正极、负极上发生的电极反应正极:
③这样设计的主要节(电)能之处在于(写出2处)
您最近一年使用:0次
2016-12-09更新
|
195次组卷
|
7卷引用:2020年安徽省全省教学质量检测统一考试(练习检测一)
2020年安徽省全省教学质量检测统一考试(练习检测一)2009年普通高等学校招生统一考试理综试题化学部分(宁夏卷)2009年高考真题汇编-卤 素(已下线)2010年陕西省五校高三第一次模拟考试理综化学试题(已下线)2011-2012学年河南省平顶山市高一上学期期末调研考试化学试卷2016-2017学年江苏省如东高级中学高一下学期第一次(3月)阶段检测化学试卷云南省普洱市景东彝族自治县第一中学2019-2020学年高二下学期期中考试理综化学试题



