名校
解题方法
1 . 碘化钾( )是实验室常用的化学试剂,用途广泛。一种利用含碘废液(碘的主要存在形式为
)是实验室常用的化学试剂,用途广泛。一种利用含碘废液(碘的主要存在形式为 和
和 )制备碘化钾的实验步骤如下:
)制备碘化钾的实验步骤如下:
步骤Ⅰ:取含碘废液,调节溶液 为
为 ,加入一定量
,加入一定量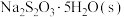 ,溶解,加热至30℃,加入稍过量
,溶解,加热至30℃,加入稍过量 粉末,搅拌,充分反应后,过滤得
粉末,搅拌,充分反应后,过滤得 沉淀;
沉淀;
步骤Ⅱ:在 圆底烧瓶中加入上述制备的
圆底烧瓶中加入上述制备的 沉淀,铁粉(过量),
沉淀,铁粉(过量),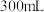 蒸馏水,搅拌,沸水浴加热1小时,冷却,抽滤。将滤液倒入
蒸馏水,搅拌,沸水浴加热1小时,冷却,抽滤。将滤液倒入 烧杯中,加入约
烧杯中,加入约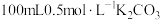 溶液,搅拌,煮沸,静置,过滤,得滤液A;
溶液,搅拌,煮沸,静置,过滤,得滤液A;
步骤Ⅲ:用氢碘酸调滤液A的 ,将滤液倒入___________(填仪器名称)中加热至___________(填现象),冷却,干燥,得到
,将滤液倒入___________(填仪器名称)中加热至___________(填现象),冷却,干燥,得到 晶体。
晶体。
回答下列问题:
(1)步骤Ⅰ中的控温方法为___________ , 与
与 转化为
转化为 的反应为①
的反应为① ,②
,② ,则反应②中氧化剂与还原剂的物质的量之比为
,则反应②中氧化剂与还原剂的物质的量之比为___________ 。
(2)步骤Ⅱ中铁粉转化为 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
(3)步骤Ⅲ中,仪器的名称是___________ ,现象是___________ 。
(4)产品中KI含量的测定
称取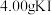 4.00样品,配成
4.00样品,配成 溶液,取
溶液,取 溶液于锥形瓶中,加入
溶液于锥形瓶中,加入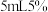 乙酸溶液及3滴曙红钠盐作指示剂,用
乙酸溶液及3滴曙红钠盐作指示剂,用 的
的 标准溶液避光滴定至沉淀呈红色(终点),平行滴定三次,消耗
标准溶液避光滴定至沉淀呈红色(终点),平行滴定三次,消耗 标准溶液分别为
标准溶液分别为 、
、 、
、 。
。
①用 标准溶液滴定时要避光的原因是
标准溶液滴定时要避光的原因是___________ ,在滴定时 溶液应盛放在
溶液应盛放在___________ (“酸式”或“碱式”)滴定管。
②样品中 的质量分数为
的质量分数为___________ 。
 )是实验室常用的化学试剂,用途广泛。一种利用含碘废液(碘的主要存在形式为
)是实验室常用的化学试剂,用途广泛。一种利用含碘废液(碘的主要存在形式为 和
和 )制备碘化钾的实验步骤如下:
)制备碘化钾的实验步骤如下:步骤Ⅰ:取含碘废液,调节溶液
 为
为 ,加入一定量
,加入一定量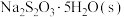 ,溶解,加热至30℃,加入稍过量
,溶解,加热至30℃,加入稍过量 粉末,搅拌,充分反应后,过滤得
粉末,搅拌,充分反应后,过滤得 沉淀;
沉淀;步骤Ⅱ:在
 圆底烧瓶中加入上述制备的
圆底烧瓶中加入上述制备的 沉淀,铁粉(过量),
沉淀,铁粉(过量),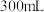 蒸馏水,搅拌,沸水浴加热1小时,冷却,抽滤。将滤液倒入
蒸馏水,搅拌,沸水浴加热1小时,冷却,抽滤。将滤液倒入 烧杯中,加入约
烧杯中,加入约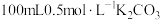 溶液,搅拌,煮沸,静置,过滤,得滤液A;
溶液,搅拌,煮沸,静置,过滤,得滤液A;步骤Ⅲ:用氢碘酸调滤液A的
 ,将滤液倒入___________(填仪器名称)中加热至___________(填现象),冷却,干燥,得到
,将滤液倒入___________(填仪器名称)中加热至___________(填现象),冷却,干燥,得到 晶体。
晶体。回答下列问题:
(1)步骤Ⅰ中的控温方法为
 与
与 转化为
转化为 的反应为①
的反应为① ,②
,② ,则反应②中氧化剂与还原剂的物质的量之比为
,则反应②中氧化剂与还原剂的物质的量之比为(2)步骤Ⅱ中铁粉转化为
 ,该反应的化学方程式为
,该反应的化学方程式为(3)步骤Ⅲ中,仪器的名称是
(4)产品中KI含量的测定
称取
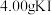 4.00样品,配成
4.00样品,配成 溶液,取
溶液,取 溶液于锥形瓶中,加入
溶液于锥形瓶中,加入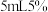 乙酸溶液及3滴曙红钠盐作指示剂,用
乙酸溶液及3滴曙红钠盐作指示剂,用 的
的 标准溶液避光滴定至沉淀呈红色(终点),平行滴定三次,消耗
标准溶液避光滴定至沉淀呈红色(终点),平行滴定三次,消耗 标准溶液分别为
标准溶液分别为 、
、 、
、 。
。①用
 标准溶液滴定时要避光的原因是
标准溶液滴定时要避光的原因是 溶液应盛放在
溶液应盛放在②样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
2024-01-02更新
|
210次组卷
|
2卷引用:江西省部分地区2023-2024学年高三上学期11月期中化学试题
2 . 自1943年侯德榜先生发明侯氏制碱法以来,我国纯碱工业高速发展。纯碱作为基本化工原料,被广泛应用于造纸、冶金、纺织、石油、国防、医药等领域,纯碱同时也是制造其他化学品的原料。可以用如图装置模拟侯氏制碱法,根据所学知识回答下列问题:

(1)仪器 的名称为
的名称为_____ ;仪器 的作用为
的作用为_____ 。
(2)装置 中生成
中生成 的反应的化学方程式为
的反应的化学方程式为_____ 。装置C中反应的离子方程式为_____ 。
(3)通过对粗盐(含有 杂质,杂质在实际生产中还容易造成设备堵塞)进行精制可制得饱和
杂质,杂质在实际生产中还容易造成设备堵塞)进行精制可制得饱和 溶液,涉及步骤如下:
溶液,涉及步骤如下:
①加入过量 溶液②加入过量
溶液②加入过量 溶液③加入足量盐酸④过滤⑤蒸发浓缩⑥加入过量
溶液③加入足量盐酸④过滤⑤蒸发浓缩⑥加入过量 溶液正确的操作顺序为_____(填标号)。
溶液正确的操作顺序为_____(填标号)。
(4)实验室模拟侯氏制碱法首先制得的是 ,然后将其在
,然后将其在_____ (填仪器名称)中,进一步制得纯碱。
(5)在实际生产中为了得到更多的产品,经常加入适量的食盐促进产品的析出,这会导致所得的 产品中混有少量
产品中混有少量 。为了确定加热后固体的组成,某化学兴趣小组准确称取
。为了确定加热后固体的组成,某化学兴趣小组准确称取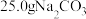 产品,配制成
产品,配制成 溶液,向所得溶液中加入
溶液,向所得溶液中加入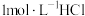 溶液,所得气体体积(已折算为标准状况)与加入盐酸体积的关系如图所示。
溶液,所得气体体积(已折算为标准状况)与加入盐酸体积的关系如图所示。
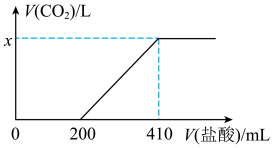
①由已知条件及图像分析, 产品中的杂质为
产品中的杂质为_____ (填化学式)。
②图中
_____ ;若每制得 该样品平均消耗标准状况下
该样品平均消耗标准状况下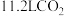 ,则在合成
,则在合成 时
时 的转化率为
的转化率为_____ (保留两位小数)%。

(1)仪器
 的名称为
的名称为 的作用为
的作用为(2)装置
 中生成
中生成 的反应的化学方程式为
的反应的化学方程式为(3)通过对粗盐(含有
 杂质,杂质在实际生产中还容易造成设备堵塞)进行精制可制得饱和
杂质,杂质在实际生产中还容易造成设备堵塞)进行精制可制得饱和 溶液,涉及步骤如下:
溶液,涉及步骤如下:①加入过量
 溶液②加入过量
溶液②加入过量 溶液③加入足量盐酸④过滤⑤蒸发浓缩⑥加入过量
溶液③加入足量盐酸④过滤⑤蒸发浓缩⑥加入过量 溶液正确的操作顺序为_____(填标号)。
溶液正确的操作顺序为_____(填标号)。| A.①④⑥④②④③⑤ | B.⑥①②④③⑤ |
| C.②⑥①④③⑤ | D.⑥①②③④⑤ |
(4)实验室模拟侯氏制碱法首先制得的是
 ,然后将其在
,然后将其在(5)在实际生产中为了得到更多的产品,经常加入适量的食盐促进产品的析出,这会导致所得的
 产品中混有少量
产品中混有少量 。为了确定加热后固体的组成,某化学兴趣小组准确称取
。为了确定加热后固体的组成,某化学兴趣小组准确称取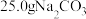 产品,配制成
产品,配制成 溶液,向所得溶液中加入
溶液,向所得溶液中加入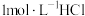 溶液,所得气体体积(已折算为标准状况)与加入盐酸体积的关系如图所示。
溶液,所得气体体积(已折算为标准状况)与加入盐酸体积的关系如图所示。
①由已知条件及图像分析,
 产品中的杂质为
产品中的杂质为②图中

 该样品平均消耗标准状况下
该样品平均消耗标准状况下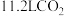 ,则在合成
,则在合成 时
时 的转化率为
的转化率为
您最近一年使用:0次
2023-11-22更新
|
444次组卷
|
2卷引用:江西省赣州市十八县23校2023-2024学年高二上学期期中联考化学试题
名校
解题方法
3 . NaCl溶液中混有Na2SO4、Na2CO3溶液和淀粉胶体,选择适当的试剂和方法从中提纯出NaCl晶体。相应的实验过程如图:

(1)写出上述实验过程中所用试剂(填化学式)和基本实验操作:试剂①___________ ;试剂③___________ ;操作①___________ ;操作④___________ 。
(2)区分淀粉胶体和NaCl溶液的方法是:___________ 。
(3)沉淀A为___________ 。
(4)加入试剂②产生沉淀的化学方程式:___________ 。

(1)写出上述实验过程中所用试剂(填化学式)和基本实验操作:试剂①
(2)区分淀粉胶体和NaCl溶液的方法是:
(3)沉淀A为
(4)加入试剂②产生沉淀的化学方程式:
您最近一年使用:0次
2023-10-31更新
|
41次组卷
|
2卷引用:江西省南昌市第一中学2023-2024学年高一上学期10月月考化学试题
名校
4 . Ⅰ.用一种试剂除去下列各物质中的杂质(括号内为杂质),并写出离子方程式。
(1) 溶液
溶液 ,试剂:
,试剂:___________ ,离子方程式:___________ 。
(2) 溶液(BaCl2),试剂:
溶液(BaCl2),试剂:___________ ,离子方程式:___________ 。
Ⅱ.造纸术是我国古代四大发明之一,在《天工开物》中记载了比较完善的造纸方法,造纸工业亦是国民经济十大支柱制造业之一,但造纸过程会消耗大量的资源并产生大量的污水,因此资源的回收利用以及污水的处理非常重要。
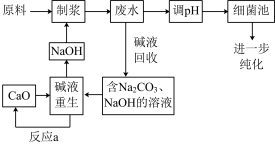
某造纸厂制浆及废水处理流程如下:
其中“制浆”是将木材、竹子等原料与烧碱共煮,制得纸浆,烧碱在制浆过程中转化为 。制浆废水中大部分碱性物质被回收利用,剩余的有机物在细菌池被微生物分解除去。
。制浆废水中大部分碱性物质被回收利用,剩余的有机物在细菌池被微生物分解除去。
(3)“碱液重生”过程分为以下两步反应,请补充反应ⅱ的离子方程式:
ⅰ.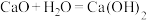 (石灰乳)
(石灰乳)
ⅱ.___________ 。
(4)反应a的化学方程式为___________ 。
(5)为防止细菌失活,需要先调 至中性,以下物质中,可以实现该目的的有___________
至中性,以下物质中,可以实现该目的的有___________
(6)上述过程中,循环使用的物质有___________ (写化学式)。
(1)
 溶液
溶液 ,试剂:
,试剂:(2)
 溶液(BaCl2),试剂:
溶液(BaCl2),试剂:Ⅱ.造纸术是我国古代四大发明之一,在《天工开物》中记载了比较完善的造纸方法,造纸工业亦是国民经济十大支柱制造业之一,但造纸过程会消耗大量的资源并产生大量的污水,因此资源的回收利用以及污水的处理非常重要。
某造纸厂制浆及废水处理流程如下:
其中“制浆”是将木材、竹子等原料与烧碱共煮,制得纸浆,烧碱在制浆过程中转化为
 。制浆废水中大部分碱性物质被回收利用,剩余的有机物在细菌池被微生物分解除去。
。制浆废水中大部分碱性物质被回收利用,剩余的有机物在细菌池被微生物分解除去。
(3)“碱液重生”过程分为以下两步反应,请补充反应ⅱ的离子方程式:
ⅰ.
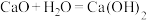 (石灰乳)
(石灰乳) ⅱ.
(4)反应a的化学方程式为
(5)为防止细菌失活,需要先调
 至中性,以下物质中,可以实现该目的的有___________
至中性,以下物质中,可以实现该目的的有___________A. | B. | C. | D. |
您最近一年使用:0次
名校
5 . 自古至今,铁及其化合物在人类生产生活中的使用发挥了巨大的作用。
(1)四大发明之一的司南是由天然磁石制成的,其主要成分是___________ (填化学式) 。
(2)由于Fe(OH)2易被氧化,所以制备时常隔绝空气制备,写出Fe(OH)2露置在空气中被氧化的化学方程式___________ 。
(3)某工业废渣wg (主要含二氧化硅、氧化铁、氧化镁)中提取氧化铁的工业流程如图(部分操作和条件略):
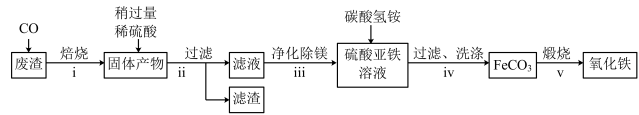
提示:二氧化硅不溶于稀硫酸。
①验证硫酸亚铁溶液中是否存在Fe3+的常用的试剂是___________ (填化学式)。
②步骤Ⅴ中,发生反应的化学方程式为___________ 。
③若提取过程中铁元素的损耗忽略不计,最终获得n g的氧化铁。则废渣中铁元素的质量分数为___________ 。
(1)四大发明之一的司南是由天然磁石制成的,其主要成分是
(2)由于Fe(OH)2易被氧化,所以制备时常隔绝空气制备,写出Fe(OH)2露置在空气中被氧化的化学方程式
(3)某工业废渣wg (主要含二氧化硅、氧化铁、氧化镁)中提取氧化铁的工业流程如图(部分操作和条件略):

提示:二氧化硅不溶于稀硫酸。
①验证硫酸亚铁溶液中是否存在Fe3+的常用的试剂是
②步骤Ⅴ中,发生反应的化学方程式为
③若提取过程中铁元素的损耗忽略不计,最终获得n g的氧化铁。则废渣中铁元素的质量分数为
您最近一年使用:0次
2023-07-10更新
|
306次组卷
|
2卷引用:江西省宁冈中学2023-2024学年高二上学期开学考试化学试题
名校
解题方法
6 . 硅是带来人类文明的重要元素之一,硅与二氧化硅广泛应用于通讯行业。
(1)工业上常用石英砂与焦炭在高温下反应制粗硅,其化学方程式是___________ 。
(2)工业上可以通过如图所示的流程制取纯硅:___________ 。
②整个过程中必须严格控制无氧。在有氧环境下,除了有不安全因素外还可能使产品中混有杂质___________ 。整个过程中可以循环利用的物质是___________ (填化学式)。
(3)如图是用海边的石英砂(含氯化钠、氧化铝等杂质)制备二氧化硅粗产品的工艺流程。___________ 。
②将洗净的石英砂研磨成粉末,目的是___________ 。
③在以上流程中,能否将盐酸改为NaOH溶液,请说明理由___________ 。
(1)工业上常用石英砂与焦炭在高温下反应制粗硅,其化学方程式是
(2)工业上可以通过如图所示的流程制取纯硅:
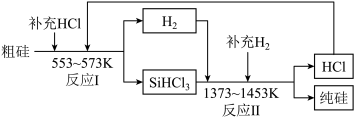
②整个过程中必须严格控制无氧。在有氧环境下,除了有不安全因素外还可能使产品中混有杂质
(3)如图是用海边的石英砂(含氯化钠、氧化铝等杂质)制备二氧化硅粗产品的工艺流程。
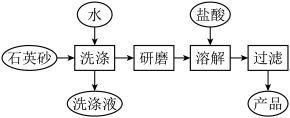
②将洗净的石英砂研磨成粉末,目的是
③在以上流程中,能否将盐酸改为NaOH溶液,请说明理由
您最近一年使用:0次
2023-07-06更新
|
199次组卷
|
4卷引用:江西省萍乡市安源中学2022-2023学年高一下学期期中考试化学试题
名校
7 . I.如图是利用电化学装置将SO2转化为重要的化工原料H2SO4的原理示意图。
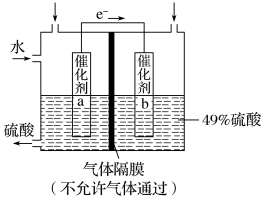
请回答下列问题:
(1)该装置将_______ 能转化为______ 能。
(2)催化剂b表面O2发生_______ 反应,其附近溶液酸性______ (填“增强”、“不变”或“减弱”)。
(3)催化剂a表面的电极反应式:_______ 。
II.某废料铁泥主要成分是Fe2O3、FeO和Fe,其他杂质不与硫酸反应。实验室用该废料提取Fe2O3,设计实验流程如图:

(4)步骤(I)充分反应后进行的实验操作名称是______ 。
(5)步骤(II)中加入H2O2溶液后需要适当加热但温度不能过高,原因是______ 。
(6)为了检验溶液B中是否有亚铁离子剩余,有同学提出只需要取少量溶液B于试管中并向其中滴加氢氧化钠溶液,然后观察现象即可证明。请你判断该同学的方法是否可行并说出理由______ 。
(7)步骤(III)中将NaOH溶液换成氨气也可以得到Fe(OH)3沉淀,反应的离子方程式为______ 。

请回答下列问题:
(1)该装置将
(2)催化剂b表面O2发生
(3)催化剂a表面的电极反应式:
II.某废料铁泥主要成分是Fe2O3、FeO和Fe,其他杂质不与硫酸反应。实验室用该废料提取Fe2O3,设计实验流程如图:

(4)步骤(I)充分反应后进行的实验操作名称是
(5)步骤(II)中加入H2O2溶液后需要适当加热但温度不能过高,原因是
(6)为了检验溶液B中是否有亚铁离子剩余,有同学提出只需要取少量溶液B于试管中并向其中滴加氢氧化钠溶液,然后观察现象即可证明。请你判断该同学的方法是否可行并说出理由
(7)步骤(III)中将NaOH溶液换成氨气也可以得到Fe(OH)3沉淀,反应的离子方程式为
您最近一年使用:0次
2023-05-19更新
|
711次组卷
|
2卷引用:江西省宜春市高安市灰埠中学2022-2023学年高一下学期7月期末化学试题
解题方法
8 . 海洋化学资源的综合利用对人类的发展意义重大。
(1)经海水晒盐获得的粗盐水中含有Ca2+、Mg2+、SO 三种杂质离子,为了除去上述三种杂质离子,需加入四种试剂:①Na2CO3、②BaCl2、③NaOH、④稀盐酸。①四种试剂的加入次序正确的是
三种杂质离子,为了除去上述三种杂质离子,需加入四种试剂:①Na2CO3、②BaCl2、③NaOH、④稀盐酸。①四种试剂的加入次序正确的是___________ (填字母)。
a.④①②③ b.②①③④ c.③①②④ d.②③①④
②加入稀盐酸的目的是___________ (用离子方程式表示)。
(2)利用氧化还原反应原理,将Cl2通入提取食盐后的母液中,将溶液中的溴离子转化为溴单质,再鼓入热空气,使溴单质从溶液中分离出来。
①鼓入热空气将溴单质从溶液中分离出来的原理是___________ 。
②将溴离子转化为溴单质的离子反应方程式为___________ 。
(1)经海水晒盐获得的粗盐水中含有Ca2+、Mg2+、SO
 三种杂质离子,为了除去上述三种杂质离子,需加入四种试剂:①Na2CO3、②BaCl2、③NaOH、④稀盐酸。①四种试剂的加入次序正确的是
三种杂质离子,为了除去上述三种杂质离子,需加入四种试剂:①Na2CO3、②BaCl2、③NaOH、④稀盐酸。①四种试剂的加入次序正确的是a.④①②③ b.②①③④ c.③①②④ d.②③①④
②加入稀盐酸的目的是
(2)利用氧化还原反应原理,将Cl2通入提取食盐后的母液中,将溶液中的溴离子转化为溴单质,再鼓入热空气,使溴单质从溶液中分离出来。
①鼓入热空气将溴单质从溶液中分离出来的原理是
②将溴离子转化为溴单质的离子反应方程式为
您最近一年使用:0次
2023-04-30更新
|
271次组卷
|
2卷引用:江西省九江市彭泽县第二高级中学2022-2023学年高一下学期7月期末化学试题
名校
解题方法
9 . 钠长石是地表岩石最重要的造岩矿物,也是工业生产的重要原料。钠长石富含钠元素,同时还有少量的钙和铁元素,铁元素在矿石中既有+2 价 Fe(II)也有+3 价 Fe(III)。钠长石的化学式为:NaxFe4CaO7,以该矿石为原料制备金属钠的工艺流程如下:
请回答下列问题:
(1)“粉碎研磨”的作用是_______ 。
(2)写出 NaClO 与溶液 A 反应的离子方程式_______ 。下面物质中可以替换 NaClO 的是_______ (填字母)。
A.H2O2 B.NaCl C.KMnO4 D.Na2O2
(3)“难溶物 1”的成份是_______ 。(写化学式)
(4)写出制备金属钠的反应方程式_______ 。
(5)溶液 C 中有 Na+还有少量 Ca2+,可用试剂_______ (写化学式)除去 Ca2+。
(6)钠长石中铁元素的化合价有+2 和+3,且 Fe(II)和 Fe(III)的个数比为 3:1,则钠长石的化学式中 x=_______ 。
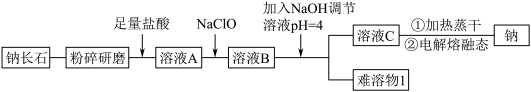
| Ca2+ | Fe2+ | Fe3+ | |
| Mn+完全沉淀时的pH | 12.0 | 5.8 | 4.0 |
(1)“粉碎研磨”的作用是
(2)写出 NaClO 与溶液 A 反应的离子方程式
A.H2O2 B.NaCl C.KMnO4 D.Na2O2
(3)“难溶物 1”的成份是
(4)写出制备金属钠的反应方程式
(5)溶液 C 中有 Na+还有少量 Ca2+,可用试剂
(6)钠长石中铁元素的化合价有+2 和+3,且 Fe(II)和 Fe(III)的个数比为 3:1,则钠长石的化学式中 x=
您最近一年使用:0次
2022-12-21更新
|
524次组卷
|
6卷引用:江西省南昌市第三中学2023-2024学年高一上学期期中考试化学试题
解题方法
10 . 粗盐提纯后的精盐含有氯化钙、氯化镁、硫酸钠等可溶性杂质,常通过加入化学试剂使其转化为沉淀而除去。
(1)除去氯化钙加入的试剂是_______ ,反应的化学方程式是_______ 。
(2)除去氯化镁加入的试剂是_______ ,反应的化学方程式是_______ 。
(3)除去硫酸钠加入的试剂是_______ ,反应的化学方程式是_______ 。
(1)除去氯化钙加入的试剂是
(2)除去氯化镁加入的试剂是
(3)除去硫酸钠加入的试剂是
您最近一年使用:0次
2021-06-05更新
|
266次组卷
|
2卷引用:江西省宜春市百树学校2023-2024学年高一上学期第一次月考化学试卷



