1 .  是一种高效、安全消毒剂。目前已开发出多种电解法制取
是一种高效、安全消毒剂。目前已开发出多种电解法制取 气体的新工艺,方法一:如图乙,电解精制饱和食盐水制取
气体的新工艺,方法一:如图乙,电解精制饱和食盐水制取 ;方法二:如图丙,电极上通入
;方法二:如图丙,电极上通入 
 酸性溶液中电解
酸性溶液中电解 制取
制取 。某浓差电池的示意图如图丁,该电池既能提供电能,又能产生产生多种化学品。
。某浓差电池的示意图如图丁,该电池既能提供电能,又能产生产生多种化学品。
(1)图甲中,操作Ⅰ、Ⅱ为_______ ,试剂 Ⅱ为_______ (填化学式)
(2)图乙中,电解精制饱和食盐水产生 的电极反应式为
的电极反应式为________ ;电解一段时间,若有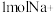 通过离子交换膜,在电极A上产生的气体体积(标准状况)为
通过离子交换膜,在电极A上产生的气体体积(标准状况)为______ L。
(3)图丙中,阴极电极反应式为_______ ;电解一段时间后,阴极区(溶液体积变化忽略不计 溶液的 pH
溶液的 pH______ (填“变大”、“变小”、“不变”)
(4)若以图丁所示电池作图乙的电源,则 a端与______ 相连(填 “e”或 “f”),图乙中阳极的另一产物可不断补充到图丁的正极区,该物质是_______ (填化学式)
(5)工业生产中,还可以用酸性 溶液还原
溶液还原 制得
制得 ,则每生成0.2mol
,则每生成0.2mol ,转移电子的数目为
,转移电子的数目为___________ 。
 是一种高效、安全消毒剂。目前已开发出多种电解法制取
是一种高效、安全消毒剂。目前已开发出多种电解法制取 气体的新工艺,方法一:如图乙,电解精制饱和食盐水制取
气体的新工艺,方法一:如图乙,电解精制饱和食盐水制取 ;方法二:如图丙,电极上通入
;方法二:如图丙,电极上通入 
 酸性溶液中电解
酸性溶液中电解 制取
制取 。某浓差电池的示意图如图丁,该电池既能提供电能,又能产生产生多种化学品。
。某浓差电池的示意图如图丁,该电池既能提供电能,又能产生产生多种化学品。
(1)图甲中,操作Ⅰ、Ⅱ为
(2)图乙中,电解精制饱和食盐水产生
 的电极反应式为
的电极反应式为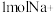 通过离子交换膜,在电极A上产生的气体体积(标准状况)为
通过离子交换膜,在电极A上产生的气体体积(标准状况)为(3)图丙中,阴极电极反应式为
 溶液的 pH
溶液的 pH(4)若以图丁所示电池作图乙的电源,则 a端与
(5)工业生产中,还可以用酸性
 溶液还原
溶液还原 制得
制得 ,则每生成0.2mol
,则每生成0.2mol ,转移电子的数目为
,转移电子的数目为
您最近一年使用:0次
2024-01-22更新
|
160次组卷
|
2卷引用:四川省达州市2023-2024学年高二上学期期末监测化学试题
2 . Ⅰ.现有下列物质:①蔗糖、②Na2CO3溶液、③稀硫酸、④CO2、⑤CuSO4·5H2O固体、⑥石墨棒、⑦含泥沙的氯化钠溶液、⑧淀粉溶液
(1)属于电解质的是___________ (填序号,下同),属于非电解质的是___________ 。
(2)除去⑦中的泥沙杂质的实验操作方法是___________ 。
(3)将气体④通入②会发生化学反应,其化学方程式为___________ 。
Ⅱ.央视《每周质量报告》曝光了一些明胶企业将皮革废料熬制成工业明胶,出售给某些制药企业,最终变成药用胶囊。由工业明胶制成的胶囊往往含有超标的重金属铬,会对人体造成伤害。明胶是水溶性蛋白质混合物,溶于水形成胶体。
(4)已知Fe(CrO2)2中铬元素是+3价,则其中铁元素是___________ 价。Fe(CrO2)2属于___________ (填“酸”、“碱”、“盐”或“氧化物”)。
(5)明胶的水溶液和K2SO4溶液共同具备的性质是___________(填序号)。
(1)属于电解质的是
(2)除去⑦中的泥沙杂质的实验操作方法是
(3)将气体④通入②会发生化学反应,其化学方程式为
Ⅱ.央视《每周质量报告》曝光了一些明胶企业将皮革废料熬制成工业明胶,出售给某些制药企业,最终变成药用胶囊。由工业明胶制成的胶囊往往含有超标的重金属铬,会对人体造成伤害。明胶是水溶性蛋白质混合物,溶于水形成胶体。
(4)已知Fe(CrO2)2中铬元素是+3价,则其中铁元素是
(5)明胶的水溶液和K2SO4溶液共同具备的性质是___________(填序号)。
| A.都不稳定,密封放置会产生沉淀 | B.分散质粒子可通过滤纸 |
| C.分散质粒子可通过半透膜 | D.二者均有丁达尔效应 |
您最近一年使用:0次
名校
3 . 必修Ⅰ第二章带领我们认识了海水中重要元素-钠和氯,同时引入了一个新的物理量——物质的量,帮助我们建立宏观物质和微观微粒之间的联系。以下是小明和李华两位同学学习第二章后相互赠送的化学礼物——亲自命制的习题。作为他们共同的好朋友,请你也收下并完成这两份礼物,陪伴他们共同成长与进步。
Ⅰ.小明送出的礼物(节选):
(1)钠长期置于空气中,最后形成的物质是_______ ,该物质与足量盐酸反应的离子方程式为_______ ,为除去该反应生成的气体中混有的HCl,应选用试剂_______ 。
(2)加热法除去碳酸钠固体中少量的碳酸氢钠反应化学方程式为_______ 。
Ⅱ.李华送出的礼物(节选):
(3)除去氯气中的HCl选用试剂_______ 。
(4)漂白粉的制备化学方程式_______ 。
(5)56g Fe与足量的氯气完全反应转移_______ 个电子数。
(6)相同质量的CO和CO2所含的氧原子个数之比是_______ 。
Ⅰ.小明送出的礼物(节选):
(1)钠长期置于空气中,最后形成的物质是
(2)加热法除去碳酸钠固体中少量的碳酸氢钠反应化学方程式为
Ⅱ.李华送出的礼物(节选):
(3)除去氯气中的HCl选用试剂
(4)漂白粉的制备化学方程式
(5)56g Fe与足量的氯气完全反应转移
(6)相同质量的CO和CO2所含的氧原子个数之比是
您最近一年使用:0次
名校
4 . 按要求回答下列问题
(1)请从下列试剂中选择合适的完成指定转化(试剂可以重复选择):
试剂:NaCl溶液、Cu、AgNO3、NH3、CO2
i.请写出一个置换反应的化学方程式___________ 。
ii.请写出一个生成白色沉淀的离子方程式___________ 。
(2)以石灰渣[主要成分Ca(OH)2,其他杂质不与Cl2反应]为原料生产氯酸钾的流程如下
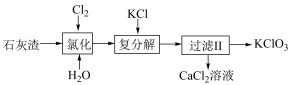
i.氯化反应的温度为60℃,产物中的含氯化合物是CaCl2和Ca(ClO3)2,写出氯化反应的化学方程式___________ 。
ii.根据流程中的复分解反应,推断溶解度:Ca(ClO3)2___________ KClO3(填“>”或“<”)。
(1)请从下列试剂中选择合适的完成指定转化(试剂可以重复选择):
试剂:NaCl溶液、Cu、AgNO3、NH3、CO2
i.请写出一个置换反应的化学方程式
ii.请写出一个生成白色沉淀的离子方程式
(2)以石灰渣[主要成分Ca(OH)2,其他杂质不与Cl2反应]为原料生产氯酸钾的流程如下

i.氯化反应的温度为60℃,产物中的含氯化合物是CaCl2和Ca(ClO3)2,写出氯化反应的化学方程式
ii.根据流程中的复分解反应,推断溶解度:Ca(ClO3)2
您最近一年使用:0次
名校
5 . I.某校化学一兴趣小组在社会实践活动中,考察了当地某工厂的废水(无色)处理流程,并取该厂未经处理的废水样品进行实验分析。

已知: 固体难溶于硝酸。
固体难溶于硝酸。
(1)取少量废水,向其中滴入紫色石蕊试液,溶液变红,该废水呈_______ (填“酸性”或“碱性”),说明废水中含有较大量的_______ (填离子符号),建议该厂用_______ (填化学式)处理废水。
(2)另取少量废水,滴加适量 溶液,有白色沉淀产生,说明该废水中一定含有的离子是
溶液,有白色沉淀产生,说明该废水中一定含有的离子是_______ ,其离子反应方程式为_______ 。
(3)已知该工厂废水中除含有以上离子外,还含有较多的 。该兴趣小组另取少量废水进行如图所示实验。开始时,试管中无明显现象,原因是
。该兴趣小组另取少量废水进行如图所示实验。开始时,试管中无明显现象,原因是_______ ;随试剂的滴加,试管中出现的现象是_______ ,该反应的离子方程式为_______ 。
Ⅱ.另一兴趣小组在实验室中尝试制备氢氧化铁胶体并探究它的性质。
(4)判断胶体的制备是否成功,可利用胶体的_______
(5)向 胶体中逐滴加入了稀
胶体中逐滴加入了稀 溶液,结果出现了一系列变化:
溶液,结果出现了一系列变化:
①先出现红褐色沉淀,原因是_______ 。
②随后沉淀溶解,此反应的离子方程式是_______ 。

已知:
 固体难溶于硝酸。
固体难溶于硝酸。(1)取少量废水,向其中滴入紫色石蕊试液,溶液变红,该废水呈
(2)另取少量废水,滴加适量
 溶液,有白色沉淀产生,说明该废水中一定含有的离子是
溶液,有白色沉淀产生,说明该废水中一定含有的离子是(3)已知该工厂废水中除含有以上离子外,还含有较多的
 。该兴趣小组另取少量废水进行如图所示实验。开始时,试管中无明显现象,原因是
。该兴趣小组另取少量废水进行如图所示实验。开始时,试管中无明显现象,原因是Ⅱ.另一兴趣小组在实验室中尝试制备氢氧化铁胶体并探究它的性质。
(4)判断胶体的制备是否成功,可利用胶体的
(5)向
 胶体中逐滴加入了稀
胶体中逐滴加入了稀 溶液,结果出现了一系列变化:
溶液,结果出现了一系列变化:①先出现红褐色沉淀,原因是
②随后沉淀溶解,此反应的离子方程式是
您最近一年使用:0次
名校
解题方法
6 . 回答下列问题:
(1)正常雨水的pH约为___________ ;
(2)常在医疗上用作消化系统X射线检查的内服药剂“钡餐”的化学式为___________ ;
(3)在粗盐的提纯实验中,欲除去其中的杂质Mg2+,应加入的试剂为___________ (填化学式);
(4)新型碳化硅(SiC)陶瓷可用作耐高温结构材料和半导体材料,其中的碳原子和硅原子通过___________ (填“离子”或“共价”)键连接;
(5)根据元素周期律的知识,请写出新型陶瓷氮化硅的化学式___________ 。
(1)正常雨水的pH约为
(2)常在医疗上用作消化系统X射线检查的内服药剂“钡餐”的化学式为
(3)在粗盐的提纯实验中,欲除去其中的杂质Mg2+,应加入的试剂为
(4)新型碳化硅(SiC)陶瓷可用作耐高温结构材料和半导体材料,其中的碳原子和硅原子通过
(5)根据元素周期律的知识,请写出新型陶瓷氮化硅的化学式
您最近一年使用:0次
解题方法
7 . Ⅰ.金属元素的原子结构决定了金属元素的性质、在自然界中的存在形式及冶炼方法。
(1)金属在自然界中大多以化合物的形式存在,在这些金属化合物中,金属元素都显___________ (填“正”或“负”)化合价。
(2)金属的冶炼方法可以分为:A.焦炭法;B.热分解法;C.活泼金属置换法;D.电解法。
请从上述四种方法中选择相应的序号填入表中空格:
(3)写出Al与Cr2O3反应的化学方程式:___________ 。
Ⅱ.以下为工业从海水中提取液溴的流程图:
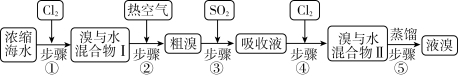
已知:溴的沸点为59℃,微溶于水,有毒性。请回答:
(4)用热空气能将溴单质吹出的原因是___________ 。
(5)从“溴与水混合物Ⅰ”到“溴与水混合物Ⅱ”的目的是___________ 。
(1)金属在自然界中大多以化合物的形式存在,在这些金属化合物中,金属元素都显
(2)金属的冶炼方法可以分为:A.焦炭法;B.热分解法;C.活泼金属置换法;D.电解法。
请从上述四种方法中选择相应的序号填入表中空格:
| 高炉炼铁 | 湿法炼铜 | 铝热法炼铬 | 工业上冶炼钾 |
| ① | ② | ③ | ④ |
Ⅱ.以下为工业从海水中提取液溴的流程图:

已知:溴的沸点为59℃,微溶于水,有毒性。请回答:
(4)用热空气能将溴单质吹出的原因是
(5)从“溴与水混合物Ⅰ”到“溴与水混合物Ⅱ”的目的是
您最近一年使用:0次
8 . 我国科学家侯德榜发明了联合制碱法。联合以氯化钠、氨及二氧化碳为原料,同时生产纯碱和氯化铵两种产品,又称“侯氏制碱法”,对世界制碱工业做出了卓越贡献。下列是制备纯碱的工艺流程,回答下列问题。
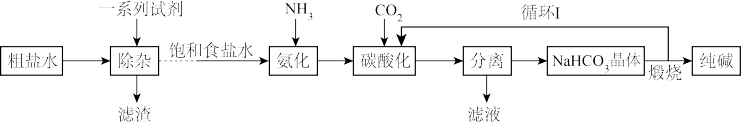
(1) 的电子式为
的电子式为_______ ;氯化铵的化学式为_______ ,其常见用途有_______ (写一条)。
(2)粗盐水中含大量 、
、 ,“除杂”时依次加入过量的
,“除杂”时依次加入过量的 、
、 、
、 提纯
提纯 。用离子方程式说明加入
。用离子方程式说明加入 的目的
的目的_______ 。
(3)若在实验室中进行“分离”操作,用到的玻璃仪器有_______ 。
(4)循环Ⅰ中参与循环的物质是_______ ;分析上述流程,所涉及的反应属于_______ (氧化还原反应或非氧化还原反应)。
(5)制得的纯碱可能含少量 ,简述检验杂质的方法
,简述检验杂质的方法_______ 。
(6) 有广泛的用途。通电的条件下可由饱和食盐水制备烧碱
有广泛的用途。通电的条件下可由饱和食盐水制备烧碱 和氯气,同时还产生氢气,写出该反应的化学方程式
和氯气,同时还产生氢气,写出该反应的化学方程式_______ 。

(1)
 的电子式为
的电子式为(2)粗盐水中含大量
 、
、 ,“除杂”时依次加入过量的
,“除杂”时依次加入过量的 、
、 、
、 提纯
提纯 。用离子方程式说明加入
。用离子方程式说明加入 的目的
的目的(3)若在实验室中进行“分离”操作,用到的玻璃仪器有
(4)循环Ⅰ中参与循环的物质是
(5)制得的纯碱可能含少量
 ,简述检验杂质的方法
,简述检验杂质的方法(6)
 有广泛的用途。通电的条件下可由饱和食盐水制备烧碱
有广泛的用途。通电的条件下可由饱和食盐水制备烧碱 和氯气,同时还产生氢气,写出该反应的化学方程式
和氯气,同时还产生氢气,写出该反应的化学方程式
您最近一年使用:0次
解题方法
9 . 纯碱是一种重要的工业原料,可用于生活洗涤、食品加工和工业制玻璃等,可用侯氏制碱法制备,其流程如下(部分物质已略去):
已知:通常状况下,1体积水大约溶解1体积 或700体积
或700体积 ;
; 溶于水后,溶液显碱性。
溶于水后,溶液显碱性。

(1)为除去食盐水中的 、
、 、
、 ,可先
,可先_______ (填选项字母),过滤后加适量盐酸,再蒸发浓缩得饱和溶液。
A.加NaOH溶液,后加 溶液,再加钡试剂溶液
溶液,再加钡试剂溶液
B.加NaOH溶液,后加钡试剂溶液,再加 溶液
溶液
C.加钡试剂溶液,后加NaOH溶液,再加 溶液
溶液
除去 时,该钡试剂最好为
时,该钡试剂最好为_______ 。
A. B.
B. C.
C.
(2)向饱和食盐水中先通入的气体为_______ ,分析其原因_______ 。
(3)过程①的实验操作为_______ 、洗涤、干燥,检验所得小苏打中不含 的方法为
的方法为_______ 。
(4)过程②的化学方程式为_______ 。
(5)该制备可得到的副产品为_______ 。
已知:通常状况下,1体积水大约溶解1体积
 或700体积
或700体积 ;
; 溶于水后,溶液显碱性。
溶于水后,溶液显碱性。
(1)为除去食盐水中的
 、
、 、
、 ,可先
,可先A.加NaOH溶液,后加
 溶液,再加钡试剂溶液
溶液,再加钡试剂溶液B.加NaOH溶液,后加钡试剂溶液,再加
 溶液
溶液C.加钡试剂溶液,后加NaOH溶液,再加
 溶液
溶液除去
 时,该钡试剂最好为
时,该钡试剂最好为A.
 B.
B. C.
C.
(2)向饱和食盐水中先通入的气体为
(3)过程①的实验操作为
 的方法为
的方法为(4)过程②的化学方程式为
(5)该制备可得到的副产品为
您最近一年使用:0次
名校
解题方法
10 . 铁是人类较早使用的金属之一,完成下列问题。
(1)下列铁的化合物中,可以由单质直接化合得到的是___________(用字母代号填)。
(2)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,与水反应可生成透明的红褐色胶体。
上述反应的离子方程式如下,请将方程式补写完整_______ 。
___________ +_______H2O=_______Fe(OH)3(胶体)+________O2↑+_________OH-
+_______H2O=_______Fe(OH)3(胶体)+________O2↑+_________OH-
(3)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
①写出FeCl3溶液与金属铜发生反应的化学方程式___________ 。
②某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,采用下列步骤:

请写出上述过程中滤渣③中所含成分的化学式_________ ,物质⑥的化学式___________ 。
(4)把1.1g铁、铝混合物溶于200ml5mol/L盐酸中,反应后盐酸的浓度变为4.6mol/L(溶液体积变化忽略不计)。求①反应中消耗HCl的物质的量________________ 。
②该混合物中铝的物质的量________________ ,铁的物质的量 _________ 。
(1)下列铁的化合物中,可以由单质直接化合得到的是___________(用字母代号填)。
| A.Fe(OH)2 | B.FeCl3 | C.Fe(OH)3 | D.Fe3O4 |
上述反应的离子方程式如下,请将方程式补写完整
___________
 +_______H2O=_______Fe(OH)3(胶体)+________O2↑+_________OH-
+_______H2O=_______Fe(OH)3(胶体)+________O2↑+_________OH-(3)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
①写出FeCl3溶液与金属铜发生反应的化学方程式
②某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,采用下列步骤:

请写出上述过程中滤渣③中所含成分的化学式
(4)把1.1g铁、铝混合物溶于200ml5mol/L盐酸中,反应后盐酸的浓度变为4.6mol/L(溶液体积变化忽略不计)。求①反应中消耗HCl的物质的量
②该混合物中铝的物质的量
您最近一年使用:0次
2023-01-07更新
|
290次组卷
|
2卷引用:四川省成都高新实验中学2022-2023学年高一上学期期末检测化学试题



