1 . 写出下列物质的除杂方式
Cl2(HCl)____________ CO2(HCl)___________
Cl2(HCl)
您最近一年使用:0次
名校
2 . 我国将力争2060年前实现碳中和,CO2的捕捉是减少碳排放的措施之一、
(1)一种利用NaOH溶液捕捉回收CO2的过程如图所示。
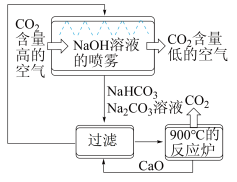
①捕捉室中NaOH溶液常喷成雾状,优点是___________ 。
②整个过程中可以循环利用的物质是___________ 。
(2)实验室模拟捕捉回收CO2,需要 溶液,现进行溶液配制。
溶液,现进行溶液配制。
①配制溶液需要的玻璃仪器是烧杯、玻璃棒和___________ 。根据计算用天平称量NaOH固体___________ g。
②在容量瓶的使用方法中,下列操作正确的是___________ 。
A.使用容量瓶前检验是否漏水
B.容量瓶用蒸馏水洗净,必须干燥后再配制溶液
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线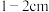 处,用胶头滴管加蒸馏水至刻度线。
处,用胶头滴管加蒸馏水至刻度线。
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线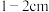 处,用胶头滴管加蒸馏水至刻度线。
处,用胶头滴管加蒸馏水至刻度线。
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3) 蛋黄型空心球催化剂技术实现了
蛋黄型空心球催化剂技术实现了 封存和能量储存双重效果,其原理如图所示。制得的甲烷(CH4)通过两步法可制取
封存和能量储存双重效果,其原理如图所示。制得的甲烷(CH4)通过两步法可制取 ,原理如图所示。
,原理如图所示。


①已知 中H为+1价,则空心球催化剂技术中获得的
中H为+1价,则空心球催化剂技术中获得的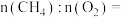
___________ 。
②写出两步法的步骤ii的化学方程式___________ 。
(1)一种利用NaOH溶液捕捉回收CO2的过程如图所示。

①捕捉室中NaOH溶液常喷成雾状,优点是
②整个过程中可以循环利用的物质是
(2)实验室模拟捕捉回收CO2,需要
 溶液,现进行溶液配制。
溶液,现进行溶液配制。①配制溶液需要的玻璃仪器是烧杯、玻璃棒和
②在容量瓶的使用方法中,下列操作正确的是
A.使用容量瓶前检验是否漏水
B.容量瓶用蒸馏水洗净,必须干燥后再配制溶液
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线
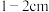 处,用胶头滴管加蒸馏水至刻度线。
处,用胶头滴管加蒸馏水至刻度线。D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线
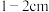 处,用胶头滴管加蒸馏水至刻度线。
处,用胶头滴管加蒸馏水至刻度线。E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3)
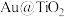 蛋黄型空心球催化剂技术实现了
蛋黄型空心球催化剂技术实现了 封存和能量储存双重效果,其原理如图所示。制得的甲烷(CH4)通过两步法可制取
封存和能量储存双重效果,其原理如图所示。制得的甲烷(CH4)通过两步法可制取 ,原理如图所示。
,原理如图所示。

①已知
 中H为+1价,则空心球催化剂技术中获得的
中H为+1价,则空心球催化剂技术中获得的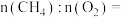
②写出两步法的步骤ii的化学方程式
您最近一年使用:0次
名校
3 . 我国是世界产盐大国,海盐、湖盐和井盐的总产量居世界第二位。某同学进行粗盐的提纯并配制溶液、检验纯度实验。
(一)粗盐的提纯
(1)粗盐中含有泥沙、Ca2+、Mg2+、SO 杂质,请选择合适的操作补全实验流程。
杂质,请选择合适的操作补全实验流程。_______
将粗盐溶解→加入NaOH溶液→___________→___________→___________→___________→结晶得到精盐
加入稀盐酸 B.加入稀硫酸 C.过滤 D.加入BaCl2溶液 E.加入Na2CO3溶液
(2)以上流程中加酸的目的是(用离子方程式表示)___________
(二)一定浓度溶液的配制:用制得的精盐配制100 mL 1.00 mol/L NaCl溶液
(3)实验中用到的玻璃仪器,除了烧杯、量筒、胶头滴管外,还需要___________
(4)定容时的操作:当液面离容量瓶刻度线1~2cm时,___________ ,再将容量瓶塞盖好,反复上下颠倒,摇匀。
(5)下列操作会使配得的NaCl溶液浓度偏低的是___________。
(三)纯度测定
取25.00mL所配溶液于锥形瓶中,加入几滴K2CrO4溶液(指示反应终点),在不断摇动下,滴加1.00mol/L AgNO3溶液反应。平行测试3次,平均消耗AgNO3溶液23.50mL。
(6)制得的NaCl的纯度是___________ 。
(一)粗盐的提纯
(1)粗盐中含有泥沙、Ca2+、Mg2+、SO
 杂质,请选择合适的操作补全实验流程。
杂质,请选择合适的操作补全实验流程。将粗盐溶解→加入NaOH溶液→___________→___________→___________→___________→结晶得到精盐
加入稀盐酸 B.加入稀硫酸 C.过滤 D.加入BaCl2溶液 E.加入Na2CO3溶液
(2)以上流程中加酸的目的是(用离子方程式表示)
(二)一定浓度溶液的配制:用制得的精盐配制100 mL 1.00 mol/L NaCl溶液
(3)实验中用到的玻璃仪器,除了烧杯、量筒、胶头滴管外,还需要
(4)定容时的操作:当液面离容量瓶刻度线1~2cm时,
(5)下列操作会使配得的NaCl溶液浓度偏低的是___________。
| A.没有进行洗涤操作 |
| B.定容时俯视容量瓶的刻度线 |
| C.摇匀后发现液面低于容量瓶刻度线,再滴加蒸馏水至刻度线 |
| D.转移洗涤液时洒到容量瓶外,继续用该未清洗的容量瓶重新配制 |
(三)纯度测定
取25.00mL所配溶液于锥形瓶中,加入几滴K2CrO4溶液(指示反应终点),在不断摇动下,滴加1.00mol/L AgNO3溶液反应。平行测试3次,平均消耗AgNO3溶液23.50mL。
(6)制得的NaCl的纯度是
您最近一年使用:0次
2023-11-17更新
|
173次组卷
|
5卷引用:河南省焦作市博爱县第一中学2023-2024学年高三上学期12月月考化学试题
4 . 某学习兴趣小组在探究AgNO3对氯水漂白效果的实验中,发现同时产生了AgC1和AgClO沉淀。于是,组内同学基于物质类别、氧化还原、物质特性等视角对沉淀混合物中AgClO的性质进行探究。
探究1:AgClO的不稳定性
(1)AgClO属于_____ (填“酸”、“碱”、“盐”或“氧化物”)。
(2)向氯水中滴加过量AgNO3溶液,将反应后的悬浊液先进行_____ (填实验操作名称)。再将沉淀洗涤、干燥后置于坩埚中灼烧。经测定,加热后坩埚和周体总质量减少。
(3)类比HClO的分解反应,写出AgClO受热分解的化学方程式_____ 。
探究2:AgClO的强氧化性
(4)推测上述实验中产生的气体是_____ ,AgClO与浓盐酸反应的化学方程式为_____ 。
探究3:AgClO的漂白性
查资料知:AgClO与饱和NaCl溶液可发生转化反应:
(5)推测AgC1O具有漂白性的原因是由_____ (填序号)引起的。
①Ag+ ②C1- ③C1O- ④Na+
探究1:AgClO的不稳定性
(1)AgClO属于
(2)向氯水中滴加过量AgNO3溶液,将反应后的悬浊液先进行
(3)类比HClO的分解反应,写出AgClO受热分解的化学方程式
探究2:AgClO的强氧化性
| 实验准备 | 实验试剂及用量 | 实验现象 |
| 取沉淀混合物,用蒸馏水洗涤3次,干燥后装入一支试管中,再加入试剂,观察现象 | ①2mL浓盐酸 ②湿润的淀粉KI试纸若干 | 湿润的淀粉KI试纸变蓝,同时,有刺激性气味气体产生 |
探究3:AgClO的漂白性
查资料知:AgClO与饱和NaCl溶液可发生转化反应:

| 实验准备 | 实验操作 | 实验现象 |
| 取沉淀混合物,用蒸馏水洗涤3次,干燥后装入一支试管中,再加入试剂,观察现象 | 加入5mL饱和NaCl溶液,静置4小时后,另取上层清液1mL于试管a中,滴加1滴品红溶液 | 试管a中品红溶液褪色 |
①Ag+ ②C1- ③C1O- ④Na+
您最近一年使用:0次
2023-11-08更新
|
97次组卷
|
2卷引用:河南省商丘名校联考2023-2024学年高一上学期11月期中考试化学试题
解题方法
5 . 氮及其化合物在化学工业和环境工业中研究颇多。回答下列问题:
(1)联氨(N2H4)可用于处理锅炉水中的溶解氧,一种反应机理如图所示。

①类比NH3与HCl反应,写出H2N-NH2与足量HCl反应的化学方程式:___________ 。
②反应Ⅱ的离子方程式为___________ 。
③1molN2H4可处理水中___________ molO2。
(2)氮污染主要包括氨态氮(NH3、
 )和硝态氮(
)和硝态氮(
 、
、
 ),工业上常利用还原法处理水体中的无机氮。如普通铝粉可实现酸性污水的脱硝(硝态氮转化为N2)。
),工业上常利用还原法处理水体中的无机氮。如普通铝粉可实现酸性污水的脱硝(硝态氮转化为N2)。
①写出普通铝粉脱硝时, 反应的离子方程式:
反应的离子方程式:___________ ,酸性太强不利于脱硝,其原因是__________ 。
②等量的纳米铝粉比普通铝粉更有利于脱硝,其原因有___________ (写出一点即可)。
③研究发现纳米铁粉也有很好的脱硝效果,但水体中溶解氧(O2)过多,会大大降低脱硝效果,其原因是_________ 。
(3)氨态氮可用次氯酸钠除去,一种原理如图所示。

①NaClO除去氨态氮的总反应中,参与反应的氧化剂与还原剂的物质的量之比为___________ 。
②在较高温度下,氨态氮去除率会降低,其原因是___________ (语言叙述)。
(1)联氨(N2H4)可用于处理锅炉水中的溶解氧,一种反应机理如图所示。

①类比NH3与HCl反应,写出H2N-NH2与足量HCl反应的化学方程式:
②反应Ⅱ的离子方程式为
③1molN2H4可处理水中
(2)氮污染主要包括氨态氮(NH3、
 )和硝态氮(
)和硝态氮( 、
、 ),工业上常利用还原法处理水体中的无机氮。如普通铝粉可实现酸性污水的脱硝(硝态氮转化为N2)。
),工业上常利用还原法处理水体中的无机氮。如普通铝粉可实现酸性污水的脱硝(硝态氮转化为N2)。①写出普通铝粉脱硝时,
 反应的离子方程式:
反应的离子方程式:②等量的纳米铝粉比普通铝粉更有利于脱硝,其原因有
③研究发现纳米铁粉也有很好的脱硝效果,但水体中溶解氧(O2)过多,会大大降低脱硝效果,其原因是
(3)氨态氮可用次氯酸钠除去,一种原理如图所示。

①NaClO除去氨态氮的总反应中,参与反应的氧化剂与还原剂的物质的量之比为
②在较高温度下,氨态氮去除率会降低,其原因是
您最近一年使用:0次
名校
解题方法
6 . 回答下列问题:
I.已知:① ②
② ③
③ ④
④ ⑤稀硫酸 ⑥硼酸 ⑦饱和
⑤稀硫酸 ⑥硼酸 ⑦饱和 溶液 ⑧氨水 ⑨稀硝酸 ⑩硫酸铝。根据上述提供的物质,回答下列问题:
溶液 ⑧氨水 ⑨稀硝酸 ⑩硫酸铝。根据上述提供的物质,回答下列问题:
(1)属于电解质的是_______ 。(填数字序号)
(2) 具有一元弱酸的性质,在水中可产生正四面体结构的离子,写出
具有一元弱酸的性质,在水中可产生正四面体结构的离子,写出 在水中的电离方程式:
在水中的电离方程式:_______ 。
Ⅱ.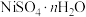 易溶于水,难溶于乙醇,其水溶液显酸性。从电镀污泥中可回收制备
易溶于水,难溶于乙醇,其水溶液显酸性。从电镀污泥中可回收制备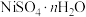 ,采用热重分析法测定所得
,采用热重分析法测定所得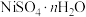 样品所含结晶水数。
样品所含结晶水数。
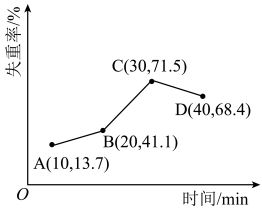
(3)将样品在900℃下进行锻烧,失重率随时间变化如图所示,A点时失掉2个结晶水,n的值为_______ ;C点产物的化学式为_______ 。
(4)高铁酸钾( ,
, 为
为 价)是一种高效水处理剂,具有氧化能力强、安全性好等优点。已知
价)是一种高效水处理剂,具有氧化能力强、安全性好等优点。已知 是紫色固体,可溶于水、微溶于浓
是紫色固体,可溶于水、微溶于浓 溶液。实验室可通过如下反应制取
溶液。实验室可通过如下反应制取 溶液:
溶液: (未配平)。
(未配平)。
①配平反应的方程式,并用单线桥表示电子转移的方向和数目_______ 。
②反应结束后,为从溶液中获得 晶体,可采取的实验操作是
晶体,可采取的实验操作是_______ 。
Ⅲ.锰酸锂离子蓄电池是第二代锂离子动力电池。锰酸锂可充电电池的总反应为 。
。
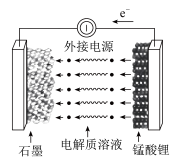
(5)充电时,电池的阳极反应式为_______ ,若此时转移
 ,则石墨电极将增重
,则石墨电极将增重_______ g。
(6)一种锰的硅化物的晶胞结构 如图所示:
如图所示:
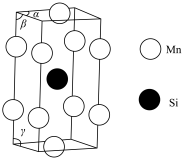
a.基态 原子的核外电子排布式为
原子的核外电子排布式为_______ 。
b.该锰的硅化物的化学式为_______ 。
Ⅳ.我国化学家侯德榜发明了联合制碱法,为世界制碱工业做出了巨大贡献。联合制碱法的主要过程如图所示(部分物质已略去)。
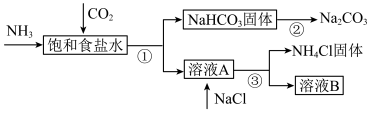
(7)饱和食盐水中通二氧化碳和氨气的离子方程式是_______ 。
(8)下列说法中合理的是_______(填标号)。
I.已知:①
 ②
② ③
③ ④
④ ⑤稀硫酸 ⑥硼酸 ⑦饱和
⑤稀硫酸 ⑥硼酸 ⑦饱和 溶液 ⑧氨水 ⑨稀硝酸 ⑩硫酸铝。根据上述提供的物质,回答下列问题:
溶液 ⑧氨水 ⑨稀硝酸 ⑩硫酸铝。根据上述提供的物质,回答下列问题:(1)属于电解质的是
(2)
 具有一元弱酸的性质,在水中可产生正四面体结构的离子,写出
具有一元弱酸的性质,在水中可产生正四面体结构的离子,写出 在水中的电离方程式:
在水中的电离方程式:Ⅱ.
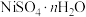 易溶于水,难溶于乙醇,其水溶液显酸性。从电镀污泥中可回收制备
易溶于水,难溶于乙醇,其水溶液显酸性。从电镀污泥中可回收制备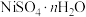 ,采用热重分析法测定所得
,采用热重分析法测定所得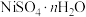 样品所含结晶水数。
样品所含结晶水数。
(3)将样品在900℃下进行锻烧,失重率随时间变化如图所示,A点时失掉2个结晶水,n的值为
(4)高铁酸钾(
 ,
, 为
为 价)是一种高效水处理剂,具有氧化能力强、安全性好等优点。已知
价)是一种高效水处理剂,具有氧化能力强、安全性好等优点。已知 是紫色固体,可溶于水、微溶于浓
是紫色固体,可溶于水、微溶于浓 溶液。实验室可通过如下反应制取
溶液。实验室可通过如下反应制取 溶液:
溶液: (未配平)。
(未配平)。①配平反应的方程式,并用单线桥表示电子转移的方向和数目
②反应结束后,为从溶液中获得
 晶体,可采取的实验操作是
晶体,可采取的实验操作是Ⅲ.锰酸锂离子蓄电池是第二代锂离子动力电池。锰酸锂可充电电池的总反应为
 。
。
(5)充电时,电池的阳极反应式为

 ,则石墨电极将增重
,则石墨电极将增重(6)一种锰的硅化物的晶胞结构
 如图所示:
如图所示:
a.基态
 原子的核外电子排布式为
原子的核外电子排布式为b.该锰的硅化物的化学式为
Ⅳ.我国化学家侯德榜发明了联合制碱法,为世界制碱工业做出了巨大贡献。联合制碱法的主要过程如图所示(部分物质已略去)。

(7)饱和食盐水中通二氧化碳和氨气的离子方程式是
(8)下列说法中合理的是_______(填标号)。
A.副产物 可用作氮肥 可用作氮肥 |
B.溶液B中的主要离子是 、 、 、 、 、 、 |
C.制碱流程中可回收并循环利用的物质只有碳酸氢钠分解产生的 |
| D.饱和食盐水中应该先通二氧化碳至饱和,再通入氨气至饱和 |
您最近一年使用:0次
7 . 海洋中蕴含着丰富的资源,我们通过“浓缩、氧化、提取”等步骤获取溴、碘单质等资源。回答下列问题:
Ⅰ.为研究海水提溴工艺,甲、乙两同学分别设计了如下实验流程:
甲:苦卤 含溴海水
含溴海水 含溴空气
含溴空气 溴水混合物
溴水混合物 溴蒸气
溴蒸气 液溴
液溴
乙:苦卤 含溴海水
含溴海水 溴蒸气
溴蒸气 液溴
液溴
(1)对比甲、乙两流程,最大的区别在于对含溴海水的处理方法不同,其中较符合实际工业生产要求且能耗较低的是___________ (填“甲”或“乙”)。
(2)甲同学设计的流程中,步骤③通入热空气或水蒸气吹出Br2,利用了溴的___________ 性;步骤④中发生反应的化学方程式为 ___________ 。
Ⅱ.对比溴元素的提取,碘元素是从海洋植物如海带、海藻中提取,某提取碘单质的工艺流程如图。___________ ;步骤④的离子方程式为 ___________ 。
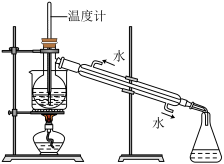
(4)从含碘的某溶液中提取碘,还要经过蒸馏,指出下列蒸馏装置中的错误之处:________ (任写两点)。
Ⅰ.为研究海水提溴工艺,甲、乙两同学分别设计了如下实验流程:
甲:苦卤
 含溴海水
含溴海水 含溴空气
含溴空气 溴水混合物
溴水混合物 溴蒸气
溴蒸气 液溴
液溴乙:苦卤
 含溴海水
含溴海水 溴蒸气
溴蒸气 液溴
液溴(1)对比甲、乙两流程,最大的区别在于对含溴海水的处理方法不同,其中较符合实际工业生产要求且能耗较低的是
(2)甲同学设计的流程中,步骤③通入热空气或水蒸气吹出Br2,利用了溴的
Ⅱ.对比溴元素的提取,碘元素是从海洋植物如海带、海藻中提取,某提取碘单质的工艺流程如图。

(4)从含碘的某溶液中提取碘,还要经过蒸馏,指出下列蒸馏装置中的错误之处:
您最近一年使用:0次
2023-05-30更新
|
230次组卷
|
6卷引用:河南省洛阳强基联盟2022-2023学年高一下学期5月联考化学试题
河南省洛阳强基联盟2022-2023学年高一下学期5月联考化学试题黑龙江省哈尔滨市2022-2023学年高一下学期学业质量检测化学试题辽宁省凌源市普通高中2022-2023学年高一下学期6月月考化学试题青海省西宁市大通回族土族自治县2022-2023学年高一下学期期末考试化学试题甘肃省永昌县第一高级中学2022-2023学年高一下学期期末考试化学试题(已下线)专题06 化学与可持续发展-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(人教版2019必修第二册)



