名校
解题方法
1 . 抗原检测盒中T线处是使用的胶体金(Au)标记物,一种从被FeS2包裹的含金矿物中提金的工艺流程如下:
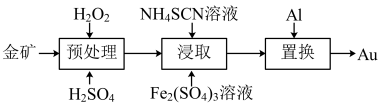
(1)①“预处理”时,FeS2被氧化为Fe2(SO4)3,写出该反应的离子方程式_______ 。
②研究发现H2O2在Fe2+的催化作用下产生具有强氧化能力的中间体·OH,·OH将金表面的FeS2氧化溶出。FeS2溶出率与硫酸初始浓度的关系如图所示,随着硫酸初始浓度的增大,FeS2溶出率逐渐提高的主要原因是_______ 。

(2)“置换”时需维持无氧环境,其主要原因是_______ 。
(3)测定样品中Au的含量:准确称取0.1000g试样,加入王水,将Au转化成具有强氧化性的氯金酸(HAuCl4),在除去硝酸根后的溶液中,边不断搅拌,边向溶液中加入过量0.4000mol·L-1 FeSO4溶液30.00mL,将HAuCl4完全还原为Au:滴加二苯胺磺酸钠作指示剂,用0.1000mol·L-1 K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液18.00mL。
已知: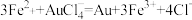

计算样品中金的质量分数(写出计算过程)_______ 。

(1)①“预处理”时,FeS2被氧化为Fe2(SO4)3,写出该反应的离子方程式
②研究发现H2O2在Fe2+的催化作用下产生具有强氧化能力的中间体·OH,·OH将金表面的FeS2氧化溶出。FeS2溶出率与硫酸初始浓度的关系如图所示,随着硫酸初始浓度的增大,FeS2溶出率逐渐提高的主要原因是

(2)“置换”时需维持无氧环境,其主要原因是
(3)测定样品中Au的含量:准确称取0.1000g试样,加入王水,将Au转化成具有强氧化性的氯金酸(HAuCl4),在除去硝酸根后的溶液中,边不断搅拌,边向溶液中加入过量0.4000mol·L-1 FeSO4溶液30.00mL,将HAuCl4完全还原为Au:滴加二苯胺磺酸钠作指示剂,用0.1000mol·L-1 K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液18.00mL。
已知:
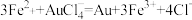

计算样品中金的质量分数(写出计算过程)
您最近一年使用:0次
名校
解题方法
2 . 海洋中蕴含着丰富的资源,我们通过“浓缩、氧化、提取”等步骤提取其中的溴、碘单质等资源。
为研究海水提溴工艺,甲、乙两同学分别设计了如下实验流程:
甲:苦卤 含溴海水
含溴海水 含溴空气
含溴空气 溴水混合物
溴水混合物 溴蒸气
溴蒸气 液溴
液溴
乙:苦卤 含溴海水
含溴海水 溴蒸气
溴蒸气 液溴
液溴
(1)步骤③通入热空气或水蒸气吹出Br2,利用了溴的__________ 性。甲同学步骤④所发生反应的化学反应方程式为___________________ 。步骤④中SO2被氧化生成 ,写出检验
,写出检验 的方法
的方法___________________ 。
(2)对比甲、乙两流程,最大的区别在于对含溴海水的处理方法不同,其中符合工业生产要求的是_______ (填“甲”或“乙”),理由_____________________________________ 。
海洋植物中富含一种人体必需的微量元素——碘。实验室模拟从海带中提取碘单质的流程图如下:

(3)为寻找氯水的替代品,某同学将O2不断鼓入“溶液A”中。设计实验,判断O2是否能代替氯水。(简要说明所用的试剂、现象和结论)____________________ 。
(4)由于“溶液B”中I2的含量较低,“操作I”能将I2“富集、浓缩”到“有机溶液X”中。已知:I2在以下试剂中的溶解度都大于水,则“试剂a”可以是_________ 。(选填编号)
(5)除操作I可以从碘的有机溶液中提取碘以外,还可用反萃取法,其流程如下:
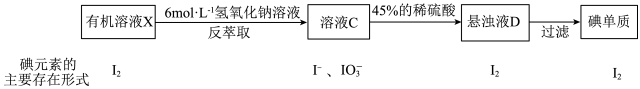
①“配制100g质量分数为45%H2SO4溶液”一定不会用到“配制100mL 6mol·L-1NaOH溶液”中的_____________ 仪器(填名称)。
②相较于操作II,反萃取法的优点在于_______________ 。
为研究海水提溴工艺,甲、乙两同学分别设计了如下实验流程:
甲:苦卤
 含溴海水
含溴海水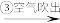 含溴空气
含溴空气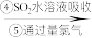 溴水混合物
溴水混合物 溴蒸气
溴蒸气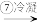 液溴
液溴乙:苦卤
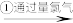 含溴海水
含溴海水 溴蒸气
溴蒸气 液溴
液溴(1)步骤③通入热空气或水蒸气吹出Br2,利用了溴的
 ,写出检验
,写出检验 的方法
的方法(2)对比甲、乙两流程,最大的区别在于对含溴海水的处理方法不同,其中符合工业生产要求的是
海洋植物中富含一种人体必需的微量元素——碘。实验室模拟从海带中提取碘单质的流程图如下:

(3)为寻找氯水的替代品,某同学将O2不断鼓入“溶液A”中。设计实验,判断O2是否能代替氯水。(简要说明所用的试剂、现象和结论)
(4)由于“溶液B”中I2的含量较低,“操作I”能将I2“富集、浓缩”到“有机溶液X”中。已知:I2在以下试剂中的溶解度都大于水,则“试剂a”可以是
试剂 | A.乙醇 | B.氯仿 | C.四氯化碳 | D.裂化汽油 |
相关性质 | 与水互溶 不与I2反应 | 与水不互溶 不与I2反应 | 与水不互溶 不与I2反应 | 与水不互溶 与I2反应 |
(5)除操作I可以从碘的有机溶液中提取碘以外,还可用反萃取法,其流程如下:

①“配制100g质量分数为45%H2SO4溶液”一定不会用到“配制100mL 6mol·L-1NaOH溶液”中的
②相较于操作II,反萃取法的优点在于
您最近一年使用:0次
2022-12-14更新
|
762次组卷
|
2卷引用:上海市格致中学2023-2024学年高二上学期期末考试级化学(合格考)试卷
名校
3 . 填空
(1)胆矾的化学式为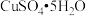 。
。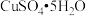 属于
属于___________ 。 (选填“纯净物”或“混合物”); 1mol 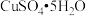 中约含有
中约含有___________ 个S原子
(2)湿法炼铜产生酸性废水,含有的H2SO4、CuSO4、 ZnSO4, 可用铁炭混合物(铁粉和活性炭的混合物)除去。其他条件不变,废水pH对Cu2+、Zn2+去除率的影响如图所示。
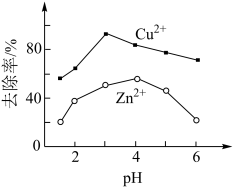
①pH<3时,铁炭混合物表面有大量气泡产生,产生该现象的化学方程式为___________ 。
②相同pH条件下,Cu2+的去除率远高于Zn2+的原因可能是___________ 。
(3)如图是某输液瓶标签上的部分内容。由此可知,葡萄糖由___________ 种元素组成,其中碳元素的质量分数为___________ 。要把 10 g 这种葡萄糖溶液稀释为 2%的溶液,需要加水的质量为___________ g。
(1)胆矾的化学式为
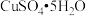 。
。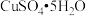 属于
属于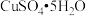 中约含有
中约含有(2)湿法炼铜产生酸性废水,含有的H2SO4、CuSO4、 ZnSO4, 可用铁炭混合物(铁粉和活性炭的混合物)除去。其他条件不变,废水pH对Cu2+、Zn2+去除率的影响如图所示。

①pH<3时,铁炭混合物表面有大量气泡产生,产生该现象的化学方程式为
②相同pH条件下,Cu2+的去除率远高于Zn2+的原因可能是
(3)如图是某输液瓶标签上的部分内容。由此可知,葡萄糖由
| 葡萄糖注射液 (C6H12O6) 【成分】葡萄糖,水 【规格】500mL 质量分数为 5% 【性状】液体,味甜 【贮藏】密闭保存 |
您最近一年使用:0次
4 . 钴酸锂电池广泛应用于笔记本电脑、手机等小型电子设备中。
(1)钴酸锂电池工作时发生反应: ,电解质中可传导
,电解质中可传导 。
。
①基态 原子的核外电子排布式为
原子的核外电子排布式为___________ 。
②钴酸锂电池放电时正极反应式为___________ 。
(2)将废旧的钴酸锂电池正极材料(主要成分为 )粉碎,加入
)粉碎,加入 硫酸和30%
硫酸和30% 的混合溶液浸取,利用浸取液可制得
的混合溶液浸取,利用浸取液可制得 。
。
①浸取时,加料完成后,控制适宜温度,并以一定速率搅拌反应。提高钴元素浸取率的方法还有___________ 。
②写出浸取时生成 和
和 的化学方程式:
的化学方程式:___________ 。
③在稀硫酸中加入 样品(仅含
样品(仅含 杂质),待样品完全溶解后加入
杂质),待样品完全溶解后加入 固体。充分反应后调节溶液
固体。充分反应后调节溶液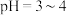 。以淀粉作指示剂,逐滴滴入
。以淀粉作指示剂,逐滴滴入 标准溶液,反应结束时共消耗标准溶液
标准溶液,反应结束时共消耗标准溶液 。
。
已知: (未配平),
(未配平), (未配平)。
(未配平)。
计算样品中 的质量分数
的质量分数___________ (写出计算过程)。
(1)钴酸锂电池工作时发生反应:
 ,电解质中可传导
,电解质中可传导 。
。①基态
 原子的核外电子排布式为
原子的核外电子排布式为②钴酸锂电池放电时正极反应式为
(2)将废旧的钴酸锂电池正极材料(主要成分为
 )粉碎,加入
)粉碎,加入 硫酸和30%
硫酸和30% 的混合溶液浸取,利用浸取液可制得
的混合溶液浸取,利用浸取液可制得 。
。①浸取时,加料完成后,控制适宜温度,并以一定速率搅拌反应。提高钴元素浸取率的方法还有
②写出浸取时生成
 和
和 的化学方程式:
的化学方程式:③在稀硫酸中加入
 样品(仅含
样品(仅含 杂质),待样品完全溶解后加入
杂质),待样品完全溶解后加入 固体。充分反应后调节溶液
固体。充分反应后调节溶液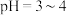 。以淀粉作指示剂,逐滴滴入
。以淀粉作指示剂,逐滴滴入 标准溶液,反应结束时共消耗标准溶液
标准溶液,反应结束时共消耗标准溶液 。
。已知:
 (未配平),
(未配平), (未配平)。
(未配平)。计算样品中
 的质量分数
的质量分数
您最近一年使用:0次
2023-11-19更新
|
186次组卷
|
2卷引用:江苏省南通市2023-2024学年高二上学期期中考试化学试题
名校
解题方法
5 . 碘化钾( )是实验室常用的化学试剂,用途广泛。一种利用含碘废液(碘的主要存在形式为
)是实验室常用的化学试剂,用途广泛。一种利用含碘废液(碘的主要存在形式为 和
和 )制备碘化钾的实验步骤如下:
)制备碘化钾的实验步骤如下:
步骤Ⅰ:取含碘废液,调节溶液 为
为 ,加入一定量
,加入一定量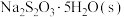 ,溶解,加热至30℃,加入稍过量
,溶解,加热至30℃,加入稍过量 粉末,搅拌,充分反应后,过滤得
粉末,搅拌,充分反应后,过滤得 沉淀;
沉淀;
步骤Ⅱ:在 圆底烧瓶中加入上述制备的
圆底烧瓶中加入上述制备的 沉淀,铁粉(过量),
沉淀,铁粉(过量),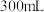 蒸馏水,搅拌,沸水浴加热1小时,冷却,抽滤。将滤液倒入
蒸馏水,搅拌,沸水浴加热1小时,冷却,抽滤。将滤液倒入 烧杯中,加入约
烧杯中,加入约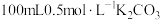 溶液,搅拌,煮沸,静置,过滤,得滤液A;
溶液,搅拌,煮沸,静置,过滤,得滤液A;
步骤Ⅲ:用氢碘酸调滤液A的 ,将滤液倒入___________(填仪器名称)中加热至___________(填现象),冷却,干燥,得到
,将滤液倒入___________(填仪器名称)中加热至___________(填现象),冷却,干燥,得到 晶体。
晶体。
回答下列问题:
(1)步骤Ⅰ中的控温方法为___________ , 与
与 转化为
转化为 的反应为①
的反应为① ,②
,② ,则反应②中氧化剂与还原剂的物质的量之比为
,则反应②中氧化剂与还原剂的物质的量之比为___________ 。
(2)步骤Ⅱ中铁粉转化为 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
(3)步骤Ⅲ中,仪器的名称是___________ ,现象是___________ 。
(4)产品中KI含量的测定
称取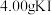 4.00样品,配成
4.00样品,配成 溶液,取
溶液,取 溶液于锥形瓶中,加入
溶液于锥形瓶中,加入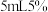 乙酸溶液及3滴曙红钠盐作指示剂,用
乙酸溶液及3滴曙红钠盐作指示剂,用 的
的 标准溶液避光滴定至沉淀呈红色(终点),平行滴定三次,消耗
标准溶液避光滴定至沉淀呈红色(终点),平行滴定三次,消耗 标准溶液分别为
标准溶液分别为 、
、 、
、 。
。
①用 标准溶液滴定时要避光的原因是
标准溶液滴定时要避光的原因是___________ ,在滴定时 溶液应盛放在
溶液应盛放在___________ (“酸式”或“碱式”)滴定管。
②样品中 的质量分数为
的质量分数为___________ 。
 )是实验室常用的化学试剂,用途广泛。一种利用含碘废液(碘的主要存在形式为
)是实验室常用的化学试剂,用途广泛。一种利用含碘废液(碘的主要存在形式为 和
和 )制备碘化钾的实验步骤如下:
)制备碘化钾的实验步骤如下:步骤Ⅰ:取含碘废液,调节溶液
 为
为 ,加入一定量
,加入一定量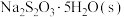 ,溶解,加热至30℃,加入稍过量
,溶解,加热至30℃,加入稍过量 粉末,搅拌,充分反应后,过滤得
粉末,搅拌,充分反应后,过滤得 沉淀;
沉淀;步骤Ⅱ:在
 圆底烧瓶中加入上述制备的
圆底烧瓶中加入上述制备的 沉淀,铁粉(过量),
沉淀,铁粉(过量),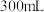 蒸馏水,搅拌,沸水浴加热1小时,冷却,抽滤。将滤液倒入
蒸馏水,搅拌,沸水浴加热1小时,冷却,抽滤。将滤液倒入 烧杯中,加入约
烧杯中,加入约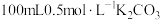 溶液,搅拌,煮沸,静置,过滤,得滤液A;
溶液,搅拌,煮沸,静置,过滤,得滤液A;步骤Ⅲ:用氢碘酸调滤液A的
 ,将滤液倒入___________(填仪器名称)中加热至___________(填现象),冷却,干燥,得到
,将滤液倒入___________(填仪器名称)中加热至___________(填现象),冷却,干燥,得到 晶体。
晶体。回答下列问题:
(1)步骤Ⅰ中的控温方法为
 与
与 转化为
转化为 的反应为①
的反应为① ,②
,② ,则反应②中氧化剂与还原剂的物质的量之比为
,则反应②中氧化剂与还原剂的物质的量之比为(2)步骤Ⅱ中铁粉转化为
 ,该反应的化学方程式为
,该反应的化学方程式为(3)步骤Ⅲ中,仪器的名称是
(4)产品中KI含量的测定
称取
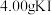 4.00样品,配成
4.00样品,配成 溶液,取
溶液,取 溶液于锥形瓶中,加入
溶液于锥形瓶中,加入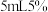 乙酸溶液及3滴曙红钠盐作指示剂,用
乙酸溶液及3滴曙红钠盐作指示剂,用 的
的 标准溶液避光滴定至沉淀呈红色(终点),平行滴定三次,消耗
标准溶液避光滴定至沉淀呈红色(终点),平行滴定三次,消耗 标准溶液分别为
标准溶液分别为 、
、 、
、 。
。①用
 标准溶液滴定时要避光的原因是
标准溶液滴定时要避光的原因是 溶液应盛放在
溶液应盛放在②样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
2024-01-02更新
|
210次组卷
|
2卷引用:贵州省贵阳市2023-2024学年高三上学期11月质量检测化学试题
名校
6 . 亚硝酸钠(NaNO2)用途很广泛:可制药,作食品防腐剂、显色剂,作印染工业的媒染剂、漂白剂、缓蚀剂等。某兴趣小组欲制备亚硝酸钠并进行一定的实验探究,查阅资料可知:①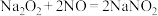 ;②
;②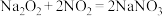 ;③NO可被酸性KMnO4氧化成
;③NO可被酸性KMnO4氧化成 。
。
【制备NaNO2】
用下图所示装置制备NaNO2:
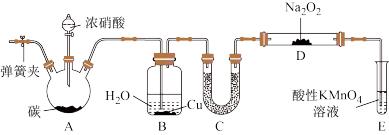
(1)过氧化钠的电子式是_____ 。
(2)仪器B中Cu的作用是_____ 。
(3)U形管C中的试剂可以是_____ 。
(4)试管E中反应的离子方程式为_____ 。
(5)以上装置有设计缺陷,会使产品NaNO2中杂质增多。改进方法是_____ 。
【测定NaNO2纯度】
(6)①称量0.5000g制得的样品,溶于水配成500mL溶液;
②取25.00mL待测液于锥形瓶中,加入足量KI酸性溶液,滴入2~3滴淀粉溶液;
③取一支_____ (填“酸”或“碱”)式滴定管用蒸馏水洗净后,用0.01mol/LNa2S2O3溶液润洗,装液,排出下端尖嘴内的气泡,调整液面,记下读数:
④进行滴定,记录读数。重复实验后,平均消耗Na2S2O3溶液的体积为20.00mL。(已知: ;
; )
)
(7)下列情况可能会使测得的NaNO2纯度偏低的是_____(填标号)。
(8)样品中NaNO2的质量分数为_____ 。
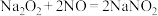 ;②
;②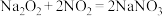 ;③NO可被酸性KMnO4氧化成
;③NO可被酸性KMnO4氧化成 。
。【制备NaNO2】
用下图所示装置制备NaNO2:

(1)过氧化钠的电子式是
(2)仪器B中Cu的作用是
(3)U形管C中的试剂可以是
(4)试管E中反应的离子方程式为
(5)以上装置有设计缺陷,会使产品NaNO2中杂质增多。改进方法是
【测定NaNO2纯度】
(6)①称量0.5000g制得的样品,溶于水配成500mL溶液;
②取25.00mL待测液于锥形瓶中,加入足量KI酸性溶液,滴入2~3滴淀粉溶液;
③取一支
④进行滴定,记录读数。重复实验后,平均消耗Na2S2O3溶液的体积为20.00mL。(已知:
 ;
; )
)(7)下列情况可能会使测得的NaNO2纯度偏低的是_____(填标号)。
| A.操作②中使用的锥形瓶未干燥 |
| B.操作③中未排尽下端尖嘴内的气泡 |
| C.操作④当滴入半滴Na2S2O3溶液,溶液由蓝色变为无色时,立即停止滴定 |
| D.整个滴定操作过慢,用时过长 |
(8)样品中NaNO2的质量分数为
您最近一年使用:0次
7 . 黏土钒矿中,钒以+3价、+4价、+5价的化合物存在,还包括SiO2、Fe2O3和铝硅酸盐(Al2O3•SiO2)等。采用以下流程可由黏土钒矿制备V2O5、Fe2O3和硫酸铝铵。

已知:i.有机酸性萃取剂HR的萃取原理为:Mn+(aq)+nHR(org) MR(org)+nH+(aq)(org表示有机溶液)
MR(org)+nH+(aq)(org表示有机溶液)
ii.酸性溶液中,HR对+4价钒萃取能力强,而对+5价钒的萃取能力较弱。
iii.HR能萃取Fe3+而不能萃取Fe2+。
(1)从黏土钒矿到浸出液的流程中,加快浸出速率的措施有_______ 。
(2)浸出液中钒以+4价、+5价的形式存在,简述加入铁粉的原因:_______ 。
(3)从平衡移动原理解释加入20%H2SO4溶液的作用:_______ 。
(4)KClO3和VO2+(反应生成VO 和Cl-的离子方程式是
和Cl-的离子方程式是_______ 。
(5)测定V2O5产品的纯度
称取V2O5产品ag,先加入硫酸将V2O5转化为VO ,加入指示剂后,cmol/L(NH4)2Fe(SO4)2溶液滴定将VO
,加入指示剂后,cmol/L(NH4)2Fe(SO4)2溶液滴定将VO 转化为VO2+至终点,消耗(NH4)2Fe(SO4)2溶液的体积为VmL。假设杂质不参与反应,则V2O5产品中V2O5的质量分数是
转化为VO2+至终点,消耗(NH4)2Fe(SO4)2溶液的体积为VmL。假设杂质不参与反应,则V2O5产品中V2O5的质量分数是_______ (V2O5的摩尔质量为Mg/mol)。
(6)从无机层获得Fe(OH)3的离子方程式是_______ 。
(7)硫酸铝铵固体中含有少量硫酸铵杂质,根据如图的溶解度曲线,进一步提纯硫酸铝铵的操作是加热溶解、_______ 、洗涤、干燥。


已知:i.有机酸性萃取剂HR的萃取原理为:Mn+(aq)+nHR(org)
 MR(org)+nH+(aq)(org表示有机溶液)
MR(org)+nH+(aq)(org表示有机溶液)ii.酸性溶液中,HR对+4价钒萃取能力强,而对+5价钒的萃取能力较弱。
iii.HR能萃取Fe3+而不能萃取Fe2+。
(1)从黏土钒矿到浸出液的流程中,加快浸出速率的措施有
(2)浸出液中钒以+4价、+5价的形式存在,简述加入铁粉的原因:
(3)从平衡移动原理解释加入20%H2SO4溶液的作用:
(4)KClO3和VO2+(反应生成VO
 和Cl-的离子方程式是
和Cl-的离子方程式是(5)测定V2O5产品的纯度
称取V2O5产品ag,先加入硫酸将V2O5转化为VO
 ,加入指示剂后,cmol/L(NH4)2Fe(SO4)2溶液滴定将VO
,加入指示剂后,cmol/L(NH4)2Fe(SO4)2溶液滴定将VO 转化为VO2+至终点,消耗(NH4)2Fe(SO4)2溶液的体积为VmL。假设杂质不参与反应,则V2O5产品中V2O5的质量分数是
转化为VO2+至终点,消耗(NH4)2Fe(SO4)2溶液的体积为VmL。假设杂质不参与反应,则V2O5产品中V2O5的质量分数是(6)从无机层获得Fe(OH)3的离子方程式是
(7)硫酸铝铵固体中含有少量硫酸铵杂质,根据如图的溶解度曲线,进一步提纯硫酸铝铵的操作是加热溶解、

您最近一年使用:0次
2023-10-22更新
|
649次组卷
|
2卷引用:北京市清华大学附属中学2023-2024学年高三上学期10月月考化学试题
名校
8 . 溶液在日常生活、工农业生产和科学研究中具有广泛用途。
(1)60℃时,KNO3的溶解度为_______ 。
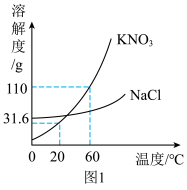
(2)20℃时,将20gKNO3加入到50g水中,充分溶解后所得溶液的质量为_______ g。
(3)除去KNO3溶液中混有的少量的NaCl,提纯的方法是_______ 。
(4)60℃,将KNO3和NaCl两种物质的饱和溶液降温至20℃,质量分数的大小关系为_______ 。
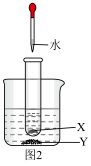
(5)探究温度对溶解度的影响,如图2所示。固体X是NH4NO3或NaOH,固体Y是KNO3或Ca(OH)2,烧杯中盛放20℃Y的饱和溶液(有少量Y的固体则余),往试管中滴入适量水,烧杯中固体逐渐消失,写出X与Y可能的组合有_______ 。
(1)60℃时,KNO3的溶解度为

(2)20℃时,将20gKNO3加入到50g水中,充分溶解后所得溶液的质量为
(3)除去KNO3溶液中混有的少量的NaCl,提纯的方法是
(4)60℃,将KNO3和NaCl两种物质的饱和溶液降温至20℃,质量分数的大小关系为
(5)探究温度对溶解度的影响,如图2所示。固体X是NH4NO3或NaOH,固体Y是KNO3或Ca(OH)2,烧杯中盛放20℃Y的饱和溶液(有少量Y的固体则余),往试管中滴入适量水,烧杯中固体逐渐消失,写出X与Y可能的组合有

您最近一年使用:0次
9 . 二氧化锰是电池工业的一种非常重要的原料
(1)电解含纳米 颗粒的酸性
颗粒的酸性 溶液可以制备掺铝二氧化锰。悬浮纳米
溶液可以制备掺铝二氧化锰。悬浮纳米 颗粒会在电场作用下向电极移动,与生成的
颗粒会在电场作用下向电极移动,与生成的 共沉淀。
共沉淀。
①写出生成 的电极反应式
的电极反应式___________ 。
②电解液中纳米 颗粒表面所带电荷的电性为
颗粒表面所带电荷的电性为___________ 。
(2) 溶液(含
溶液(含 、
、 等杂质)经除铁、沉锰得
等杂质)经除铁、沉锰得 固体,煅烧
固体,煅烧 可得到较纯
可得到较纯 。
。
①除铁时加入软锰矿(主要成分是 )能除铁,原因是
)能除铁,原因是___________ 。
②已知 沉淀是一种白色胶状固体,在空气中受热也可转化为
沉淀是一种白色胶状固体,在空气中受热也可转化为 。沉锰时将
。沉锰时将 转化为
转化为 而不转化为
而不转化为 的原因是
的原因是___________ 。
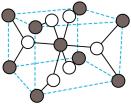
③如图是 的一种晶型的晶胞,该晶胞中
的一种晶型的晶胞,该晶胞中 所围成的空间构型是
所围成的空间构型是___________ 。
(3)测定软锰矿中 含量的方法如下:
含量的方法如下:
步骤一:称取0.1500g软锰矿样品于碘量瓶中,加适量硫酸及足量碘化钾溶液充分反应。
步骤二:待反应完全后加入少量淀粉溶液,用 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液22.00mL。
溶液22.00mL。
计算软锰矿中 的质量分数
的质量分数__________ ,写出计算过程。
已知: (未配平)
(未配平)
(1)电解含纳米
 颗粒的酸性
颗粒的酸性 溶液可以制备掺铝二氧化锰。悬浮纳米
溶液可以制备掺铝二氧化锰。悬浮纳米 颗粒会在电场作用下向电极移动,与生成的
颗粒会在电场作用下向电极移动,与生成的 共沉淀。
共沉淀。①写出生成
 的电极反应式
的电极反应式②电解液中纳米
 颗粒表面所带电荷的电性为
颗粒表面所带电荷的电性为(2)
 溶液(含
溶液(含 、
、 等杂质)经除铁、沉锰得
等杂质)经除铁、沉锰得 固体,煅烧
固体,煅烧 可得到较纯
可得到较纯 。
。①除铁时加入软锰矿(主要成分是
 )能除铁,原因是
)能除铁,原因是②已知
 沉淀是一种白色胶状固体,在空气中受热也可转化为
沉淀是一种白色胶状固体,在空气中受热也可转化为 。沉锰时将
。沉锰时将 转化为
转化为 而不转化为
而不转化为 的原因是
的原因是③如图是
 的一种晶型的晶胞,该晶胞中
的一种晶型的晶胞,该晶胞中 所围成的空间构型是
所围成的空间构型是
(3)测定软锰矿中
 含量的方法如下:
含量的方法如下:步骤一:称取0.1500g软锰矿样品于碘量瓶中,加适量硫酸及足量碘化钾溶液充分反应。
步骤二:待反应完全后加入少量淀粉溶液,用
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液22.00mL。
溶液22.00mL。计算软锰矿中
 的质量分数
的质量分数已知:
 (未配平)
(未配平)
您最近一年使用:0次
10 . 有机物M(只含C、H、O三种元素中的两种或三种)具有令人愉悦的牛奶香气,主要用于配制奶油、乳品、酸奶和草莓等型香精,是我国批准使用的香料产品,其沸点为148℃。某化学兴趣小组从粗品中分离提纯有机物M,然后借助李比希法、现代科学仪器测定有机物M的分子组成和结构,具体实验过程如下:
步骤一:将粗品用蒸馏法进行纯化。
(1)蒸馏装置如图1所示,图中虚线框内应选用右侧的_______ (填“仪器x”或“仪器y”)。

步骤二:确定M的实验式和分子式。
(2)利用元素分析仪测得有机物M中碳的质量分数为54.5%,氢的质量分数为9.1%。
①M的实验式为_______ 。
②已知M的密度是同温同压下二氧化碳密度的2倍,则M的相对分子质量为_______ ,分子式为_______ 。
步骤三:确定M的结构简式。
(3)用核磁共振仪测出M的核磁共振氢谱如图2所示,图中峰面积之比为1∶3∶1∶3;利用红外光谱仪测得M的红外光谱如图3所示。

M中官能团的名称为_______ ,M的结构简式为_______ (填键线式)。
步骤一:将粗品用蒸馏法进行纯化。
(1)蒸馏装置如图1所示,图中虚线框内应选用右侧的

步骤二:确定M的实验式和分子式。
(2)利用元素分析仪测得有机物M中碳的质量分数为54.5%,氢的质量分数为9.1%。
①M的实验式为
②已知M的密度是同温同压下二氧化碳密度的2倍,则M的相对分子质量为
步骤三:确定M的结构简式。
(3)用核磁共振仪测出M的核磁共振氢谱如图2所示,图中峰面积之比为1∶3∶1∶3;利用红外光谱仪测得M的红外光谱如图3所示。

M中官能团的名称为
您最近一年使用:0次



