名校
解题方法
1 . 氧化铁红颜料跟某些油料混合,可以制成防锈油漆.以黄铁矿为原料制硫酸产生的硫酸渣中含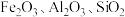 (难溶于稀硫酸),用硫酸渣制备铁红
(难溶于稀硫酸),用硫酸渣制备铁红 的过程如图:
的过程如图:

(1)“酸溶”过程中,加入过量稀硫酸充分反应后的溶液中含有的阳离子除了 ,还有
,还有____________ (填离子符号),写出 与稀硫酸反应的离子方程式:
与稀硫酸反应的离子方程式:____________ .
(2)实验室中过滤需要用到的玻璃仪器有____________ .
(3)滤渣A的主要成分是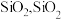 是一种常见的酸性氧化物,与
是一种常见的酸性氧化物,与 类似,可与强碱反应,写出
类似,可与强碱反应,写出 与
与 溶液反应的化学方程式:
溶液反应的化学方程式:____________ .
(4)“氧化”时,可观察到的现象为____________ .若加入的 溶液过量,则滤液B中的溶质除了
溶液过量,则滤液B中的溶质除了 外,还有
外,还有____________ (填化学式,下同);若加入的 溶液不够,则制得的铁红中可能含有的杂质为
溶液不够,则制得的铁红中可能含有的杂质为____________ .
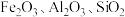 (难溶于稀硫酸),用硫酸渣制备铁红
(难溶于稀硫酸),用硫酸渣制备铁红 的过程如图:
的过程如图:
(1)“酸溶”过程中,加入过量稀硫酸充分反应后的溶液中含有的阳离子除了
 ,还有
,还有 与稀硫酸反应的离子方程式:
与稀硫酸反应的离子方程式:(2)实验室中过滤需要用到的玻璃仪器有
(3)滤渣A的主要成分是
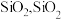 是一种常见的酸性氧化物,与
是一种常见的酸性氧化物,与 类似,可与强碱反应,写出
类似,可与强碱反应,写出 与
与 溶液反应的化学方程式:
溶液反应的化学方程式:(4)“氧化”时,可观察到的现象为
 溶液过量,则滤液B中的溶质除了
溶液过量,则滤液B中的溶质除了 外,还有
外,还有 溶液不够,则制得的铁红中可能含有的杂质为
溶液不够,则制得的铁红中可能含有的杂质为
您最近一年使用:0次
2024-02-03更新
|
87次组卷
|
2卷引用:陕西省商洛市2023-2024学年高一上学期期末统测化学试题
名校
2 . 水处理包括水的净化、杀菌消毒等。其中常见的杀菌消毒剂包括氯气、漂白粉、高铁酸钾等。
(一)氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)新制氯水中含有的离子有______ ,向其中滴入紫色石蕊试液,可以看到的现象为_____ 。
(2)新制饱和氯水经光照后,其pH值会________ (填“增大”或“减小”)。
(3)工业用氯气和石灰乳反应制备________ ,可用作棉、麻、织物的漂白,可用于游泳池水等的杀菌消毒。
(二)某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,该厂用此废金属屑制取新型高效水处理剂Na2FeO4(高铁酸钠)等产品的过程如下:
Ⅰ.向废金属屑中加入过量的NaOH溶液,充分反应后过滤;
Ⅱ.向Ⅰ所得固体中加入过量稀H2SO4,充分反应后过滤;
Ⅲ.向Ⅱ所得固体中继续加入热的稀H2SO4,同时不断鼓入空气,固体溶解得CuSO4溶液;
Ⅳ..……
(4)步骤Ⅰ中发生的单质溶解的化学反应方程式为_________________ 。
(5)步骤Ⅱ所得硫酸亚铁滤液经进一步处理可制得Na2FeO4,流程如下:

该流程中使用的两种氧化剂,理论上按反应顺序消耗两者的物质的量之比为____________ 。
(6)从步骤Ⅲ中的CuSO4溶液里获得CuSO4·5H2O的方法为____________ 、____________ 、过滤、洗涤、干燥。
(一)氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)新制氯水中含有的离子有
(2)新制饱和氯水经光照后,其pH值会
(3)工业用氯气和石灰乳反应制备
(二)某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,该厂用此废金属屑制取新型高效水处理剂Na2FeO4(高铁酸钠)等产品的过程如下:
Ⅰ.向废金属屑中加入过量的NaOH溶液,充分反应后过滤;
Ⅱ.向Ⅰ所得固体中加入过量稀H2SO4,充分反应后过滤;
Ⅲ.向Ⅱ所得固体中继续加入热的稀H2SO4,同时不断鼓入空气,固体溶解得CuSO4溶液;
Ⅳ..……
(4)步骤Ⅰ中发生的单质溶解的化学反应方程式为
(5)步骤Ⅱ所得硫酸亚铁滤液经进一步处理可制得Na2FeO4,流程如下:

该流程中使用的两种氧化剂,理论上按反应顺序消耗两者的物质的量之比为
(6)从步骤Ⅲ中的CuSO4溶液里获得CuSO4·5H2O的方法为
您最近一年使用:0次
3 . 钠的化合物在日常生活中的应用非常广泛。回答下列问题:
Ⅰ.为了测定Na2CO3和NaHCO3的混合物中Na2CO3的质量分数,某同学用如下实验装置完成实验。
(1)实验前首先要进行的操作是_______ 。
(2)某同学称取65.4 g混合物于锥形瓶中,打开止水夹,通入N2,一段时间后,关闭止水夹,打开旋塞,当锥形瓶中没有气泡生成时,关闭旋塞,再次打开止水夹,通入一段时间N2。停止通N2,装置C的质量增加30.8 g。
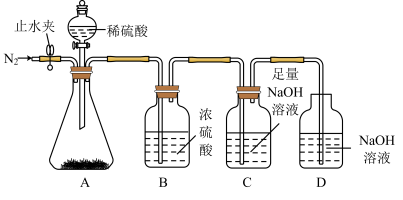
①两次通入N2的目的分别是_______ 、_______ 。
②混合物中Na2CO3的物质的量为_______ mol。
Ⅱ.侯德榜“联合制碱法”将制碱技术发展到一个新的水平。该工艺以氯化钠为原料制取纯碱,主要流程如图所示(部分物质已略去)。
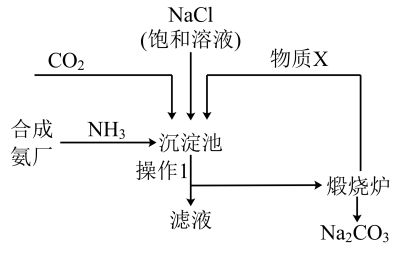
资料:沉淀池中的反应为NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl。
(3)操作1的名称为_______ ;煅烧炉中反应的化学方程式为_______ 。
(4)物质X可循环利用,其化学式为_______ 。
(5)工业可用纯碱代替烧碱生产某些化工产品,如用饱和纯碱溶液与Cl2反应可制得一种在生产、生活中常用于漂白、消毒的物质,同时有NaHCO3生成,该反应的化学方程式是_______ 。
(6)某同学提出制得的纯碱中可能含有氯化钠,请设计实验鉴别:_______ (写出步骤、现象和结论)。
Ⅰ.为了测定Na2CO3和NaHCO3的混合物中Na2CO3的质量分数,某同学用如下实验装置完成实验。
(1)实验前首先要进行的操作是
(2)某同学称取65.4 g混合物于锥形瓶中,打开止水夹,通入N2,一段时间后,关闭止水夹,打开旋塞,当锥形瓶中没有气泡生成时,关闭旋塞,再次打开止水夹,通入一段时间N2。停止通N2,装置C的质量增加30.8 g。

①两次通入N2的目的分别是
②混合物中Na2CO3的物质的量为
Ⅱ.侯德榜“联合制碱法”将制碱技术发展到一个新的水平。该工艺以氯化钠为原料制取纯碱,主要流程如图所示(部分物质已略去)。

资料:沉淀池中的反应为NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl。
(3)操作1的名称为
(4)物质X可循环利用,其化学式为
(5)工业可用纯碱代替烧碱生产某些化工产品,如用饱和纯碱溶液与Cl2反应可制得一种在生产、生活中常用于漂白、消毒的物质,同时有NaHCO3生成,该反应的化学方程式是
(6)某同学提出制得的纯碱中可能含有氯化钠,请设计实验鉴别:
您最近一年使用:0次
名校
解题方法
4 . 铁泥(主要成分为 ,还含有少量杂质:杂质与酸不反应,且难溶于水)是一种常见的工业废料,为了减少污染并变废为宝,工程师设计了如下两种不同的工艺(部分步骤已略去),用于生产七水合硫酸亚铁(
,还含有少量杂质:杂质与酸不反应,且难溶于水)是一种常见的工业废料,为了减少污染并变废为宝,工程师设计了如下两种不同的工艺(部分步骤已略去),用于生产七水合硫酸亚铁( )或柠檬酸铁铵。
)或柠檬酸铁铵。

(1)过程Ⅰ:
① 与硫酸反应的离子方程式为
与硫酸反应的离子方程式为_______ 。
②分离出杂质的操作是_______ 。
(2)制备柠檬酸铁铵:
①过程Ⅱ中发生反应的离子方程式为_______ 。
②过程Ⅲ中,加入氨水后,可观察到的现象为_______ 。
(3)制备 ;
;
①过程Ⅴ中,用离子方程式说明加入铁屑的主要目的是_______ 。
②过程Ⅰ中加入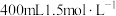 硫酸溶液至固体不再溶解,则经过程Ⅴ反应后所得溶液中
硫酸溶液至固体不再溶解,则经过程Ⅴ反应后所得溶液中 的物质的量最多为
的物质的量最多为_______ mol。
 ,还含有少量杂质:杂质与酸不反应,且难溶于水)是一种常见的工业废料,为了减少污染并变废为宝,工程师设计了如下两种不同的工艺(部分步骤已略去),用于生产七水合硫酸亚铁(
,还含有少量杂质:杂质与酸不反应,且难溶于水)是一种常见的工业废料,为了减少污染并变废为宝,工程师设计了如下两种不同的工艺(部分步骤已略去),用于生产七水合硫酸亚铁( )或柠檬酸铁铵。
)或柠檬酸铁铵。
(1)过程Ⅰ:
①
 与硫酸反应的离子方程式为
与硫酸反应的离子方程式为②分离出杂质的操作是
(2)制备柠檬酸铁铵:
①过程Ⅱ中发生反应的离子方程式为
②过程Ⅲ中,加入氨水后,可观察到的现象为
(3)制备
 ;
;①过程Ⅴ中,用离子方程式说明加入铁屑的主要目的是
②过程Ⅰ中加入
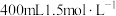 硫酸溶液至固体不再溶解,则经过程Ⅴ反应后所得溶液中
硫酸溶液至固体不再溶解,则经过程Ⅴ反应后所得溶液中 的物质的量最多为
的物质的量最多为
您最近一年使用:0次
5 . 氢溴酸(HBr)在医药和石化工业上有广泛用途。探究小组同学在实验室中按下图流程模拟工业制备氢溴酸粗品并精制:

已知:HBr、 都易挥发。回答下列问题:
都易挥发。回答下列问题:
(1)实验室中利用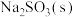 和70%的硫酸制取
和70%的硫酸制取 的离子方程式为
的离子方程式为___________ 。
(2)混合①中发生反应的化学方程式为___________ ,该反应是___________ 反应(填“吸热”或“放热”)。
(3)混合②中加入 的目的是
的目的是___________ 。
(4)操作II和操作III的名称分别是___________ 、___________ 。
(5)检验操作III所得“混合溶液”中是否存在 的实验操作方法是
的实验操作方法是___________ (说明实验操作、现象及结论)。
(6)稀硫酸可用作酸性氢氧燃料电池的电解质,氢氧燃料电池的工作原理如图所示。
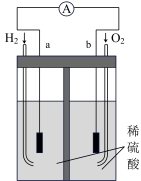
电池工作时,a电极的电极反应为___________ ,当电路中转移2mol 时,至少消耗标准状况下
时,至少消耗标准状况下
___________ L。

已知:HBr、
 都易挥发。回答下列问题:
都易挥发。回答下列问题:(1)实验室中利用
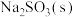 和70%的硫酸制取
和70%的硫酸制取 的离子方程式为
的离子方程式为(2)混合①中发生反应的化学方程式为
(3)混合②中加入
 的目的是
的目的是(4)操作II和操作III的名称分别是
(5)检验操作III所得“混合溶液”中是否存在
 的实验操作方法是
的实验操作方法是(6)稀硫酸可用作酸性氢氧燃料电池的电解质,氢氧燃料电池的工作原理如图所示。

电池工作时,a电极的电极反应为
 时,至少消耗标准状况下
时,至少消耗标准状况下
您最近一年使用:0次
名校
解题方法
6 . 用硫铁矿烧渣(主要成分为Fe2O3和少量SiO2)为原料可以制得绿矾(FeSO4·7H2O),其制备流程如下∶

I.配制250 mL4.8 mol/L的硫酸溶液
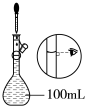
(1)配制时,除量筒、烧杯、玻璃棒和胶头滴管外,还需玻璃仪器_______ (填仪器名称)。
(2)配制时,一般可分为以下几个步骤∶①量取②计算③稀释④摇匀⑤转移⑥洗涤⑦ ⑧装瓶,贴标签。补充填写⑦操作应该是_______ 。
(3)配制时,下列操作会引起结果偏高的是_______ 。
①未洗涤烧杯、玻璃棒②容量瓶不干燥,含有少量蒸馏水 ③定容时俯视标线
④定容时仰视标线⑤超过刻度线,吸出一部分水 ⑥摇匀后液面下降,补充水
II.绿矾的制备流程图中
(4)滤渣的主要化学成分是_______ (填化学式)。
(5)操作I、II、III是同一分离操作,该操作为_______ 。
(6)绿矾长期放置于空气中会变质,将绿矾溶于水后,加入试剂_______ (填名称),观察现象,可判断是否变质。写出反应的离子方程式:_______ 。

I.配制250 mL4.8 mol/L的硫酸溶液
(1)配制时,除量筒、烧杯、玻璃棒和胶头滴管外,还需玻璃仪器
(2)配制时,一般可分为以下几个步骤∶①量取②计算③稀释④摇匀⑤转移⑥洗涤⑦ ⑧装瓶,贴标签。补充填写⑦操作应该是
(3)配制时,下列操作会引起结果偏高的是
①未洗涤烧杯、玻璃棒②容量瓶不干燥,含有少量蒸馏水 ③定容时俯视标线
④定容时仰视标线⑤超过刻度线,吸出一部分水 ⑥摇匀后液面下降,补充水
II.绿矾的制备流程图中
(4)滤渣的主要化学成分是
(5)操作I、II、III是同一分离操作,该操作为
(6)绿矾长期放置于空气中会变质,将绿矾溶于水后,加入试剂
您最近一年使用:0次
名校
7 . 某工业废水中含有大量的Cu2+、Fe3+、Fe2+和 ,拟从该废水中回收金属铜并制得绿矾(FeSO4·7H2O),工艺流程如下图:
,拟从该废水中回收金属铜并制得绿矾(FeSO4·7H2O),工艺流程如下图:
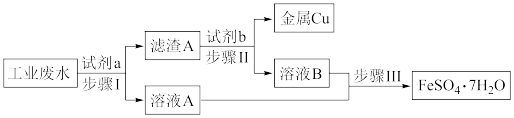
(1)下列叙述正确的是___________。
(2)步骤Ⅰ发生反应的离子方程式为Fe+Cu2+=Fe2++Cu和___________ 。
(3)取2mL溶液A于试管中,滴加少量NaOH溶液,观察到的实验现象是___________ 。
(4)获得的绿矾晶体(FeSO4·7H2O)可能有部分被氧化,请设计检验方案验证(操作、现象、结论)___________ 。
(5)已知:3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g)。虚线框处宜选择的装置是
Fe3O4(s)+4H2(g)。虚线框处宜选择的装置是___________ (填“甲”或“乙”)。
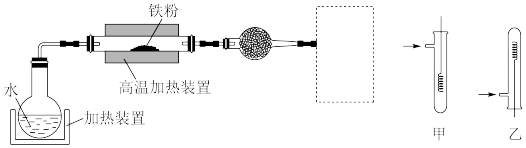
 ,拟从该废水中回收金属铜并制得绿矾(FeSO4·7H2O),工艺流程如下图:
,拟从该废水中回收金属铜并制得绿矾(FeSO4·7H2O),工艺流程如下图:
(1)下列叙述正确的是___________。
| A.滤渣A为Fe和Cu的混合物 |
| B.试剂b为盐酸 |
| C.步骤Ⅱ可以分离出Cu,并能得到FeSO4溶液 |
| D.步骤Ⅲ为蒸发溶液 |
(3)取2mL溶液A于试管中,滴加少量NaOH溶液,观察到的实验现象是
(4)获得的绿矾晶体(FeSO4·7H2O)可能有部分被氧化,请设计检验方案验证(操作、现象、结论)
(5)已知:3Fe(s)+4H2O(g)
 Fe3O4(s)+4H2(g)。虚线框处宜选择的装置是
Fe3O4(s)+4H2(g)。虚线框处宜选择的装置是
您最近一年使用:0次
2022-02-20更新
|
150次组卷
|
2卷引用:浙江省桐乡市高级中学2021-2022学年高一12月阶段教学质量检测化学试题
名校
解题方法
8 . 浩瀚的海洋约占地球表面积的71%,它是一个巨大的宝藏。海水中水储量约为1.3×1018吨,约占地球上总水量的97%。
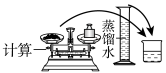
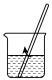
(1)海水淡化主要有蒸馏法。实验室进行水蒸馏的装置有___ (选填必要装置的序号)。
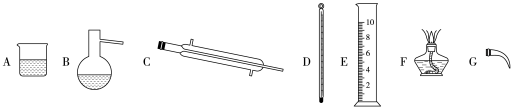
(2)某苦卤水中主要含有Mg2+、SO 、K+、Cl-等。根据图中的溶解度曲线判断,从中获得K2SO4晶体的最佳方案是先加入适量
、K+、Cl-等。根据图中的溶解度曲线判断,从中获得K2SO4晶体的最佳方案是先加入适量____ 试剂,过滤,然后,冷却结晶,析出晶体。所得晶体中含有少量KCl杂质,简述检验其中Cl-的实验操作与现象__ 。
(3)海藻中富含碘元素,实验室模拟海藻提取KI的流程如图:

在灼烧、溶解、过滤、蒸发四个步骤中,均要使用到的一种实验仪器为___ 。
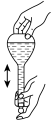
(4)配制100mL0.2mol/LKI溶液的操作如下,请正确排序___ (填数字序号)。
(1)海水淡化主要有蒸馏法。实验室进行水蒸馏的装置有

(2)某苦卤水中主要含有Mg2+、SO
 、K+、Cl-等。根据图中的溶解度曲线判断,从中获得K2SO4晶体的最佳方案是先加入适量
、K+、Cl-等。根据图中的溶解度曲线判断,从中获得K2SO4晶体的最佳方案是先加入适量
(3)海藻中富含碘元素,实验室模拟海藻提取KI的流程如图:

在灼烧、溶解、过滤、蒸发四个步骤中,均要使用到的一种实验仪器为
(4)配制100mL0.2mol/LKI溶液的操作如下,请正确排序
 |  |  |  |  |  |
| ① | ② | ③ | ④ | ⑤ | ⑥ |
您最近一年使用:0次
2021-12-02更新
|
100次组卷
|
2卷引用:陕西省西安市铁一中学2021-2022学年上学期高一上学期期中化学试题
解题方法
9 . 铁的化合物有广泛的应用,如碳酸亚铁(FeCO3)可以作为补血剂,铁红可以作为颜料。工业上可以利用硫酸厂产生的烧渣(主要成分含Fe2O3、FeO,还有一定量的SiO2)制备碳酸亚铁的工艺流程如图所示:
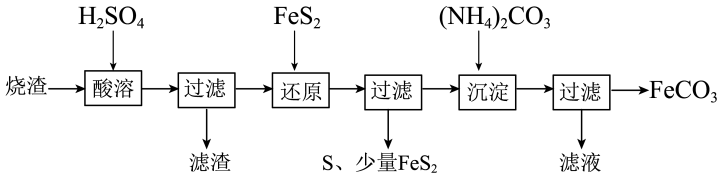
(1)“酸溶”时加快反应速率的方法有___________ (任写一种)。
(2)还原剂FeS2中铁元素的化合价为___________ ,已知“还原”时,FeS2与H2SO4不反应,Fe3+通过两个反应被还原,其中一个反应为FeS2+14Fe3++8H2O=15Fe2++2 +16H+,另一个反应中FeS2中硫元素全部转化为淡黄色沉淀,则相应的离子方程式为
+16H+,另一个反应中FeS2中硫元素全部转化为淡黄色沉淀,则相应的离子方程式为___________ 。
(3)FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色Fe(OH)3,同时释放出CO2,则与FeCO3反应的物质有___________ (填化学式)。
(4)为得到较为纯净的FeCO3需对所得产品进行多次洗涤操作,请简要描述洗涤FeCO3的基本操作___________ 。
(5)取一定质量的FeCO3样品将其溶于适量稀盐酸中制得FeCl2溶液,若想检验在溶解的过程中是有铁元素被氧化,可加入的检验试剂是___________ (填试剂名称),可观察到的现象有___________ 。

(1)“酸溶”时加快反应速率的方法有
(2)还原剂FeS2中铁元素的化合价为
 +16H+,另一个反应中FeS2中硫元素全部转化为淡黄色沉淀,则相应的离子方程式为
+16H+,另一个反应中FeS2中硫元素全部转化为淡黄色沉淀,则相应的离子方程式为(3)FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色Fe(OH)3,同时释放出CO2,则与FeCO3反应的物质有
(4)为得到较为纯净的FeCO3需对所得产品进行多次洗涤操作,请简要描述洗涤FeCO3的基本操作
(5)取一定质量的FeCO3样品将其溶于适量稀盐酸中制得FeCl2溶液,若想检验在溶解的过程中是有铁元素被氧化,可加入的检验试剂是
您最近一年使用:0次
10 . 我国某现代化铜冶炼厂排放的废水中含有较多的 、
、 、
、 、
、 和少量的
和少量的 ,为了减少污染并变废为宝,该铜冶炼厂以该废水为原料制备硫酸钠、硫酸亚铁晶体(
,为了减少污染并变废为宝,该铜冶炼厂以该废水为原料制备硫酸钠、硫酸亚铁晶体( )并回收金属铜,设计了如下流程(流程中加入的试剂均过量)。
)并回收金属铜,设计了如下流程(流程中加入的试剂均过量)。

已知:加入的试剂①为 溶液。
溶液。
回答下列问题:
(1)操作a的名称为___________ ;溶液A中所含的溶质主要为___________ (填化学式)。
(2)加入的试剂③为___________ (填试剂名称)。
(3)检验溶液D中的金属阳离子的具体操作及现象为___________ ,写出检验过程中属于氧化还原反应的离子方程式:___________ 。
(4)若取2mL溶液G加入试管中,然后滴加氢氧化钠溶液,可观察到的现象为___________ ,此现象中涉及的氧化还原反应的化学方程式为___________ 。
 、
、 、
、 、
、 和少量的
和少量的 ,为了减少污染并变废为宝,该铜冶炼厂以该废水为原料制备硫酸钠、硫酸亚铁晶体(
,为了减少污染并变废为宝,该铜冶炼厂以该废水为原料制备硫酸钠、硫酸亚铁晶体( )并回收金属铜,设计了如下流程(流程中加入的试剂均过量)。
)并回收金属铜,设计了如下流程(流程中加入的试剂均过量)。
已知:加入的试剂①为
 溶液。
溶液。回答下列问题:
(1)操作a的名称为
(2)加入的试剂③为
(3)检验溶液D中的金属阳离子的具体操作及现象为
(4)若取2mL溶液G加入试管中,然后滴加氢氧化钠溶液,可观察到的现象为
您最近一年使用:0次



