解题方法
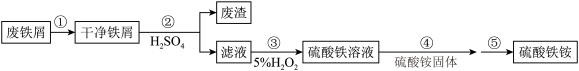
1 . 硫酸铁铵晶体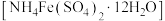 是一种重要铁盐.为充分利用资源,变废为宝,在实验室中采用废铁屑来制备硫酸铁铵,具体流程如下:
是一种重要铁盐.为充分利用资源,变废为宝,在实验室中采用废铁屑来制备硫酸铁铵,具体流程如下:
回答下列问题:
(1) 中
中 元素的化合价为
元素的化合价为____________ 。
(2)步骤②的离子反应方程式为____________ ,分离废渣的操作是____________ 。
(3)步骤③发生的氧化还原反应中,氧化剂与还原剂的物质的量之比为____________ 。
(4)步骤⑤的具体操作有蒸发浓缩、____________ 、过滤洗涤,经干燥得到硫酸铁铵晶体。
(5)人体主要吸收 ,因此常以
,因此常以 做补铁剂,但其中
做补铁剂,但其中 常因保存不善而氧化为
常因保存不善而氧化为 。请你设计实验对市售某种
。请你设计实验对市售某种 补铁药片进行检测,判断其是否氧化变质。
补铁药片进行检测,判断其是否氧化变质。
某补铁口服液中的 含量为
含量为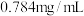 ,则该补铁口服液中
,则该补铁口服液中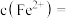
____________  。
。
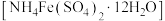 是一种重要铁盐.为充分利用资源,变废为宝,在实验室中采用废铁屑来制备硫酸铁铵,具体流程如下:
是一种重要铁盐.为充分利用资源,变废为宝,在实验室中采用废铁屑来制备硫酸铁铵,具体流程如下:
回答下列问题:
(1)
 中
中 元素的化合价为
元素的化合价为(2)步骤②的离子反应方程式为
(3)步骤③发生的氧化还原反应中,氧化剂与还原剂的物质的量之比为
(4)步骤⑤的具体操作有蒸发浓缩、
(5)人体主要吸收
 ,因此常以
,因此常以 做补铁剂,但其中
做补铁剂,但其中 常因保存不善而氧化为
常因保存不善而氧化为 。请你设计实验对市售某种
。请你设计实验对市售某种 补铁药片进行检测,判断其是否氧化变质。
补铁药片进行检测,判断其是否氧化变质。| 实验步骤 | 实验现象 | 实验结论 |
步骤1:取市售 药片于烧杯中,加入适量蒸馏水。 药片于烧杯中,加入适量蒸馏水。 | 药片溶解 | |
| 步骤2:取少量步骤1所得溶液于试管,滴加几滴 | 该药片已变质。 |
 含量为
含量为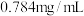 ,则该补铁口服液中
,则该补铁口服液中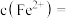
 。
。
您最近一年使用:0次
解题方法
2 . 某硫酸厂用硫铁矿焙烧后的烧渣(主要成分为 、
、 、
、 ,不考虑其他杂质)制备绿矾粗产品
,不考虑其他杂质)制备绿矾粗产品 的流程如下:
的流程如下: 是酸性氧化物。
是酸性氧化物。
回答下列问题:
(1)流程中两次“操作”的名称是________ 。
(2)“还原”步骤中溶液由黄色变浅绿色,写出溶液变浅绿色的离子方程式________ 。
(3)“调pH至5-6”步骤中,写出生成 的离子方程式
的离子方程式________ 。
(4)鉴别滤液a中金属阳离子的实验方案如下,按要求填空:
 、
、 、
、 ,不考虑其他杂质)制备绿矾粗产品
,不考虑其他杂质)制备绿矾粗产品 的流程如下:
的流程如下:
 是酸性氧化物。
是酸性氧化物。回答下列问题:
(1)流程中两次“操作”的名称是
(2)“还原”步骤中溶液由黄色变浅绿色,写出溶液变浅绿色的离子方程式
(3)“调pH至5-6”步骤中,写出生成
 的离子方程式
的离子方程式(4)鉴别滤液a中金属阳离子的实验方案如下,按要求填空:
操作 | 现象 | 结论或离子方程式 |
| 步骤1:取少量滤液a进行① | 火焰呈② | 滤液a中含有 。 。 |
| 步骤2:另取少量滤液a于试管中,依次滴入③ | 溶液先无红色,后变红色。 | 滤液a中含有 ,不含 ,不含 。写出该过程中属于氧化还原反应的离子方程式④ 。写出该过程中属于氧化还原反应的离子方程式④ |
您最近一年使用:0次
2024-01-22更新
|
95次组卷
|
2卷引用:广东省深圳市光明区2023-2024学年高一上学期期末考试化学试题
名校
3 . 高锰酸钾生产过程中产生的废锰渣(主要成分为MnO2、KOH和Fe2O3)可用于制备MnSO4晶体,工艺流程如下:
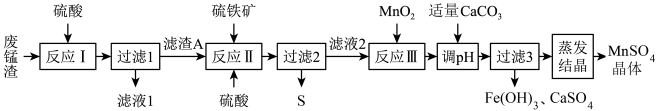
已知:硫铁矿的主要成分为二硫化亚铁(FeS2,杂质不参与反应)。
回答下列问题:
(1)二硫化亚铁中S元素的化合价为___________ 。
(2)滤渣A的主要成分是___________ (填化学式)。
(3)“反应III”中还原剂和氧化剂物质的量之比为___________ ;加入MnO2作为氧化剂的优点是___________ ;
(4)“调pH"时,验证Fe2+已经沉淀完全的实验操作和现象为___________ ;
(5)“蒸发结晶”时,应在___________ 时停止加热。

已知:硫铁矿的主要成分为二硫化亚铁(FeS2,杂质不参与反应)。
回答下列问题:
(1)二硫化亚铁中S元素的化合价为
(2)滤渣A的主要成分是
(3)“反应III”中还原剂和氧化剂物质的量之比为
(4)“调pH"时,验证Fe2+已经沉淀完全的实验操作和现象为
(5)“蒸发结晶”时,应在
您最近一年使用:0次
名校
4 . 铁及其化合物在日常生产生活中应用广泛,研究铁及其化合物的应用意义重大。
(1)所含铁元素只有还原性的物质是___________。
(2)当人体缺铁时,往往需要吃补铁保健品。人体能够吸收的是+2价的铁,但是+2价的铁很容易被氧化。
①如何检验某固体补铁剂中铁元素已被氧化?写出操作过程、现象及结论。
答:研细后用盐酸溶解,___________ 。
②服用维生素C,可使食物中的三价铁离子转化为二价铁离子。由此可推知,维生素C具有___________ (填化学性质)。
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、C1O-、OH-、FeO 、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:
、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:___________
______Fe(OH)3+_______ClO-+_______=_______FeO +_______Cl-+_______
+_______Cl-+_______
(4)工业上用氯化铁腐蚀铜箔、制造电路板。某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:

回答下列问题:
①试剂a是___________ ,操作I用到的玻璃仪器有烧杯、玻璃棒和___________ 。
②滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为___________ 。
③上述流程中操作Ⅲ包括:蒸发浓缩、___________ 、过滤、洗涤。
(1)所含铁元素只有还原性的物质是___________。
| A.Fe | B.FeCl2 | C.FeCl3 | D.Fe2O3 |
(2)当人体缺铁时,往往需要吃补铁保健品。人体能够吸收的是+2价的铁,但是+2价的铁很容易被氧化。
①如何检验某固体补铁剂中铁元素已被氧化?写出操作过程、现象及结论。
答:研细后用盐酸溶解,
②服用维生素C,可使食物中的三价铁离子转化为二价铁离子。由此可推知,维生素C具有
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、C1O-、OH-、FeO
 、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:
、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:______Fe(OH)3+_______ClO-+_______=_______FeO
 +_______Cl-+_______
+_______Cl-+_______(4)工业上用氯化铁腐蚀铜箔、制造电路板。某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:

回答下列问题:
①试剂a是
②滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为
③上述流程中操作Ⅲ包括:蒸发浓缩、
您最近一年使用:0次
名校
5 . 某工业胶料(主要成分为 、
、 、
、 及少量
及少量 ;
; 为两性氧化物),为了减少污染并变废为宝,工程师设计了如下两种不同的工艺(部分步骤已略去),用于生产七水合硫酸亚铁(
为两性氧化物),为了减少污染并变废为宝,工程师设计了如下两种不同的工艺(部分步骤已略去),用于生产七水合硫酸亚铁( )或柠檬酸铁铵。
)或柠檬酸铁铵。
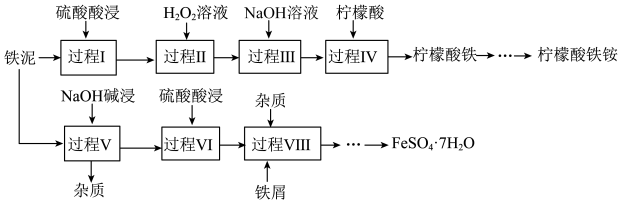
(1)碱浸。
①过程III中, 和
和 与过最
与过最 溶液反应的离子方程式分别为
溶液反应的离子方程式分别为___________________ 、__________________ 、_______________________ 。
②过程V中,发生反应的离子方程式为________________________ 。
③过程III和过程V分离出杂质的操作是___________________________ 。
(2)制各柠檬酸铁铵。
①补全过程Ⅱ中发生反应的离子方程式:________
 。
。
②过程II中,加入 溶液后,可观察到的现象为
溶液后,可观察到的现象为____________________ 。
(3)制备 。
。
①过程VIII中,用离子方程式说明加入铁屑的主要目的是______________________________ 。
②若过程V中 恰好反应完全,则在过程VI中加入
恰好反应完全,则在过程VI中加入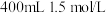 硫酸至固体不再溶解,且酸浸液全部用于制备硫酸亚铁,则经过程VI反应后,所得溶液中
硫酸至固体不再溶解,且酸浸液全部用于制备硫酸亚铁,则经过程VI反应后,所得溶液中 的物质的量最多为
的物质的量最多为__________  。
。
(4)应用。
向酸性含铬废水中加入 ,可将有害的
,可将有害的 (
( 元素为
元素为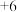 价)转化为
价)转化为 ,写出离子方程式:
,写出离子方程式:___________________________ 。然后调节 ,过滤,可将废水中的
,过滤,可将废水中的 除去。
除去。
 、
、 、
、 及少量
及少量 ;
; 为两性氧化物),为了减少污染并变废为宝,工程师设计了如下两种不同的工艺(部分步骤已略去),用于生产七水合硫酸亚铁(
为两性氧化物),为了减少污染并变废为宝,工程师设计了如下两种不同的工艺(部分步骤已略去),用于生产七水合硫酸亚铁( )或柠檬酸铁铵。
)或柠檬酸铁铵。
(1)碱浸。
①过程III中,
 和
和 与过最
与过最 溶液反应的离子方程式分别为
溶液反应的离子方程式分别为②过程V中,发生反应的离子方程式为
③过程III和过程V分离出杂质的操作是
(2)制各柠檬酸铁铵。
①补全过程Ⅱ中发生反应的离子方程式:
 。
。②过程II中,加入
 溶液后,可观察到的现象为
溶液后,可观察到的现象为(3)制备
 。
。①过程VIII中,用离子方程式说明加入铁屑的主要目的是
②若过程V中
 恰好反应完全,则在过程VI中加入
恰好反应完全,则在过程VI中加入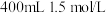 硫酸至固体不再溶解,且酸浸液全部用于制备硫酸亚铁,则经过程VI反应后,所得溶液中
硫酸至固体不再溶解,且酸浸液全部用于制备硫酸亚铁,则经过程VI反应后,所得溶液中 的物质的量最多为
的物质的量最多为 。
。(4)应用。
向酸性含铬废水中加入
 ,可将有害的
,可将有害的 (
( 元素为
元素为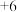 价)转化为
价)转化为 ,写出离子方程式:
,写出离子方程式: ,过滤,可将废水中的
,过滤,可将废水中的 除去。
除去。
您最近一年使用:0次
解题方法
6 . 为将某部分被氧化的废铜屑[主要含Cu、CuO、 ]转化为铜单质,同时制备绿矾(
]转化为铜单质,同时制备绿矾( ),某实验小组设计如图所示流程.
),某实验小组设计如图所示流程.

回答下列问题:
(1)“浸泡”时,Cu发生反应的离子方程式为______ , 的作用为
的作用为______ .
(2)“滤液1”中所含溶质的主要成分为______ .
(3)“分铜”时的操作名称是______ .
(4)“滤液2”容易被空气中的氧气氧化,长时间保存“滤液2”时需向其中加入一定量______ .
(5)向“滤液2”中滴加NaOH溶液,观察到的实验现象为______ ;发生反应的化学方程式为______ 和______ .
 ]转化为铜单质,同时制备绿矾(
]转化为铜单质,同时制备绿矾( ),某实验小组设计如图所示流程.
),某实验小组设计如图所示流程.
回答下列问题:
(1)“浸泡”时,Cu发生反应的离子方程式为
 的作用为
的作用为(2)“滤液1”中所含溶质的主要成分为
(3)“分铜”时的操作名称是
(4)“滤液2”容易被空气中的氧气氧化,长时间保存“滤液2”时需向其中加入一定量
(5)向“滤液2”中滴加NaOH溶液,观察到的实验现象为
您最近一年使用:0次
2023-12-22更新
|
124次组卷
|
2卷引用:河南省(驻马店)青桐鸣联考2023-2024学年高一上学期12月月考化学试题
名校
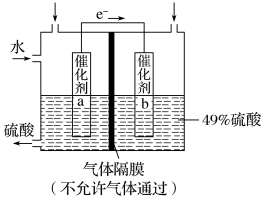
7 . I.如图是利用电化学装置将SO2转化为重要的化工原料H2SO4的原理示意图。
请回答下列问题:
(1)该装置将_______ 能转化为______ 能。
(2)催化剂b表面O2发生_______ 反应,其附近溶液酸性______ (填“增强”、“不变”或“减弱”)。
(3)催化剂a表面的电极反应式:_______ 。
II.某废料铁泥主要成分是Fe2O3、FeO和Fe,其他杂质不与硫酸反应。实验室用该废料提取Fe2O3,设计实验流程如图:

(4)步骤(I)充分反应后进行的实验操作名称是______ 。
(5)步骤(II)中加入H2O2溶液后需要适当加热但温度不能过高,原因是______ 。
(6)为了检验溶液B中是否有亚铁离子剩余,有同学提出只需要取少量溶液B于试管中并向其中滴加氢氧化钠溶液,然后观察现象即可证明。请你判断该同学的方法是否可行并说出理由______ 。
(7)步骤(III)中将NaOH溶液换成氨气也可以得到Fe(OH)3沉淀,反应的离子方程式为______ 。

请回答下列问题:
(1)该装置将
(2)催化剂b表面O2发生
(3)催化剂a表面的电极反应式:
II.某废料铁泥主要成分是Fe2O3、FeO和Fe,其他杂质不与硫酸反应。实验室用该废料提取Fe2O3,设计实验流程如图:

(4)步骤(I)充分反应后进行的实验操作名称是
(5)步骤(II)中加入H2O2溶液后需要适当加热但温度不能过高,原因是
(6)为了检验溶液B中是否有亚铁离子剩余,有同学提出只需要取少量溶液B于试管中并向其中滴加氢氧化钠溶液,然后观察现象即可证明。请你判断该同学的方法是否可行并说出理由
(7)步骤(III)中将NaOH溶液换成氨气也可以得到Fe(OH)3沉淀,反应的离子方程式为
您最近一年使用:0次
2023-05-19更新
|
714次组卷
|
2卷引用:贵州省遵义市仁怀市高中教育联盟2022-2023学年高一下学期5月期中考试化学试题
名校
8 . I.某校化学一兴趣小组在社会实践活动中,考察了当地某工厂的废水(无色)处理流程,并取该厂未经处理的废水样品进行实验分析。

已知: 固体难溶于硝酸。
固体难溶于硝酸。
(1)取少量废水,向其中滴入紫色石蕊试液,溶液变红,该废水呈_______ (填“酸性”或“碱性”),说明废水中含有较大量的_______ (填离子符号),建议该厂用_______ (填化学式)处理废水。
(2)另取少量废水,滴加适量 溶液,有白色沉淀产生,说明该废水中一定含有的离子是
溶液,有白色沉淀产生,说明该废水中一定含有的离子是_______ ,其离子反应方程式为_______ 。
(3)已知该工厂废水中除含有以上离子外,还含有较多的 。该兴趣小组另取少量废水进行如图所示实验。开始时,试管中无明显现象,原因是
。该兴趣小组另取少量废水进行如图所示实验。开始时,试管中无明显现象,原因是_______ ;随试剂的滴加,试管中出现的现象是_______ ,该反应的离子方程式为_______ 。
Ⅱ.另一兴趣小组在实验室中尝试制备氢氧化铁胶体并探究它的性质。
(4)判断胶体的制备是否成功,可利用胶体的_______
(5)向 胶体中逐滴加入了稀
胶体中逐滴加入了稀 溶液,结果出现了一系列变化:
溶液,结果出现了一系列变化:
①先出现红褐色沉淀,原因是_______ 。
②随后沉淀溶解,此反应的离子方程式是_______ 。

已知:
 固体难溶于硝酸。
固体难溶于硝酸。(1)取少量废水,向其中滴入紫色石蕊试液,溶液变红,该废水呈
(2)另取少量废水,滴加适量
 溶液,有白色沉淀产生,说明该废水中一定含有的离子是
溶液,有白色沉淀产生,说明该废水中一定含有的离子是(3)已知该工厂废水中除含有以上离子外,还含有较多的
 。该兴趣小组另取少量废水进行如图所示实验。开始时,试管中无明显现象,原因是
。该兴趣小组另取少量废水进行如图所示实验。开始时,试管中无明显现象,原因是Ⅱ.另一兴趣小组在实验室中尝试制备氢氧化铁胶体并探究它的性质。
(4)判断胶体的制备是否成功,可利用胶体的
(5)向
 胶体中逐滴加入了稀
胶体中逐滴加入了稀 溶液,结果出现了一系列变化:
溶液,结果出现了一系列变化:①先出现红褐色沉淀,原因是
②随后沉淀溶解,此反应的离子方程式是
您最近一年使用:0次
解题方法
9 . 硫酸是化工生产中的重要试剂,在自然资源的开发利用上发挥巨大的作用。
(1)浓硫酸可用于制取 ,如何检验是否生成了
,如何检验是否生成了 ?
?_______ (简述实验操作及现象)。
(2)硫酸可用于提取碘,工业上利用海带提取 的部分流程如图所示。步骤①发生反应的离子方程式为
的部分流程如图所示。步骤①发生反应的离子方程式为_______ ,该反应体现了硫酸的_______ (填“酸性”、“氧化性”或“难挥发性”)。

(3)硫酸也可用于制备硫酸镁。以菱镁矿((主要成分为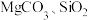
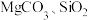 ,含少量
,含少量 )为原料制备硫酸镁的工艺流程如图所示。已知
)为原料制备硫酸镁的工艺流程如图所示。已知 熔点为
熔点为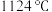 ,
, 熔点为
熔点为 。
。
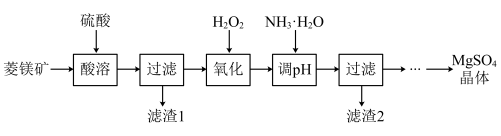
①酸溶时 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
②滤渣1、2的主要成分分别为_______ 、_______ (填化学式)。
③工业上电解法制取镁的化学方程式为_______ 。从熔点的角度说明不选 电解制取镁的原因是
电解制取镁的原因是_______ 。
(1)浓硫酸可用于制取
 ,如何检验是否生成了
,如何检验是否生成了 ?
?(2)硫酸可用于提取碘,工业上利用海带提取
 的部分流程如图所示。步骤①发生反应的离子方程式为
的部分流程如图所示。步骤①发生反应的离子方程式为
(3)硫酸也可用于制备硫酸镁。以菱镁矿((主要成分为
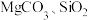
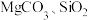 ,含少量
,含少量 )为原料制备硫酸镁的工艺流程如图所示。已知
)为原料制备硫酸镁的工艺流程如图所示。已知 熔点为
熔点为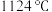 ,
, 熔点为
熔点为 。
。
①酸溶时
 发生反应的离子方程式为
发生反应的离子方程式为②滤渣1、2的主要成分分别为
③工业上电解法制取镁的化学方程式为
 电解制取镁的原因是
电解制取镁的原因是
您最近一年使用:0次
解题方法
10 . 以萃铜余液为原料制备工业活性氧化锌,其生产工艺流程如图所示:
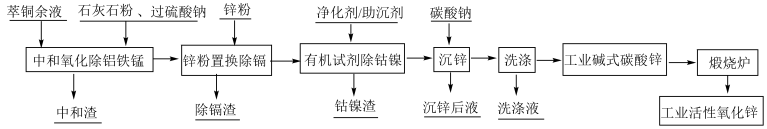
(1)铜萃余液含硫酸30~60g/L,设计采用过硫酸钠(Na2S2O8)氧化法除锰,写出Mn2+被氧化成MnO2的离子方程式_______ ;采用石灰石粉中和除去铝和铁,则中和渣中主要成分为_______ 。
(2)流程中用到最多的操作是_______ ,该操作中玻璃棒的作用是_______ 。
(3)用锌粉除镉(Cd2+ )的离子方程式为_______ ;沉锌生成碱式碳酸锌[2Zn(OH2)·ZnCO3·H2O]的化学方程式为_______ 。
(4)检验碱式碳酸锌洗涤干净的操作及现象为_______ 。
(5)煅烧炉中发生反应的化学方程式为_______ 。

(1)铜萃余液含硫酸30~60g/L,设计采用过硫酸钠(Na2S2O8)氧化法除锰,写出Mn2+被氧化成MnO2的离子方程式
(2)流程中用到最多的操作是
(3)用锌粉除镉(Cd2+ )的离子方程式为
(4)检验碱式碳酸锌洗涤干净的操作及现象为
(5)煅烧炉中发生反应的化学方程式为
您最近一年使用:0次



