名校
解题方法
1 . 化工生产中常利用硫酸厂煅烧黄铁矿石的烧渣(主要成分为 及少量
及少量 、
、 等)来制取绿矾
等)来制取绿矾 。具体制备流程如下:
。具体制备流程如下:
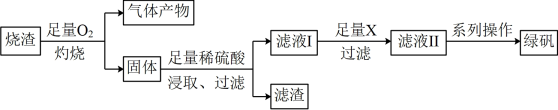
回答下列关于上述流程图中转化关系及操作的有关问题:
(1)在“灼烧”过程中发生的主要反应为: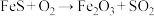 (未配平),该反应中氧化剂与还原剂的物质的量之比为
(未配平),该反应中氧化剂与还原剂的物质的量之比为___________ ,氧化产物是___________ (填化学式)。
(2)所得气体产物 属于
属于_________ (填“电解质”或“非电解质”)。技术员用氨水对“气体产物”进行吸收后再处理,可以回收 ,请你写出用过量氨水吸收
,请你写出用过量氨水吸收 时发生反应的离子方程式
时发生反应的离子方程式______ 。
(3)加入足量X时发生反应的离子方程式为:___________ 。
(4)系列操作包括:___________ 、___________ 、过滤、洗涤、干燥。
(5)绿矾保存不当容易被氧化变质,为了检验所得产品是否变质,技术人员进行了以下操作:取少量产品(绿矾)置于试管中加水溶解,向溶液中加入___________ 溶液(填化学式),发现___________ (填现象),则绿矾已经变质。
 及少量
及少量 、
、 等)来制取绿矾
等)来制取绿矾 。具体制备流程如下:
。具体制备流程如下:
回答下列关于上述流程图中转化关系及操作的有关问题:
(1)在“灼烧”过程中发生的主要反应为:
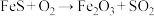 (未配平),该反应中氧化剂与还原剂的物质的量之比为
(未配平),该反应中氧化剂与还原剂的物质的量之比为(2)所得气体产物
 属于
属于 ,请你写出用过量氨水吸收
,请你写出用过量氨水吸收 时发生反应的离子方程式
时发生反应的离子方程式(3)加入足量X时发生反应的离子方程式为:
(4)系列操作包括:
(5)绿矾保存不当容易被氧化变质,为了检验所得产品是否变质,技术人员进行了以下操作:取少量产品(绿矾)置于试管中加水溶解,向溶液中加入
您最近一年使用:0次
名校
解题方法
2 . 海洋是一个巨大的化学资源宝库,而溴又被称为“海洋元素”。以海水为原料制备溴的工艺流程如图所示,请回答下列问题。
(1)海水晒盐所得的粗盐的主要成分为NaCl,还含有少量的 、
、 和
和 。将粗盐溶于水后,依次加入
。将粗盐溶于水后,依次加入__________ (填标号)后,过滤,往滤液中加入稍过量的稀盐酸,充分反应后加热除去HCl,获得精盐水。若过滤所得的滤液比较浑浊,原因可能是__________ 。
a.NaOH溶液、 溶液、
溶液、 溶液
溶液
b. 溶液、KOH溶液、
溶液、KOH溶液、 溶液
溶液
c. 溶液、
溶液、 溶液、NaOH溶液
溶液、NaOH溶液
d.KOH溶液、 溶液、
溶液、 溶液
溶液
(2)氯碱工业通过电解饱和食盐水制得烧碱、氢气和氯气,该反应的化学方程式为__________ ;步骤Ⅱ中反应的离子方程式为__________ 。
(3)往5mL溴水中,加入1mL四氯化碳,振荡、静置后,试管中的现象是__________ (填标号);往2mL淀粉碘化钾溶液中,滴加几滴溴水,观察到的现象为__________ 。
(4)下列有关说法正确的是__________(填标号)。
(1)海水晒盐所得的粗盐的主要成分为NaCl,还含有少量的
 、
、 和
和 。将粗盐溶于水后,依次加入
。将粗盐溶于水后,依次加入a.NaOH溶液、
 溶液、
溶液、 溶液
溶液b.
 溶液、KOH溶液、
溶液、KOH溶液、 溶液
溶液c.
 溶液、
溶液、 溶液、NaOH溶液
溶液、NaOH溶液d.KOH溶液、
 溶液、
溶液、 溶液
溶液(2)氯碱工业通过电解饱和食盐水制得烧碱、氢气和氯气,该反应的化学方程式为
(3)往5mL溴水中,加入1mL四氯化碳,振荡、静置后,试管中的现象是
A. B.
B. C.
C. D.
D.
(4)下列有关说法正确的是__________(填标号)。
| A.步骤Ⅰ、Ⅱ的目的是富集溴元素 |
| B.精盐水中分散质的粒子直径介于1~100nm |
C.非金属性: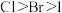 |
| D.实验室常将溴单质保存在带有橡胶塞的棕色广口瓶中,并加少量水水封 |
您最近一年使用:0次
名校
3 . 类比是化学学习的重要方法之一, 与
与 在结构和性质上有很多相似的地方。过氧化钙(
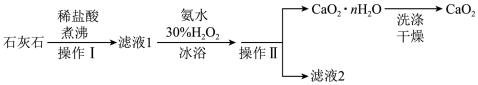
在结构和性质上有很多相似的地方。过氧化钙( )是一种难溶于水、可与水缓慢反应、能溶于酸的白色固体,广泛用于蔬保鲜、空气净化、污水处理等方面。以下是一种制备过氧化钙的实验方法。
)是一种难溶于水、可与水缓慢反应、能溶于酸的白色固体,广泛用于蔬保鲜、空气净化、污水处理等方面。以下是一种制备过氧化钙的实验方法。
已知: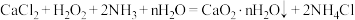 。
。
(1) 中氧元素化合价为
中氧元素化合价为___________ 。
(2) 中阳离子和阴离子的个数之比为
中阳离子和阴离子的个数之比为___________ 。
(3) 可用于长途运输鱼苗,其原因是
可用于长途运输鱼苗,其原因是___________ (用化学方程式解释)。
(4)操作Ⅰ和操作Ⅱ的名称是___________ 。
(5)操作Ⅱ可得到 沉淀,取实验得到的2.76g
沉淀,取实验得到的2.76g  粗品(含有杂质)在密闭容器中加热,其受热脱水过程的热重曲线(140℃时完全脱水,杂质受热不分解)如图所示。
粗品(含有杂质)在密闭容器中加热,其受热脱水过程的热重曲线(140℃时完全脱水,杂质受热不分解)如图所示。
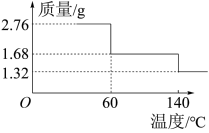
60℃时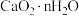 中n=
中n=___________ 。
(6)实验小组同学查阅资料知: 的氧化性强于
的氧化性强于 。设计如下实验进行验证,向
。设计如下实验进行验证,向 溶液中加入
溶液中加入 固体,振荡,向反应后的溶液中
固体,振荡,向反应后的溶液中___________ (填实验操作与现象),则证明 的氧化性强于
的氧化性强于 。
。
 与
与 在结构和性质上有很多相似的地方。过氧化钙(
在结构和性质上有很多相似的地方。过氧化钙( )是一种难溶于水、可与水缓慢反应、能溶于酸的白色固体,广泛用于蔬保鲜、空气净化、污水处理等方面。以下是一种制备过氧化钙的实验方法。
)是一种难溶于水、可与水缓慢反应、能溶于酸的白色固体,广泛用于蔬保鲜、空气净化、污水处理等方面。以下是一种制备过氧化钙的实验方法。
已知:
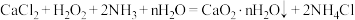 。
。(1)
 中氧元素化合价为
中氧元素化合价为(2)
 中阳离子和阴离子的个数之比为
中阳离子和阴离子的个数之比为(3)
 可用于长途运输鱼苗,其原因是
可用于长途运输鱼苗,其原因是(4)操作Ⅰ和操作Ⅱ的名称是
(5)操作Ⅱ可得到
 沉淀,取实验得到的2.76g
沉淀,取实验得到的2.76g  粗品(含有杂质)在密闭容器中加热,其受热脱水过程的热重曲线(140℃时完全脱水,杂质受热不分解)如图所示。
粗品(含有杂质)在密闭容器中加热,其受热脱水过程的热重曲线(140℃时完全脱水,杂质受热不分解)如图所示。
60℃时
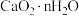 中n=
中n=(6)实验小组同学查阅资料知:
 的氧化性强于
的氧化性强于 。设计如下实验进行验证,向
。设计如下实验进行验证,向 溶液中加入
溶液中加入 固体,振荡,向反应后的溶液中
固体,振荡,向反应后的溶液中 的氧化性强于
的氧化性强于 。
。
您最近一年使用:0次
名校
解题方法
4 .  常用作催化剂、抛光剂和用于生物医药等方面,一种利用氯化铁溶液和硫脲
常用作催化剂、抛光剂和用于生物医药等方面,一种利用氯化铁溶液和硫脲 溶液制备
溶液制备 的流程如图所示,回答下列问题:
的流程如图所示,回答下列问题:

(1)实验室进行过滤操作时所用的玻璃仪器有玻璃棒、___________ ; 的俗名为
的俗名为___________ 。
(2)氯化铁溶液和硫脲溶液反应的离子方程式如下,请补全并配平下列方程式:___________ 。
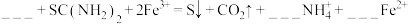
该反应的氧化剂和还原剂的物质的量之比为___________ 。
(3)检验“过滤”后所得的滤液中是否含有 的操作和现象为
的操作和现象为___________ 。
(4)要使 中的
中的 元素全部转化为
元素全部转化为 ,理论上加入的
,理论上加入的 和
和 的物质的量之比为
的物质的量之比为___________ ,实际生产过程中,硫脲的用量比理论的要多一点,原因可能是___________ 。
(5)铁与水蒸气高温反应也能制备 ,若生成
,若生成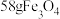 ,则生成的气体的体积为
,则生成的气体的体积为___________ L(换算成标准状况下)。
 常用作催化剂、抛光剂和用于生物医药等方面,一种利用氯化铁溶液和硫脲
常用作催化剂、抛光剂和用于生物医药等方面,一种利用氯化铁溶液和硫脲 溶液制备
溶液制备 的流程如图所示,回答下列问题:
的流程如图所示,回答下列问题:
(1)实验室进行过滤操作时所用的玻璃仪器有玻璃棒、
 的俗名为
的俗名为(2)氯化铁溶液和硫脲溶液反应的离子方程式如下,请补全并配平下列方程式:
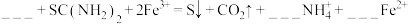
该反应的氧化剂和还原剂的物质的量之比为
(3)检验“过滤”后所得的滤液中是否含有
 的操作和现象为
的操作和现象为(4)要使
 中的
中的 元素全部转化为
元素全部转化为 ,理论上加入的
,理论上加入的 和
和 的物质的量之比为
的物质的量之比为(5)铁与水蒸气高温反应也能制备
 ,若生成
,若生成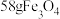 ,则生成的气体的体积为
,则生成的气体的体积为
您最近一年使用:0次
5 . Ⅰ.氧化铁是重要工业颜料,用废铁屑制备氧化铁的流程如图:
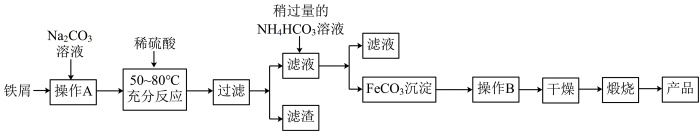
回答下列问题:
(1)检验“操作B”是否彻底的操作为_______ 。
(2)写出加入稍过量的NH4HCO3溶液得到FeCO3的离子方程式:_______ 。
(3)写出在空气中充分加热煅烧FeCO3的化学方程式:_______ 。
Ⅱ.上述流程中,若煅烧不充分,最终产品中会含有少量的FeO杂质。某同学为测定产品中Fe2O3的含量,进行如下实验:
a.称取样品8.00 g,加入足量稀H2SO4溶解,并加水稀释至100 mL;
b.量取25.00 mL待测溶液于锥形瓶中;
c.用酸化的0. 010 00 mol·L-1KMnO4标准液滴定至终点;
d.重复操作b、c 2~3次,得出消耗KMnO4溶液体积的平均值为20.00 mL。
(4)确定滴定达到终点的操作及现象为_______ 。
(5)上述样品的质量分数为_______ 。
(6)下列操作会导致样品中Fe2O3的质量分数测定结果偏低的有_______(填字母) 。

回答下列问题:
(1)检验“操作B”是否彻底的操作为
(2)写出加入稍过量的NH4HCO3溶液得到FeCO3的离子方程式:
(3)写出在空气中充分加热煅烧FeCO3的化学方程式:
Ⅱ.上述流程中,若煅烧不充分,最终产品中会含有少量的FeO杂质。某同学为测定产品中Fe2O3的含量,进行如下实验:
a.称取样品8.00 g,加入足量稀H2SO4溶解,并加水稀释至100 mL;
b.量取25.00 mL待测溶液于锥形瓶中;
c.用酸化的0. 010 00 mol·L-1KMnO4标准液滴定至终点;
d.重复操作b、c 2~3次,得出消耗KMnO4溶液体积的平均值为20.00 mL。
(4)确定滴定达到终点的操作及现象为
(5)上述样品的质量分数为
(6)下列操作会导致样品中Fe2O3的质量分数测定结果偏低的有_______(填字母) 。
| A.未干燥锥形瓶 |
| B.盛装标准液的滴定管没有用标准液润洗 |
| C.滴定开始时平视刻度线读数,滴定结束时仰视刻度线读数 |
| D.量取待测液的滴定管没有润洗 |
您最近一年使用:0次
名校
解题方法
6 . 氧化铁红颜料跟某些油料混合,可以制成防锈油漆.以黄铁矿为原料制硫酸产生的硫酸渣中含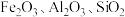 (难溶于稀硫酸),用硫酸渣制备铁红
(难溶于稀硫酸),用硫酸渣制备铁红 的过程如图:
的过程如图:

(1)“酸溶”过程中,加入过量稀硫酸充分反应后的溶液中含有的阳离子除了 ,还有
,还有____________ (填离子符号),写出 与稀硫酸反应的离子方程式:
与稀硫酸反应的离子方程式:____________ .
(2)实验室中过滤需要用到的玻璃仪器有____________ .
(3)滤渣A的主要成分是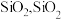 是一种常见的酸性氧化物,与
是一种常见的酸性氧化物,与 类似,可与强碱反应,写出
类似,可与强碱反应,写出 与
与 溶液反应的化学方程式:
溶液反应的化学方程式:____________ .
(4)“氧化”时,可观察到的现象为____________ .若加入的 溶液过量,则滤液B中的溶质除了
溶液过量,则滤液B中的溶质除了 外,还有
外,还有____________ (填化学式,下同);若加入的 溶液不够,则制得的铁红中可能含有的杂质为
溶液不够,则制得的铁红中可能含有的杂质为____________ .
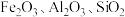 (难溶于稀硫酸),用硫酸渣制备铁红
(难溶于稀硫酸),用硫酸渣制备铁红 的过程如图:
的过程如图:
(1)“酸溶”过程中,加入过量稀硫酸充分反应后的溶液中含有的阳离子除了
 ,还有
,还有 与稀硫酸反应的离子方程式:
与稀硫酸反应的离子方程式:(2)实验室中过滤需要用到的玻璃仪器有
(3)滤渣A的主要成分是
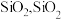 是一种常见的酸性氧化物,与
是一种常见的酸性氧化物,与 类似,可与强碱反应,写出
类似,可与强碱反应,写出 与
与 溶液反应的化学方程式:
溶液反应的化学方程式:(4)“氧化”时,可观察到的现象为
 溶液过量,则滤液B中的溶质除了
溶液过量,则滤液B中的溶质除了 外,还有
外,还有 溶液不够,则制得的铁红中可能含有的杂质为
溶液不够,则制得的铁红中可能含有的杂质为
您最近一年使用:0次
2024-02-03更新
|
87次组卷
|
2卷引用:陕西省商洛市2023-2024学年高一上学期期末统测化学试题
7 . 碳酸亚铁(FeCO3),白色固体,是菱铁矿的主要成分。难溶干水。在潮湿的空气中易被氧化,是一种重要的工业原料,常用于制备铁盐和补血剂等。如图是一种实验室制备FeCO3的流程:
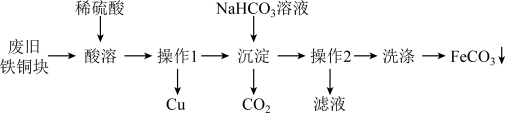
回答下列问题:
(1)废旧的铁钢表面有油行,可以用_____ (填试剂名称)溶液洗净,“酸溶时,为了加快酸溶”速率常采取的措施有____________ (写出两种)。
(2)“操作I"是____________ 。
(3)写出流程中“沉淀”时反应的离子方程式:________________ 。
(4)写出流程中“洗涤”的具体操作:_____________ 。
(5)碳酸亚铁固体在潮湿的空气中放置一段时间后呈茶色,其原因为(用化学方程式表示)__________ 。有同学认为固体呈茶色可能是含有Fe3+所致,实验室可以选用种试剂检验该离子,这种试剂是______ (填化学式)溶液。滴加这种试剂会出现__________ 现象(填实验现象)。

回答下列问题:
(1)废旧的铁钢表面有油行,可以用
(2)“操作I"是
(3)写出流程中“沉淀”时反应的离子方程式:
(4)写出流程中“洗涤”的具体操作:
(5)碳酸亚铁固体在潮湿的空气中放置一段时间后呈茶色,其原因为(用化学方程式表示)
您最近一年使用:0次
名校
解题方法
8 . I.铜和三氧化二铁在工农业生产中用途广泛,用黄铜矿(主要成分为CuFeS2,其中Cu为+2价、Fe为+2价)制取铜和三氧化二铁的工艺流程如图所示:
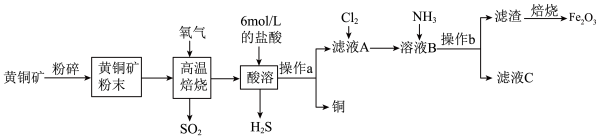
(1)将黄铜矿粉碎的目的是___________ 。
(2)高温熔烧时发生的反应是 ,
, 参加反应时,反应中转移电子
参加反应时,反应中转移电子___________  。
。
(3)操作a为___________ 。
(4)向滤液A中通入Cl2的目的是___________ 。
(5)向溶液B中通入NH3后发生反应的离子方程式为___________ 。
Ⅱ.某小组同学咨询老师,准备用亚硫酸钠溶液与浓硫酸反应来制备一定量的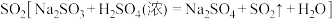 。老师给他们提供了一瓶亚硫酸钠溶液并告知该瓶溶液放置时间可能较长,不知是否变质,小组的同学分成甲、乙两小组对该瓶亚硫酸钠溶液成分进行实验探究。
。老师给他们提供了一瓶亚硫酸钠溶液并告知该瓶溶液放置时间可能较长,不知是否变质,小组的同学分成甲、乙两小组对该瓶亚硫酸钠溶液成分进行实验探究。
【提出问题】该瓶溶液中溶质成分是什么?
【查阅资料】
a.Na2SO3能与酸反应产生SO2气体
b.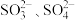 均能与Ba2+反应产生白色沉淀,BaSO3可溶于稀盐酸。
均能与Ba2+反应产生白色沉淀,BaSO3可溶于稀盐酸。
【作出猜想】猜想1:没有变质,成分是Na2SO3
猜想2:完全变质,成分是Na2SO4
猜想3:部分变质,成分是Na2SO3和Na2SO4
【实验探究】甲组设计实验探究溶液是否变质
(6)完成下列问题。
实验结论是___________ 。

(1)将黄铜矿粉碎的目的是
(2)高温熔烧时发生的反应是
 ,
, 参加反应时,反应中转移电子
参加反应时,反应中转移电子 。
。(3)操作a为
(4)向滤液A中通入Cl2的目的是
(5)向溶液B中通入NH3后发生反应的离子方程式为
Ⅱ.某小组同学咨询老师,准备用亚硫酸钠溶液与浓硫酸反应来制备一定量的
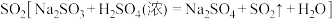 。老师给他们提供了一瓶亚硫酸钠溶液并告知该瓶溶液放置时间可能较长,不知是否变质,小组的同学分成甲、乙两小组对该瓶亚硫酸钠溶液成分进行实验探究。
。老师给他们提供了一瓶亚硫酸钠溶液并告知该瓶溶液放置时间可能较长,不知是否变质,小组的同学分成甲、乙两小组对该瓶亚硫酸钠溶液成分进行实验探究。【提出问题】该瓶溶液中溶质成分是什么?
【查阅资料】
a.Na2SO3能与酸反应产生SO2气体
b.
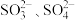 均能与Ba2+反应产生白色沉淀,BaSO3可溶于稀盐酸。
均能与Ba2+反应产生白色沉淀,BaSO3可溶于稀盐酸。【作出猜想】猜想1:没有变质,成分是Na2SO3
猜想2:完全变质,成分是Na2SO4
猜想3:部分变质,成分是Na2SO3和Na2SO4
【实验探究】甲组设计实验探究溶液是否变质
(6)完成下列问题。
| 甲组 | 实验操作 | 现象 | 结论 |
| 步骤1 | 取少量样品于试管中加入过量稀盐酸 | 产生气泡 | 容液中含有 |
| 步骤2 | 溶液中含有Na2SO4 |
实验结论是
您最近一年使用:0次
解题方法
9 . 某工厂的工业废水中含有大量的FeSO4、较多的CuSO4和少量Na2SO4,为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据下列流程图,完成回收硫酸亚铁和铜的实验方案。(可供选择的试剂为铁粉、稀H2SO4、NaOH溶液)

(1)试剂①为______ ;操作a所需要的玻璃仪器为烧杯、玻璃棒、______ 。
(2)若取2mL溶液D加入试管中,然后滴加氢氧化钠溶液,产生的现象是______ ,此现象涉及氧化还原反应的化学方程式是______ 。
(3)为防止FeSO4溶液变质,应在溶液中加入少量______ ,其原因是______ (请用离子方程式解释原因)。
(4)回收的FeSO4经一系列变化后可制的一种新型绿色净水剂高铁酸钠(Na2FeO4)。其制备原理如下,请配平离子方程式:______ 。
_____Fe3++_____ClO-+_____OH-=_____FeO +______Cl-+______H2O
+______Cl-+______H2O

(1)试剂①为
(2)若取2mL溶液D加入试管中,然后滴加氢氧化钠溶液,产生的现象是
(3)为防止FeSO4溶液变质,应在溶液中加入少量
(4)回收的FeSO4经一系列变化后可制的一种新型绿色净水剂高铁酸钠(Na2FeO4)。其制备原理如下,请配平离子方程式:
_____Fe3++_____ClO-+_____OH-=_____FeO
 +______Cl-+______H2O
+______Cl-+______H2O
您最近一年使用:0次
解题方法
10 . 某化学兴趣小组利用废铁屑(含少量 )制备还原性铁粉,从而达到资源回收利用的目的,制备流程如图所示。
)制备还原性铁粉,从而达到资源回收利用的目的,制备流程如图所示。
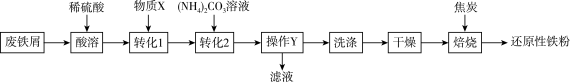
请回答下列问题:
(1)“酸溶”时,搅拌的目的是___________ 。
(2)“操作Y”为___________ (填操作名称),经过“操作Y”得到了滤渣 ,则物质X可除去过量的稀硫酸和防止
,则物质X可除去过量的稀硫酸和防止 被氧化最好为
被氧化最好为___________ 。“转化2”发生反应的离子方程式为___________ 。
(3)“洗涤”时,能证明滤渣洗涤干净的操作及现象为___________ 。
(4)麦片中常添加微量还原性铁粉,用于补充人体所需的铁元素,这些铁粉在胃酸(主要成分为盐酸)的作用下发生反应变成人体容易吸收的铁元素,发生反应的化学方程式为___________ ;人体补铁时,同时服用维生素C能促进亚铁离子被吸收,说明维生素C具有___________ (填“氧化性”或“还原性”)。
 )制备还原性铁粉,从而达到资源回收利用的目的,制备流程如图所示。
)制备还原性铁粉,从而达到资源回收利用的目的,制备流程如图所示。
请回答下列问题:
(1)“酸溶”时,搅拌的目的是
(2)“操作Y”为
 ,则物质X可除去过量的稀硫酸和防止
,则物质X可除去过量的稀硫酸和防止 被氧化最好为
被氧化最好为(3)“洗涤”时,能证明滤渣洗涤干净的操作及现象为
(4)麦片中常添加微量还原性铁粉,用于补充人体所需的铁元素,这些铁粉在胃酸(主要成分为盐酸)的作用下发生反应变成人体容易吸收的铁元素,发生反应的化学方程式为
您最近一年使用:0次



