名校
解题方法
1 . 硫酸渣是硫酸生产过程中产生的固体废料,主要化学成分有 、
、 、
、 等。
等。
I.研究人员可利用硫酸渣制备高纯度硫酸亚铁晶体,流程如下图所示:
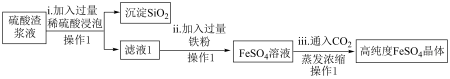
已知: 是难溶于水的酸性氧化物。
是难溶于水的酸性氧化物。
(1)操作1是______ 。
(2)步骤ii中涉及反应的离子方程式有_______ 、_________ 。
(3)步骤iii中的 的作用是
的作用是______ 。
(4)取少量高纯度 晶体配成溶液,
晶体配成溶液,_______ (操作和现象),证明该晶体中不含 。
。
Ⅱ.研究人员还可利用硫酸渣与含氯废气( 和HCl混合气)来制备絮凝剂聚合氯化铁,流程如下图所示:
和HCl混合气)来制备絮凝剂聚合氯化铁,流程如下图所示:
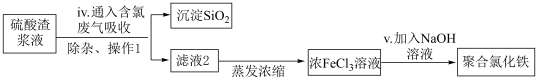
已知:聚合氯化铁的一种形式为 。
。
(5)写出以下物质中加点元素 的化合价: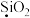
_____ ,
_____ 。
(6)下列关于步骤iv中含氯废气作用的说法中,不正确的是___________ 。
a.盐酸中 作用是使FeO、
作用是使FeO、 溶解
溶解
b.氯气参与反应的离子方程式为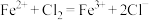
c.盐酸与氯气中的氯元素均转移到 中
中
(7)补全步骤v中涉及到反应的化学方程式______ 。
 。
。
 、
、 、
、 等。
等。I.研究人员可利用硫酸渣制备高纯度硫酸亚铁晶体,流程如下图所示:

已知:
 是难溶于水的酸性氧化物。
是难溶于水的酸性氧化物。(1)操作1是
(2)步骤ii中涉及反应的离子方程式有
(3)步骤iii中的
 的作用是
的作用是(4)取少量高纯度
 晶体配成溶液,
晶体配成溶液, 。
。Ⅱ.研究人员还可利用硫酸渣与含氯废气(
 和HCl混合气)来制备絮凝剂聚合氯化铁,流程如下图所示:
和HCl混合气)来制备絮凝剂聚合氯化铁,流程如下图所示:
已知:聚合氯化铁的一种形式为
 。
。(5)写出以下物质中
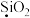

(6)下列关于步骤iv中含氯废气作用的说法中,不正确的是
a.盐酸中
 作用是使FeO、
作用是使FeO、 溶解
溶解b.氯气参与反应的离子方程式为
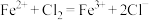
c.盐酸与氯气中的氯元素均转移到
 中
中(7)补全步骤v中涉及到反应的化学方程式
 。
。
您最近一年使用:0次
2 . 某铜冶炼厂排放的废水中含有较多的 、
、 、
、 、
、 和少量的
和少量的 ,为了减少污染并变废为宝,以该废水为原料制备硫酸钠、硫酸亚铁晶体(
,为了减少污染并变废为宝,以该废水为原料制备硫酸钠、硫酸亚铁晶体( )并回收金属铜,设计了如下流程(流程中加入的试剂均过量)。
)并回收金属铜,设计了如下流程(流程中加入的试剂均过量)。
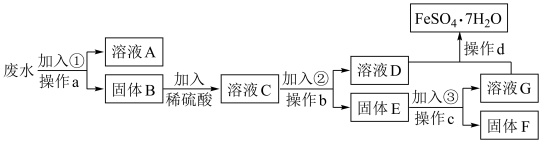
已知:加入试剂①为 溶液。回答下列问题:
溶液。回答下列问题:
(1)在实验室进行操作a的名称是___________ ;溶液A中所含的溶质主要为___________ (填化学式)。
(2)加入试剂②为___________ (填化学式);溶液C中的一种离子可与固体F反应,该反应的离子方程式为___________ 。
(3)若取2mL溶液G加入试管中,然后滴加氢氧化钠溶液,可观察到的现象为___________ ,此现象中涉及的氧化还原反应的化学方程式为___________ 。
(4)操作d为蒸发浓缩、___________ 、过滤、洗涤、干燥得到硫酸亚铁晶体,该过程中需要用到的玻璃仪器除烧杯、漏斗、酒精灯外,还有___________ 。该仪器在操作d过程中的作用是___________ 。(答出一点即可)
 、
、 、
、 、
、 和少量的
和少量的 ,为了减少污染并变废为宝,以该废水为原料制备硫酸钠、硫酸亚铁晶体(
,为了减少污染并变废为宝,以该废水为原料制备硫酸钠、硫酸亚铁晶体( )并回收金属铜,设计了如下流程(流程中加入的试剂均过量)。
)并回收金属铜,设计了如下流程(流程中加入的试剂均过量)。
已知:加入试剂①为
 溶液。回答下列问题:
溶液。回答下列问题:(1)在实验室进行操作a的名称是
(2)加入试剂②为
(3)若取2mL溶液G加入试管中,然后滴加氢氧化钠溶液,可观察到的现象为
(4)操作d为蒸发浓缩、
您最近一年使用:0次
名校
解题方法
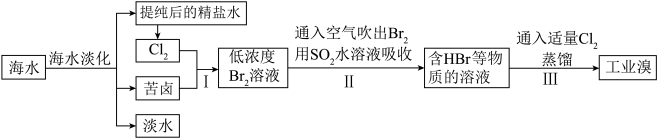
3 . 海洋是一个巨大的化学资源宝库,而溴又被称为“海洋元素”。以海水为原料制备溴的工艺流程如图所示,请回答下列问题。
(1)海水晒盐所得的粗盐的主要成分为NaCl,还含有少量的 、
、 和
和 。将粗盐溶于水后,依次加入
。将粗盐溶于水后,依次加入__________ (填标号)后,过滤,往滤液中加入稍过量的稀盐酸,充分反应后加热除去HCl,获得精盐水。若过滤所得的滤液比较浑浊,原因可能是__________ 。
a.NaOH溶液、 溶液、
溶液、 溶液
溶液
b. 溶液、KOH溶液、
溶液、KOH溶液、 溶液
溶液
c. 溶液、
溶液、 溶液、NaOH溶液
溶液、NaOH溶液
d.KOH溶液、 溶液、
溶液、 溶液
溶液
(2)氯碱工业通过电解饱和食盐水制得烧碱、氢气和氯气,该反应的化学方程式为__________ ;步骤Ⅱ中反应的离子方程式为__________ 。
(3)往5mL溴水中,加入1mL四氯化碳,振荡、静置后,试管中的现象是__________ (填标号);往2mL淀粉碘化钾溶液中,滴加几滴溴水,观察到的现象为__________ 。
(4)下列有关说法正确的是__________(填标号)。
(1)海水晒盐所得的粗盐的主要成分为NaCl,还含有少量的
 、
、 和
和 。将粗盐溶于水后,依次加入
。将粗盐溶于水后,依次加入a.NaOH溶液、
 溶液、
溶液、 溶液
溶液b.
 溶液、KOH溶液、
溶液、KOH溶液、 溶液
溶液c.
 溶液、
溶液、 溶液、NaOH溶液
溶液、NaOH溶液d.KOH溶液、
 溶液、
溶液、 溶液
溶液(2)氯碱工业通过电解饱和食盐水制得烧碱、氢气和氯气,该反应的化学方程式为
(3)往5mL溴水中,加入1mL四氯化碳,振荡、静置后,试管中的现象是
A. B.
B. C.
C. D.
D.
(4)下列有关说法正确的是__________(填标号)。
| A.步骤Ⅰ、Ⅱ的目的是富集溴元素 |
| B.精盐水中分散质的粒子直径介于1~100nm |
C.非金属性: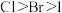 |
| D.实验室常将溴单质保存在带有橡胶塞的棕色广口瓶中,并加少量水水封 |
您最近一年使用:0次
解题方法
4 . 硫酸铁铵晶体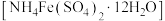 是一种重要铁盐.为充分利用资源,变废为宝,在实验室中采用废铁屑来制备硫酸铁铵,具体流程如下:
是一种重要铁盐.为充分利用资源,变废为宝,在实验室中采用废铁屑来制备硫酸铁铵,具体流程如下:
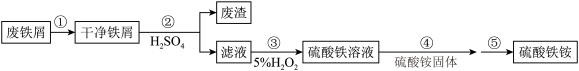
回答下列问题:
(1) 中
中 元素的化合价为
元素的化合价为____________ 。
(2)步骤②的离子反应方程式为____________ ,分离废渣的操作是____________ 。
(3)步骤③发生的氧化还原反应中,氧化剂与还原剂的物质的量之比为____________ 。
(4)步骤⑤的具体操作有蒸发浓缩、____________ 、过滤洗涤,经干燥得到硫酸铁铵晶体。
(5)人体主要吸收 ,因此常以
,因此常以 做补铁剂,但其中
做补铁剂,但其中 常因保存不善而氧化为
常因保存不善而氧化为 。请你设计实验对市售某种
。请你设计实验对市售某种 补铁药片进行检测,判断其是否氧化变质。
补铁药片进行检测,判断其是否氧化变质。
某补铁口服液中的 含量为
含量为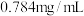 ,则该补铁口服液中
,则该补铁口服液中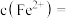
____________  。
。
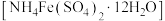 是一种重要铁盐.为充分利用资源,变废为宝,在实验室中采用废铁屑来制备硫酸铁铵,具体流程如下:
是一种重要铁盐.为充分利用资源,变废为宝,在实验室中采用废铁屑来制备硫酸铁铵,具体流程如下:
回答下列问题:
(1)
 中
中 元素的化合价为
元素的化合价为(2)步骤②的离子反应方程式为
(3)步骤③发生的氧化还原反应中,氧化剂与还原剂的物质的量之比为
(4)步骤⑤的具体操作有蒸发浓缩、
(5)人体主要吸收
 ,因此常以
,因此常以 做补铁剂,但其中
做补铁剂,但其中 常因保存不善而氧化为
常因保存不善而氧化为 。请你设计实验对市售某种
。请你设计实验对市售某种 补铁药片进行检测,判断其是否氧化变质。
补铁药片进行检测,判断其是否氧化变质。| 实验步骤 | 实验现象 | 实验结论 |
步骤1:取市售 药片于烧杯中,加入适量蒸馏水。 药片于烧杯中,加入适量蒸馏水。 | 药片溶解 | |
| 步骤2:取少量步骤1所得溶液于试管,滴加几滴 | 该药片已变质。 |
 含量为
含量为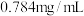 ,则该补铁口服液中
,则该补铁口服液中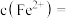
 。
。
您最近一年使用:0次
名校
5 . 高锰酸钾生产过程中产生的废锰渣(主要成分为MnO2、KOH和Fe2O3)可用于制备MnSO4晶体,工艺流程如下:
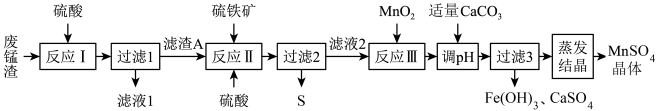
已知:硫铁矿的主要成分为二硫化亚铁(FeS2,杂质不参与反应)。
回答下列问题:
(1)二硫化亚铁中S元素的化合价为___________ 。
(2)滤渣A的主要成分是___________ (填化学式)。
(3)“反应III”中还原剂和氧化剂物质的量之比为___________ ;加入MnO2作为氧化剂的优点是___________ ;
(4)“调pH"时,验证Fe2+已经沉淀完全的实验操作和现象为___________ ;
(5)“蒸发结晶”时,应在___________ 时停止加热。

已知:硫铁矿的主要成分为二硫化亚铁(FeS2,杂质不参与反应)。
回答下列问题:
(1)二硫化亚铁中S元素的化合价为
(2)滤渣A的主要成分是
(3)“反应III”中还原剂和氧化剂物质的量之比为
(4)“调pH"时,验证Fe2+已经沉淀完全的实验操作和现象为
(5)“蒸发结晶”时,应在
您最近一年使用:0次
23-24高一上·全国·期中
名校
解题方法
6 . 钠的化合物在日常生活中的应用非常广泛。回答下列问题:
Ⅰ.为了测定Na2CO3和NaHCO3的混合物中Na2CO3的质量分数,某同学用如下实验装置完成实验。
(1)实验前首先要进行的操作是___________ 。
(2)某同学称取65.4 g混合物于锥形瓶中,打开止水夹,通入N2,一段时间后,关闭止水夹,打开旋塞,当锥形瓶中没有气泡生成时,关闭旋塞,再次打开止水夹,通入一段时间N2。停止通N2,装置C的质量增加30.8 g。
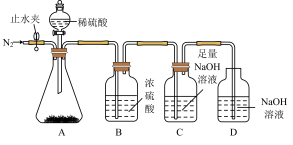
①两次通入N2的目的分别是___________ 、___________ 。
②混合物中Na2CO3的物质的量为___________ mol。
Ⅱ.侯德榜“联合制碱法”将制碱技术发展到一个新的水平。该工艺以氯化钠为原料制取纯碱,主要流程如图所示(部分物质已略去)。
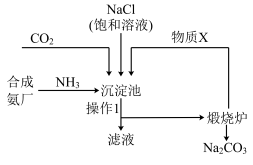
资料:沉淀池中的反应为NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl。
(3)操作1的名称为___________ ;煅烧炉中反应的化学方程式为___________ 。
(4)物质X可循环利用,其化学式为___________ 。
(5)某同学提出制得的纯碱中可能含有氯化钠,请设计实验鉴别:___________ (写出步骤、现象和结论)。
Ⅰ.为了测定Na2CO3和NaHCO3的混合物中Na2CO3的质量分数,某同学用如下实验装置完成实验。
(1)实验前首先要进行的操作是
(2)某同学称取65.4 g混合物于锥形瓶中,打开止水夹,通入N2,一段时间后,关闭止水夹,打开旋塞,当锥形瓶中没有气泡生成时,关闭旋塞,再次打开止水夹,通入一段时间N2。停止通N2,装置C的质量增加30.8 g。

①两次通入N2的目的分别是
②混合物中Na2CO3的物质的量为
Ⅱ.侯德榜“联合制碱法”将制碱技术发展到一个新的水平。该工艺以氯化钠为原料制取纯碱,主要流程如图所示(部分物质已略去)。

资料:沉淀池中的反应为NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl。
(3)操作1的名称为
(4)物质X可循环利用,其化学式为
(5)某同学提出制得的纯碱中可能含有氯化钠,请设计实验鉴别:
您最近一年使用:0次
名校
7 . 铁及其化合物在日常生产生活中应用广泛,研究铁及其化合物的应用意义重大。
(1)所含铁元素只有还原性的物质是___________。
(2)当人体缺铁时,往往需要吃补铁保健品。人体能够吸收的是+2价的铁,但是+2价的铁很容易被氧化。
①如何检验某固体补铁剂中铁元素已被氧化?写出操作过程、现象及结论。
答:研细后用盐酸溶解,___________ 。
②服用维生素C,可使食物中的三价铁离子转化为二价铁离子。由此可推知,维生素C具有___________ (填化学性质)。
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、C1O-、OH-、FeO 、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:
、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:___________
______Fe(OH)3+_______ClO-+_______=_______FeO +_______Cl-+_______
+_______Cl-+_______
(4)工业上用氯化铁腐蚀铜箔、制造电路板。某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:

回答下列问题:
①试剂a是___________ ,操作I用到的玻璃仪器有烧杯、玻璃棒和___________ 。
②滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为___________ 。
③上述流程中操作Ⅲ包括:蒸发浓缩、___________ 、过滤、洗涤。
(1)所含铁元素只有还原性的物质是___________。
| A.Fe | B.FeCl2 | C.FeCl3 | D.Fe2O3 |
(2)当人体缺铁时,往往需要吃补铁保健品。人体能够吸收的是+2价的铁,但是+2价的铁很容易被氧化。
①如何检验某固体补铁剂中铁元素已被氧化?写出操作过程、现象及结论。
答:研细后用盐酸溶解,
②服用维生素C,可使食物中的三价铁离子转化为二价铁离子。由此可推知,维生素C具有
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、C1O-、OH-、FeO
 、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:
、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:______Fe(OH)3+_______ClO-+_______=_______FeO
 +_______Cl-+_______
+_______Cl-+_______(4)工业上用氯化铁腐蚀铜箔、制造电路板。某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:

回答下列问题:
①试剂a是
②滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为
③上述流程中操作Ⅲ包括:蒸发浓缩、
您最近一年使用:0次
名校
8 . 某工业胶料(主要成分为 、
、 、
、 及少量
及少量 ;
; 为两性氧化物),为了减少污染并变废为宝,工程师设计了如下两种不同的工艺(部分步骤已略去),用于生产七水合硫酸亚铁(
为两性氧化物),为了减少污染并变废为宝,工程师设计了如下两种不同的工艺(部分步骤已略去),用于生产七水合硫酸亚铁( )或柠檬酸铁铵。
)或柠檬酸铁铵。
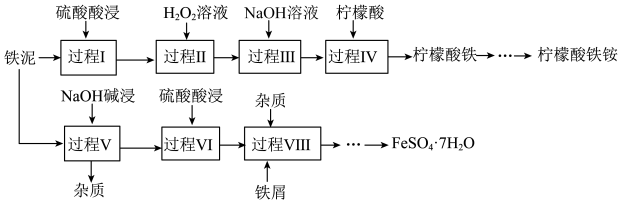
(1)碱浸。
①过程III中, 和
和 与过最
与过最 溶液反应的离子方程式分别为
溶液反应的离子方程式分别为___________________ 、__________________ 、_______________________ 。
②过程V中,发生反应的离子方程式为________________________ 。
③过程III和过程V分离出杂质的操作是___________________________ 。
(2)制各柠檬酸铁铵。
①补全过程Ⅱ中发生反应的离子方程式:________
 。
。
②过程II中,加入 溶液后,可观察到的现象为
溶液后,可观察到的现象为____________________ 。
(3)制备 。
。
①过程VIII中,用离子方程式说明加入铁屑的主要目的是______________________________ 。
②若过程V中 恰好反应完全,则在过程VI中加入
恰好反应完全,则在过程VI中加入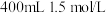 硫酸至固体不再溶解,且酸浸液全部用于制备硫酸亚铁,则经过程VI反应后,所得溶液中
硫酸至固体不再溶解,且酸浸液全部用于制备硫酸亚铁,则经过程VI反应后,所得溶液中 的物质的量最多为
的物质的量最多为__________  。
。
(4)应用。
向酸性含铬废水中加入 ,可将有害的
,可将有害的 (
( 元素为
元素为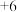 价)转化为
价)转化为 ,写出离子方程式:
,写出离子方程式:___________________________ 。然后调节 ,过滤,可将废水中的
,过滤,可将废水中的 除去。
除去。
 、
、 、
、 及少量
及少量 ;
; 为两性氧化物),为了减少污染并变废为宝,工程师设计了如下两种不同的工艺(部分步骤已略去),用于生产七水合硫酸亚铁(
为两性氧化物),为了减少污染并变废为宝,工程师设计了如下两种不同的工艺(部分步骤已略去),用于生产七水合硫酸亚铁( )或柠檬酸铁铵。
)或柠檬酸铁铵。
(1)碱浸。
①过程III中,
 和
和 与过最
与过最 溶液反应的离子方程式分别为
溶液反应的离子方程式分别为②过程V中,发生反应的离子方程式为
③过程III和过程V分离出杂质的操作是
(2)制各柠檬酸铁铵。
①补全过程Ⅱ中发生反应的离子方程式:
 。
。②过程II中,加入
 溶液后,可观察到的现象为
溶液后,可观察到的现象为(3)制备
 。
。①过程VIII中,用离子方程式说明加入铁屑的主要目的是
②若过程V中
 恰好反应完全,则在过程VI中加入
恰好反应完全,则在过程VI中加入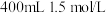 硫酸至固体不再溶解,且酸浸液全部用于制备硫酸亚铁,则经过程VI反应后,所得溶液中
硫酸至固体不再溶解,且酸浸液全部用于制备硫酸亚铁,则经过程VI反应后,所得溶液中 的物质的量最多为
的物质的量最多为 。
。(4)应用。
向酸性含铬废水中加入
 ,可将有害的
,可将有害的 (
( 元素为
元素为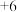 价)转化为
价)转化为 ,写出离子方程式:
,写出离子方程式: ,过滤,可将废水中的
,过滤,可将废水中的 除去。
除去。
您最近一年使用:0次
名校
解题方法
9 . 现有甲、乙、丙三名同学分别进行 胶体的制备实验。
胶体的制备实验。
甲同学:向 的
的 溶液中加少量NaOH溶液。
溶液中加少量NaOH溶液。
乙同学:向25mL沸水中逐滴加入5~6滴 饱和溶液,继续煮沸至溶液呈红褐色,停止加热。
饱和溶液,继续煮沸至溶液呈红褐色,停止加热。
丙同学:直接加热饱和 溶液。
溶液。
试回答下列问题
(1)其中操作正确的同学是___________ ,反应的化学方程式为___________ 。
(2)证明有 胶体生成的方法是
胶体生成的方法是___________ 。
(3)向其中逐滴加入过量稀硫酸,现象:开始___________ ,后来___________ ;原因是___________ 。
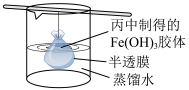
(4)可用如图所示的装置除去 胶体中的杂质离子来提纯
胶体中的杂质离子来提纯 胶体,实验过程中需不断更换烧杯中的蒸馏水。更换蒸馏水若干次后,取少量烧杯中的液体,向其中加入
胶体,实验过程中需不断更换烧杯中的蒸馏水。更换蒸馏水若干次后,取少量烧杯中的液体,向其中加入 溶液,若
溶液,若___________ (填实验现象),则说明该 胶体中的杂质离子已经完全除去。
胶体中的杂质离子已经完全除去。
 胶体的制备实验。
胶体的制备实验。甲同学:向
 的
的 溶液中加少量NaOH溶液。
溶液中加少量NaOH溶液。乙同学:向25mL沸水中逐滴加入5~6滴
 饱和溶液,继续煮沸至溶液呈红褐色,停止加热。
饱和溶液,继续煮沸至溶液呈红褐色,停止加热。丙同学:直接加热饱和
 溶液。
溶液。试回答下列问题
(1)其中操作正确的同学是
(2)证明有
 胶体生成的方法是
胶体生成的方法是(3)向其中逐滴加入过量稀硫酸,现象:开始
(4)可用如图所示的装置除去
 胶体中的杂质离子来提纯
胶体中的杂质离子来提纯 胶体,实验过程中需不断更换烧杯中的蒸馏水。更换蒸馏水若干次后,取少量烧杯中的液体,向其中加入
胶体,实验过程中需不断更换烧杯中的蒸馏水。更换蒸馏水若干次后,取少量烧杯中的液体,向其中加入 溶液,若
溶液,若 胶体中的杂质离子已经完全除去。
胶体中的杂质离子已经完全除去。
您最近一年使用:0次
名校
解题方法
10 .  常用作催化剂、抛光剂和用于生物医药等方面,一种利用氯化铁溶液和硫脲
常用作催化剂、抛光剂和用于生物医药等方面,一种利用氯化铁溶液和硫脲 溶液制备
溶液制备 的流程如图所示,回答下列问题:
的流程如图所示,回答下列问题:

(1)实验室进行过滤操作时所用的玻璃仪器有玻璃棒、___________ ; 的俗名为
的俗名为___________ 。
(2)氯化铁溶液和硫脲溶液反应的离子方程式如下,请补全并配平下列方程式:___________ 。
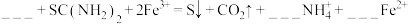
该反应的氧化剂和还原剂的物质的量之比为___________ 。
(3)检验“过滤”后所得的滤液中是否含有 的操作和现象为
的操作和现象为___________ 。
(4)要使 中的
中的 元素全部转化为
元素全部转化为 ,理论上加入的
,理论上加入的 和
和 的物质的量之比为
的物质的量之比为___________ ,实际生产过程中,硫脲的用量比理论的要多一点,原因可能是___________ 。
(5)铁与水蒸气高温反应也能制备 ,若生成
,若生成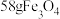 ,则生成的气体的体积为
,则生成的气体的体积为___________ L(换算成标准状况下)。
 常用作催化剂、抛光剂和用于生物医药等方面,一种利用氯化铁溶液和硫脲
常用作催化剂、抛光剂和用于生物医药等方面,一种利用氯化铁溶液和硫脲 溶液制备
溶液制备 的流程如图所示,回答下列问题:
的流程如图所示,回答下列问题:
(1)实验室进行过滤操作时所用的玻璃仪器有玻璃棒、
 的俗名为
的俗名为(2)氯化铁溶液和硫脲溶液反应的离子方程式如下,请补全并配平下列方程式:
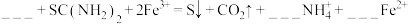
该反应的氧化剂和还原剂的物质的量之比为
(3)检验“过滤”后所得的滤液中是否含有
 的操作和现象为
的操作和现象为(4)要使
 中的
中的 元素全部转化为
元素全部转化为 ,理论上加入的
,理论上加入的 和
和 的物质的量之比为
的物质的量之比为(5)铁与水蒸气高温反应也能制备
 ,若生成
,若生成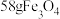 ,则生成的气体的体积为
,则生成的气体的体积为
您最近一年使用:0次



