2019高三下·全国·专题练习
名校
1 . 如图所示,用海带灰制备单质碘的实验中,涉及的操作正确且能达到实验目的的是
A.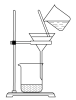 过滤海带灰浸取液 过滤海带灰浸取液 |
B.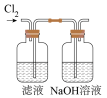 在滤液中通入Cl2 在滤液中通入Cl2 |
C.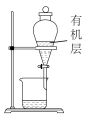 先放出下层液体,再放出有机层苯 先放出下层液体,再放出有机层苯 |
D.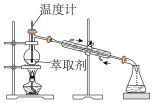 回收萃取剂苯并获得单质碘 回收萃取剂苯并获得单质碘 |
您最近一年使用:0次
2019-03-18更新
|
606次组卷
|
4卷引用:【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高一下学期4月月考化学试题
【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高一下学期4月月考化学试题(鲁科版2019)必修第二册 第1章 原子结构 元素周期律 综合检测卷山东省青岛一中2023-2024学年高一下学期4月月考化学试卷(已下线)2019年3月12日《每日一题》二轮复习 化学实验基本操作
名校
2 . 下列实验的试剂、装置选用不合理的是
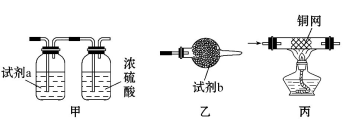

| 选项 | 实验目的 | 试剂 | 装置 |
| A | 除去Cl2中少量的HCl、H2O | 试剂a为饱和氯化钠溶液 | 甲 |
| B | 除去NH3中少量H2O | 试剂b为无水氯化钙 | 乙 |
| C | 除去H2中少量CO2、H2O | 试剂b为碱石灰 | 乙 |
| D | 除去N2中少量的O2 | 足量的铜网 | 丙 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-04-11更新
|
749次组卷
|
4卷引用:云南省玉溪第一中学2017-2018学年高一下学期4月月考化学试题
云南省玉溪第一中学2017-2018学年高一下学期4月月考化学试题云南省玉溪市玉溪一中2017-2018学年高一下学期4月月考化学试题(已下线)解密17 物质的检验分离与提纯(教师版)——备战2018年高考化学之高频考点解密(已下线)专题十五化学实验基础
12-13高一上·河南平顶山·期末
3 . 已知NaHCO3低温时溶解度小,侯德榜制碱的方法是:向氨化的饱和食盐水中通入过量的二氧化碳,即有晶体析出,经过滤、洗涤、焙烧得纯碱。此过程可以表示为:
① NaCl (饱和) + NH3+CO2+H2O=NaHCO3↓+NH4Cl(此反应是放热反应)
② 2NaHCO3 Na2CO3 +CO2↑+H2O
Na2CO3 +CO2↑+H2O
现某化学小组根据上述原理在实验室中模拟制碱过程,下图C装置是溶有氨和NaCl的溶液,且二者均达到了饱和。______ 装置(填序号)。简述该装置能随关随停的理由______ 。
(2)为使实验能够进行,在B方框内内应选用上图中的______ 装置(填写序号),该装置内应装入的试剂是______ 。______ 。
(4)若所用饱和食盐水中含有NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.46g,假设第二步分解时没有损失,则Na2CO3的产率为______ (产率为实际产量占理论产量的百分比)。
① NaCl (饱和) + NH3+CO2+H2O=NaHCO3↓+NH4Cl(此反应是放热反应)
② 2NaHCO3
 Na2CO3 +CO2↑+H2O
Na2CO3 +CO2↑+H2O现某化学小组根据上述原理在实验室中模拟制碱过程,下图C装置是溶有氨和NaCl的溶液,且二者均达到了饱和。
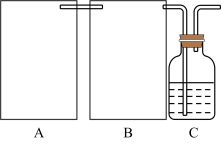
(2)为使实验能够进行,在B方框内内应选用上图中的
(4)若所用饱和食盐水中含有NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.46g,假设第二步分解时没有损失,则Na2CO3的产率为
您最近一年使用:0次
4 . 回答下列问题:
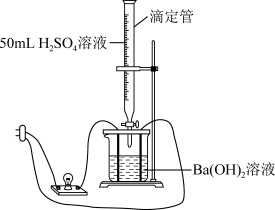
(1)某化学社团为证实Ba(OH)2溶液和H2SO4溶液的反应是离子反应,设计了如下实验。
已知:溶液的导电性由溶液中离子的浓度及离子电荷数决定,可通过观察实验现象,判断溶液中离子浓度的变化,从而证明反应是离子反应。实验装置如图所示:
(2)写出下列情况发生反应的离子方程式:向NaHSO4液中逐滴加入Ba(OH)2溶液至溶液显中性___________ 。
(3)某化工厂排出的废水呈酸性,且其中含大量的Na+、Cu2+、Cl-、 ,为除去废水样品中的Cu2+和
,为除去废水样品中的Cu2+和 ,最终得到中性溶液,设计的方案流程如下图:
,最终得到中性溶液,设计的方案流程如下图:___________ (用离子符号表示)。
②上述流程中,试剂c为___________ (写化学式)。
(1)某化学社团为证实Ba(OH)2溶液和H2SO4溶液的反应是离子反应,设计了如下实验。
已知:溶液的导电性由溶液中离子的浓度及离子电荷数决定,可通过观察实验现象,判断溶液中离子浓度的变化,从而证明反应是离子反应。实验装置如图所示:
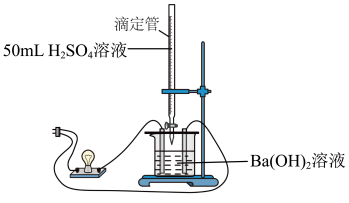
| 实验步骤 | 实验现象 | 实验结论 |
| 连接好装置,向烧杯中加入一定浓度的Ba(OH)2溶液,逐滴滴加H2SO4溶液直至过量,边滴边振荡 | Ba(OH)2溶液和H2SO4溶液的反应是离子反应 |
(2)写出下列情况发生反应的离子方程式:向NaHSO4液中逐滴加入Ba(OH)2溶液至溶液显中性
(3)某化工厂排出的废水呈酸性,且其中含大量的Na+、Cu2+、Cl-、
 ,为除去废水样品中的Cu2+和
,为除去废水样品中的Cu2+和 ,最终得到中性溶液,设计的方案流程如下图:
,最终得到中性溶液,设计的方案流程如下图: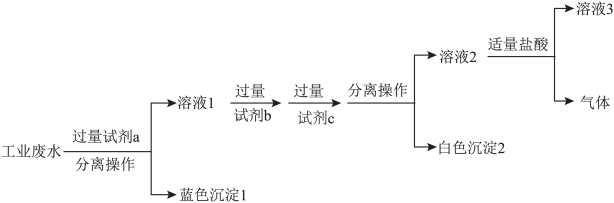
②上述流程中,试剂c为
您最近一年使用:0次
名校
5 . 某硫酸厂用硫铁矿焙烧后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制备绿矾粗产品(FeSO4·7H2O),设计了如下流程:
回答下列问题:
(1)“试剂a”的化学式为___________ ,“操作”的名称是___________ 。
(2)“酸浸”后溶液呈黄色,“还原”操作是向溶液逐步加入试剂b,溶液变为浅绿色,写出溶液变为浅绿色的离子方程式___________ 。
(3)在“调pH至5-6”步骤中,写出生成Al(OH)3的离子方程式___________ 。
(4)鉴别“滤液1”中金属阳离子的实验方案:取少量滤液1进行___________ (填实验名称),若观察到火焰呈黄色,则证明含有Na+;另外取少量滤液1于试管中,依次滴入___________ 和氯水,若实验现象依次为溶液先无红色,后变红色,则证明含有Fe2+,写出该过程中属于氧化还原反应的离子方程式___________ 。

回答下列问题:
(1)“试剂a”的化学式为
(2)“酸浸”后溶液呈黄色,“还原”操作是向溶液逐步加入试剂b,溶液变为浅绿色,写出溶液变为浅绿色的离子方程式
(3)在“调pH至5-6”步骤中,写出生成Al(OH)3的离子方程式
(4)鉴别“滤液1”中金属阳离子的实验方案:取少量滤液1进行
您最近一年使用:0次
名校
6 . I.回答下列问题:
(1)填写表格中的空白:___________ 。
II.某化学社团为证实溶液和 溶液的反应是离子反应,设计了如下实验。
溶液的反应是离子反应,设计了如下实验。
已知:溶液的导电性由溶液中离子的浓度及离子电荷数决定,可通过观察实验现象,判断溶液中离子浓度的变化,从而证明反应时离子反应。实验装置如图所示: 溶液中逐滴加入
溶液中逐滴加入 溶液至溶液显中性
溶液至溶液显中性___________ 。继续滴加 溶液
溶液___________ 。
III.某化工厂排出的废水呈酸性,且其中含大量的 、
、 、
、 、
、 、
、 ,为除去废水样品中的
,为除去废水样品中的 和
和 ,最终得到中性溶液,设计的方案流程如下图:
,最终得到中性溶液,设计的方案流程如下图:___________ (用离子符号表示)。
(4)上述流程中,试剂c为___________ (写化学式);溶液3所含溶质离子有 、
、___________ 。
(5)“分离操作”的名称是___________ ,需用到的玻璃仪器主要有___________ 。
| 实验步骤 | 实验现象 | 实验结论 |
连接好装置,向烧杯中加入一定浓度的 溶液,逐滴滴加 溶液,逐滴滴加 溶液直至过量,边滴边振荡 溶液直至过量,边滴边振荡 | ___________(填写支持实验结论的证据) |  溶液和 溶液和 溶液的反应是离子反应 溶液的反应是离子反应 |
(1)填写表格中的空白:
II.某化学社团为证实溶液和
 溶液的反应是离子反应,设计了如下实验。
溶液的反应是离子反应,设计了如下实验。已知:溶液的导电性由溶液中离子的浓度及离子电荷数决定,可通过观察实验现象,判断溶液中离子浓度的变化,从而证明反应时离子反应。实验装置如图所示:
 溶液中逐滴加入
溶液中逐滴加入 溶液至溶液显中性
溶液至溶液显中性 溶液
溶液III.某化工厂排出的废水呈酸性,且其中含大量的
 、
、 、
、 、
、 、
、 ,为除去废水样品中的
,为除去废水样品中的 和
和 ,最终得到中性溶液,设计的方案流程如下图:
,最终得到中性溶液,设计的方案流程如下图: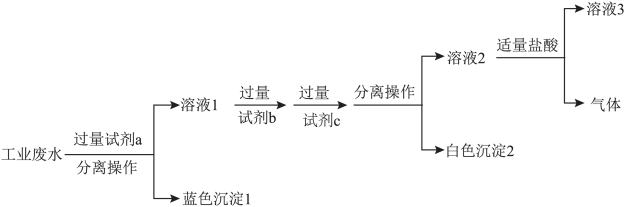
(4)上述流程中,试剂c为
 、
、(5)“分离操作”的名称是
您最近一年使用:0次
名校
解题方法
7 . Ⅰ.完成下列问题
(1)下列氯化物中,既能由金属与氯气直接化合得到,也能由金属与盐酸反应制得_______
(2)用化学方法鉴别氯化氢和氯气,不能选用的是_______
(3)能一次性鉴别AgNO3、Na2CO3、NaCl三种溶液的试剂是_______
(4)下列关于含氯消毒剂的解释正确的是_______
(5)下列物质能使干燥的蓝色石蕊试纸变红又褪色的是_______
(1)氯气(2)液氯(3)新制氯水(4)盐酸(5)氯化氢气体(6)盐酸酸化的漂粉精溶液
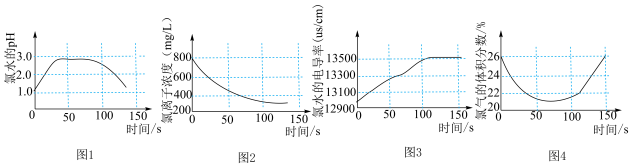
(6)某小组用手持技术对新制饱和氯水进行检测,下列图像变化最有可能是其检测结果的是_______
Ⅱ.某同学设计如下方案从粗食盐水中除去Ca2+、Mg2+、SO 等离子,以制得精盐水。并进行电解饱和食盐水的实验:
等离子,以制得精盐水。并进行电解饱和食盐水的实验:

(7)以下说法不正确的是_______
(8)电解饱和食盐水装置如图所示,其总反应的化学方程式为___________ 。
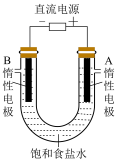
(9)向两极附近各加入酚酞溶液,___________ 极(填“A”或“B”)附近溶液变红色。A是___________ 极,检验该极产物的实验方法是___________ (必须有所用试剂或药品、现象和对应的结论)。
(1)下列氯化物中,既能由金属与氯气直接化合得到,也能由金属与盐酸反应制得_______
| A.FeCl3 | B.FeCl2 | C.CuCl2 | D.ZnCl2 |
(2)用化学方法鉴别氯化氢和氯气,不能选用的是_______
| A.湿润蓝色石蕊试纸 | B.湿润红色石蕊试纸 |
| C.湿润的淀粉KI试纸 | D.硝酸银溶液 |
(3)能一次性鉴别AgNO3、Na2CO3、NaCl三种溶液的试剂是_______
| A.盐酸 | B.NaOH溶液 | C.BaCl2溶液 | D.KNO3溶液 |
(4)下列关于含氯消毒剂的解释正确的是_______
| A.室温下,氯气通入NaOH溶液中制得漂白液:Cl2+OH-=Cl-+ClO-+H2O |
| B.氯水具有杀菌消毒作用:Cl2+H2O=HCl+HClO |
C.氯水应避光保存的原因是:2HClO H2O+Cl2↑ H2O+Cl2↑ |
| D.向Ca(ClO)2溶液中通入适量CO2可增强漂白效果:Ca(ClO)2+CO2+H2O=CaCO3+2HClO |
(5)下列物质能使干燥的蓝色石蕊试纸变红又褪色的是_______
(1)氯气(2)液氯(3)新制氯水(4)盐酸(5)氯化氢气体(6)盐酸酸化的漂粉精溶液
| A.(1)(2)(3) | B.(1)(2)(3)(6) |
| C.(3)(6) | D.(3)(4)(6) |
(6)某小组用手持技术对新制饱和氯水进行检测,下列图像变化最有可能是其检测结果的是_______

| A.图1表示氯水pH随时间的变化 |
| B.图2表示溶液中氯离子浓度随时间的变化 |
| C.图3表示氯水的电导率随时的变化 |
| D.图4表示液面上方氧气体积分数随时间的变化 |
Ⅱ.某同学设计如下方案从粗食盐水中除去Ca2+、Mg2+、SO
 等离子,以制得精盐水。并进行电解饱和食盐水的实验:
等离子,以制得精盐水。并进行电解饱和食盐水的实验:
(7)以下说法不正确的是_______
| A.E中主要有Mg(OH)2和BaSO4,也可能有一些Ca(OH)2 |
| B.②中加入过量Na2CO3溶液的主要目的是为了除去Ca2+ |
| C.N溶液呈碱性 |
D.③目的是除去CO 和OH- 和OH- |
(8)电解饱和食盐水装置如图所示,其总反应的化学方程式为

(9)向两极附近各加入酚酞溶液,
您最近一年使用:0次
名校
解题方法
8 . 无机非金属元素在化工生产中扮演着重要的角色,请利用相关知识回答下列问题:
(1)硅单质可作为硅半导体材料,三氯硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
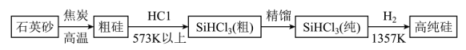
已知:i.石英砂主要成分都是SiO2;ii.三氯硅烷易被氧化。
①请写出SiH4的电子式_______ 。
②工业上原料石英砂常用NH4Cl溶液浸泡除杂,实验室检验溶液中存在 的操作与现象为
的操作与现象为_______ 。
③写出制粗硅的化学方程式_______ 。
④整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和一种气体单质,该气体单质是_______ (填名称);在制备高纯硅的过程中若混入O2,可能引起的后果是_______ 。
(2)瓷器成分大多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSixO6,铜为+2价),下列说法正确的是_______。
(3)在人体器官受到损伤时,需要使用一种新型无机非金属材料来植入体内,这种材料是_______(填序号)。
(1)硅单质可作为硅半导体材料,三氯硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:

已知:i.石英砂主要成分都是SiO2;ii.三氯硅烷易被氧化。
①请写出SiH4的电子式
②工业上原料石英砂常用NH4Cl溶液浸泡除杂,实验室检验溶液中存在
 的操作与现象为
的操作与现象为③写出制粗硅的化学方程式
④整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和一种气体单质,该气体单质是
(2)瓷器成分大多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSixO6,铜为+2价),下列说法正确的是_______。
| A.x=2 |
| B.可用氧化物形式表示为BaOCuO·SiO2 |
| C.硅酸铜钡易溶于强酸和强碱 |
| D.唐宋时期,我国的瓷器已享誉海内外 |
| A.压电陶瓷 | B.高温结构陶瓷 | C.生物陶瓷 | D.超导陶瓷 |
您最近一年使用:0次
名校
解题方法
9 . 硫酸亚铁晶体( ,摩尔质量为278g/mol)是一种重要的无机化工原料,应用广泛。
,摩尔质量为278g/mol)是一种重要的无机化工原料,应用广泛。
Ⅰ.硫酸亚铁晶体的制备
用焙烧铁矿石产生的工业废渣(主要成分为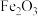 ,含有少量FeO、
,含有少量FeO、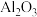 )为原料生产硫酸亚铁晶体的工艺流程如下。
)为原料生产硫酸亚铁晶体的工艺流程如下。
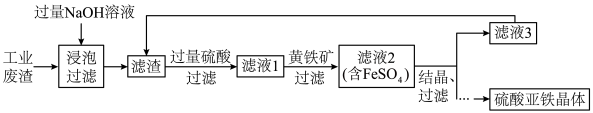
(1)加入过量NaOH溶液进行浸泡时发生反应的离子方程式为________ 。
(2)黄铁矿的主要成分是 ,其作用是
,其作用是________ 。是否可以使用Cu粉替代
________ (填“是”或“否”),解释原因________ 。
(3)为检验加入过量的黄铁矿是否充分起到作用,可以向滤液2中加入的试剂为________ (填化学式),通过________ 现象判断已经充分发挥作用。为灵敏检验滤液2中主要的金属阳离子,选择的试剂为________ (填化学式)。
(4)将滤液3(母液)循环加入滤渣中的目的是________ ,发生反应的离子方程式为________ 。
(5)配制250mL0.2mol/L的 溶液,需称量硫酸亚铁晶体质量为
溶液,需称量硫酸亚铁晶体质量为________ g,下列操作会导致所配溶液浓度偏高的是________ (填字母)。
A.所称取的晶体失去了部分结晶水 B.转移溶液前容量瓶中存在少量蒸馏水
C.定容前未洗涤烧杯和玻璃棒 D.定容时俯视刻度线
(6)产品纯度测定
已知: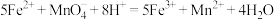
取ag硫酸亚铁晶体产品,用稀 和新煮沸过的蒸馏水溶解后,立即滴入
和新煮沸过的蒸馏水溶解后,立即滴入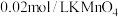 溶液至恰好完全反应,共消耗
溶液至恰好完全反应,共消耗 溶液bmL。
溶液bmL。 的质量分数是
的质量分数是________ 。
Ⅱ.用制备颜料铵铁蓝
(7) 用稀
用稀 溶解后,加入
溶解后,加入 溶液和
溶液和 溶液,加热,产生白色沉淀
溶液,加热,产生白色沉淀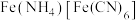 。酸性条件下再加入
。酸性条件下再加入 溶液,充分反应,得到铵铁蓝。补全离子方程式:
溶液,充分反应,得到铵铁蓝。补全离子方程式:_______
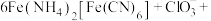 ________
________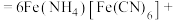 ________+________+________
________+________+________
 ,摩尔质量为278g/mol)是一种重要的无机化工原料,应用广泛。
,摩尔质量为278g/mol)是一种重要的无机化工原料,应用广泛。Ⅰ.硫酸亚铁晶体的制备
用焙烧铁矿石产生的工业废渣(主要成分为
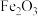 ,含有少量FeO、
,含有少量FeO、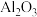 )为原料生产硫酸亚铁晶体的工艺流程如下。
)为原料生产硫酸亚铁晶体的工艺流程如下。
(1)加入过量NaOH溶液进行浸泡时发生反应的离子方程式为
(2)黄铁矿的主要成分是
 ,其作用是
,其作用是
(3)为检验加入过量的黄铁矿是否充分起到作用,可以向滤液2中加入的试剂为
(4)将滤液3(母液)循环加入滤渣中的目的是
(5)配制250mL0.2mol/L的
 溶液,需称量硫酸亚铁晶体质量为
溶液,需称量硫酸亚铁晶体质量为A.所称取的晶体失去了部分结晶水 B.转移溶液前容量瓶中存在少量蒸馏水
C.定容前未洗涤烧杯和玻璃棒 D.定容时俯视刻度线
(6)产品纯度测定
已知:
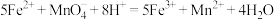
取ag硫酸亚铁晶体产品,用稀
 和新煮沸过的蒸馏水溶解后,立即滴入
和新煮沸过的蒸馏水溶解后,立即滴入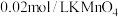 溶液至恰好完全反应,共消耗
溶液至恰好完全反应,共消耗 溶液bmL。
溶液bmL。 的质量分数是
的质量分数是Ⅱ.用制备颜料铵铁蓝
(7)
 用稀
用稀 溶解后,加入
溶解后,加入 溶液和
溶液和 溶液,加热,产生白色沉淀
溶液,加热,产生白色沉淀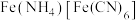 。酸性条件下再加入
。酸性条件下再加入 溶液,充分反应,得到铵铁蓝。补全离子方程式:
溶液,充分反应,得到铵铁蓝。补全离子方程式: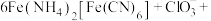 ________
________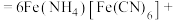 ________+________+________
________+________+________
您最近一年使用:0次
名校
解题方法
10 . 苯甲酸是一种化工原料,常用作制药和染料的中间体,也用于制取增塑剂和香料等。实验室合成苯甲酸的原理及有关数据及装置示意图如下:
反应过程: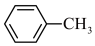


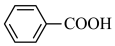
已知:(1)苯甲酸 100 ℃左右开始升华。
(2)反应试剂、产物的物理常数如下:
按下列合成步骤回答问题:
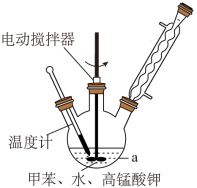
步骤Ⅰ:按图在 250 mL 仪器 a 中放入 2.7 mL 甲苯和 100 mL 水,控制温度为 100℃,搅拌溶液,在石棉网上加热至沸腾。从冷凝管上口分批加入 8.5 g 高锰酸钾(加完后用少量水冲洗冷凝管内壁),继续搅拌约 4~5h,反应完全后,停止加热。
步骤 Ⅱ:在反应结束后混合物中加入一定量亚硫酸氢钠溶液,产生黑色沉淀,趁热过滤、热水洗涤沉淀,合并滤液与洗涤液,再将其放在冰水浴中冷却,然后用浓盐酸酸化至苯甲酸全部析出;将析出的苯甲酸减压过滤,再用少量冷水洗涤苯甲酸固体,挤压除去水分,将制得的苯甲酸固体放在沸水浴上干燥,得到粗产品。
(1)仪器 a 的名称_______ 。
(2)步骤Ⅰ中反应完全的现象为_______ 。
(3)步骤 Ⅱ在反应混合物中加入一定量亚硫酸氢钠溶液,亚硫酸氢钠溶液的作用是_______ ;还可以用_______ (填选项)代替亚硫酸氢钠溶液。
A.H2O2 B.NaHCO3 C. Na2C2O4
(4)步骤 Ⅱ中干燥苯甲酸晶体时,若温度过高,可能出现的结果是_______ 。
(5)若将苯甲酸粗产品进一步提纯,可用_______ 方法,最终得到2.0g产品,则苯甲酸产率为_______ 。
反应过程:

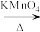


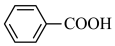
已知:(1)苯甲酸 100 ℃左右开始升华。
(2)反应试剂、产物的物理常数如下:
| 名称 | 性状 | 熔点 | 沸点/C | 密度/g·mL-1 | 溶解度/g(室温) | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体、易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 |

步骤Ⅰ:按图在 250 mL 仪器 a 中放入 2.7 mL 甲苯和 100 mL 水,控制温度为 100℃,搅拌溶液,在石棉网上加热至沸腾。从冷凝管上口分批加入 8.5 g 高锰酸钾(加完后用少量水冲洗冷凝管内壁),继续搅拌约 4~5h,反应完全后,停止加热。
步骤 Ⅱ:在反应结束后混合物中加入一定量亚硫酸氢钠溶液,产生黑色沉淀,趁热过滤、热水洗涤沉淀,合并滤液与洗涤液,再将其放在冰水浴中冷却,然后用浓盐酸酸化至苯甲酸全部析出;将析出的苯甲酸减压过滤,再用少量冷水洗涤苯甲酸固体,挤压除去水分,将制得的苯甲酸固体放在沸水浴上干燥,得到粗产品。
(1)仪器 a 的名称
(2)步骤Ⅰ中反应完全的现象为
(3)步骤 Ⅱ在反应混合物中加入一定量亚硫酸氢钠溶液,亚硫酸氢钠溶液的作用是
A.H2O2 B.NaHCO3 C. Na2C2O4
(4)步骤 Ⅱ中干燥苯甲酸晶体时,若温度过高,可能出现的结果是
(5)若将苯甲酸粗产品进一步提纯,可用
您最近一年使用:0次



