名校
1 . 完成下列问题
(1)请填写合适的除杂试剂
(2)为除去粗盐中的Mg2+、Ca2+、 ,可依次加入稍过量的哪些试剂,过滤后加入稀盐酸调节溶液为中性,请选择正确的选项
,可依次加入稍过量的哪些试剂,过滤后加入稀盐酸调节溶液为中性,请选择正确的选项___________
A.Na2CO3、BaCl2、NaOH B.BaCl2、Na2CO3、NaOH C.NaOH、BaCl2、Na2CO3
(3)总结除杂应遵循哪些原则:___________
(1)请填写合适的除杂试剂
| 物质(括号内为杂质) | 除杂试剂 | |
| ① | CO2(SO2) | |
| ② | NH3 (CO2 、H2O ) | |
| ③ | SO2(H2O) | |
| ④ | NO(NO2) |
(2)为除去粗盐中的Mg2+、Ca2+、
 ,可依次加入稍过量的哪些试剂,过滤后加入稀盐酸调节溶液为中性,请选择正确的选项
,可依次加入稍过量的哪些试剂,过滤后加入稀盐酸调节溶液为中性,请选择正确的选项A.Na2CO3、BaCl2、NaOH B.BaCl2、Na2CO3、NaOH C.NaOH、BaCl2、Na2CO3
(3)总结除杂应遵循哪些原则:
您最近一年使用:0次
解题方法
2 . 海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了如图所示实验:

请回答下列问题:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是_____ (从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤④还可用双氧水和稀硫酸氧化I-,其反应的离子方程式为______ 。
(3)步骤⑤的实验操作名称是______ ,实验室进行该操作需要用到的玻璃仪器有______ ;操作⑤选用苯的理由是_____ 。
A.苯不溶于水 B.苯的密度比水小
C.碘在苯中比在水中溶解度更大 D.苯与碘水不反应

请回答下列问题:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤④还可用双氧水和稀硫酸氧化I-,其反应的离子方程式为
(3)步骤⑤的实验操作名称是
A.苯不溶于水 B.苯的密度比水小
C.碘在苯中比在水中溶解度更大 D.苯与碘水不反应
您最近一年使用:0次
3 . 工厂烟气中含有的 ,直接排放会污染空气。工业上采用多种方法脱硫。
,直接排放会污染空气。工业上采用多种方法脱硫。
(1)氨水脱硫。氨水脱硫主要分为吸收、中和、氧化3个环节。已知:氧化时随溶液pH升高
 被空气氧化的速率如图1所示。溶液中
被空气氧化的速率如图1所示。溶液中 、
、 、
、 的物质的量分数随pH的分布如图2所示。
的物质的量分数随pH的分布如图2所示。
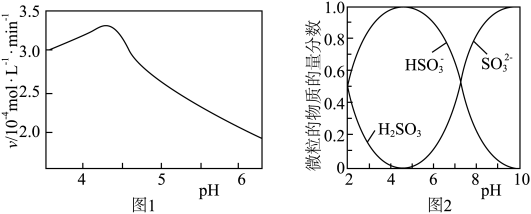
①中和过程用氨水将吸收液(pH约为4)pH调到6~7,该过程中含硫微粒浓度增大的是_______ 。
②溶液pH大于4.5,随pH增大, 被氧化速率逐渐减慢的原因是
被氧化速率逐渐减慢的原因是_______ 。
(2)生物热解气脱硫。生物热解气主要成分为CO、 、
、 ,高温下将
,高温下将 还原为
还原为 。
。 高温还原
高温还原 的化学方程式为
的化学方程式为_______ 。
(3)海水脱硫。海水中含有少量碳酸盐( 和
和 ),呈微碱性(
),呈微碱性(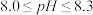 )。海水脱硫过程如下图所示:
)。海水脱硫过程如下图所示:

①在 吸收塔中采用海水从塔顶喷洒,烟气从塔底鼓入,其目的是
吸收塔中采用海水从塔顶喷洒,烟气从塔底鼓入,其目的是_______ 。
②相比氨水脱硫和生物质热解气脱硫,海水脱硫的优点是_______ 。
(4)石灰石脱硫。工业上燃煤时常在煤炭中加入石灰石,从源头上减少 排放。在煤炭中加入一定量石灰石,850℃通入一定浓度的氧气,反应为
排放。在煤炭中加入一定量石灰石,850℃通入一定浓度的氧气,反应为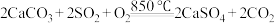
①通入气体中氧气的浓度偏低时,产生的CO与 反应生成CaO等三种氧化物,导致
反应生成CaO等三种氧化物,导致 脱除率下降。该反应的方程式为
脱除率下降。该反应的方程式为_______ 。
②不同氧气浓度影响了石灰石的利用率,氧气含量20%和40%时对石灰石表面结构的影响如图。氧气浓度高石灰石利用率偏低的原因是_______ 。

 ,直接排放会污染空气。工业上采用多种方法脱硫。
,直接排放会污染空气。工业上采用多种方法脱硫。(1)氨水脱硫。氨水脱硫主要分为吸收、中和、氧化3个环节。已知:氧化时随溶液pH升高

 被空气氧化的速率如图1所示。溶液中
被空气氧化的速率如图1所示。溶液中 、
、 、
、 的物质的量分数随pH的分布如图2所示。
的物质的量分数随pH的分布如图2所示。
①中和过程用氨水将吸收液(pH约为4)pH调到6~7,该过程中含硫微粒浓度增大的是
②溶液pH大于4.5,随pH增大,
 被氧化速率逐渐减慢的原因是
被氧化速率逐渐减慢的原因是(2)生物热解气脱硫。生物热解气主要成分为CO、
 、
、 ,高温下将
,高温下将 还原为
还原为 。
。 高温还原
高温还原 的化学方程式为
的化学方程式为(3)海水脱硫。海水中含有少量碳酸盐(
 和
和 ),呈微碱性(
),呈微碱性(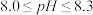 )。海水脱硫过程如下图所示:
)。海水脱硫过程如下图所示:
①在
 吸收塔中采用海水从塔顶喷洒,烟气从塔底鼓入,其目的是
吸收塔中采用海水从塔顶喷洒,烟气从塔底鼓入,其目的是②相比氨水脱硫和生物质热解气脱硫,海水脱硫的优点是
(4)石灰石脱硫。工业上燃煤时常在煤炭中加入石灰石,从源头上减少
 排放。在煤炭中加入一定量石灰石,850℃通入一定浓度的氧气,反应为
排放。在煤炭中加入一定量石灰石,850℃通入一定浓度的氧气,反应为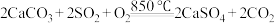
①通入气体中氧气的浓度偏低时,产生的CO与
 反应生成CaO等三种氧化物,导致
反应生成CaO等三种氧化物,导致 脱除率下降。该反应的方程式为
脱除率下降。该反应的方程式为②不同氧气浓度影响了石灰石的利用率,氧气含量20%和40%时对石灰石表面结构的影响如图。氧气浓度高石灰石利用率偏低的原因是

您最近一年使用:0次
22-23高一上·浙江·阶段练习
解题方法
4 . 按照如图的生产流程可以制得氧化铁(铁红颜料)和硫酸钾。
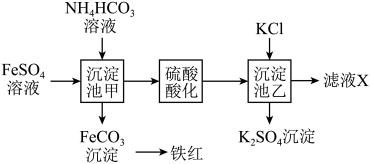
(1)沉淀池甲中反应后生成碳酸亚铁、硫酸铵水和一种温室气体,写出该反应的化学方程式_______ 。
(2)该流程中加硫酸酸化的目的是____________ 。
(3)在沉淀池乙中还要加入有机溶剂丙醇,其原因可能是___________________ 。

(1)沉淀池甲中反应后生成碳酸亚铁、硫酸铵水和一种温室气体,写出该反应的化学方程式
(2)该流程中加硫酸酸化的目的是
(3)在沉淀池乙中还要加入有机溶剂丙醇,其原因可能是
您最近一年使用:0次
名校
5 . 含钠化合物在工业生产和日常生活中应用广泛,请回答下列有关问题:
(1)钠元素的碱性氧化物的化学式为___________ ,钠另一种氧化物是一种淡黄色固体,写出其用于呼吸面具供氧剂的一个化学方程式:___________ 。
(2) 是一种强碱,若实验室用
是一种强碱,若实验室用 浓溶液配制
浓溶液配制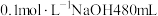 ,需量取密度为
,需量取密度为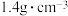 质量分数为
质量分数为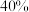 的
的 溶液
溶液___________  ,该实验所需的玻璃仪器除玻璃棒、量筒、胶头滴管之外,还有
,该实验所需的玻璃仪器除玻璃棒、量筒、胶头滴管之外,还有___________ ,当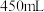 所配溶液与标准状况下
所配溶液与标准状况下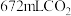 恰好反应时,发生反应的离子方程式为
恰好反应时,发生反应的离子方程式为___________ 。
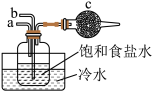
(3)如图是实验室模拟“侯氏制碱法”制取 的部分装置。下列说正确的是___________(填序号)
的部分装置。下列说正确的是___________(填序号)
(4)粗盐常含有少量 、
、 、
、 以及泥沙等杂质,实验室中可用如下流程提纯
以及泥沙等杂质,实验室中可用如下流程提纯 ,下列说法中正确的是___________(填序号)
,下列说法中正确的是___________(填序号)
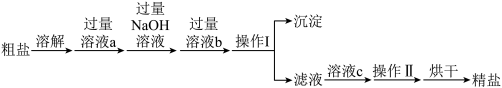
(1)钠元素的碱性氧化物的化学式为
(2)
 是一种强碱,若实验室用
是一种强碱,若实验室用 浓溶液配制
浓溶液配制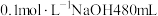 ,需量取密度为
,需量取密度为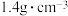 质量分数为
质量分数为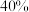 的
的 溶液
溶液 ,该实验所需的玻璃仪器除玻璃棒、量筒、胶头滴管之外,还有
,该实验所需的玻璃仪器除玻璃棒、量筒、胶头滴管之外,还有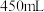 所配溶液与标准状况下
所配溶液与标准状况下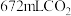 恰好反应时,发生反应的离子方程式为
恰好反应时,发生反应的离子方程式为(3)如图是实验室模拟“侯氏制碱法”制取
 的部分装置。下列说正确的是___________(填序号)
的部分装置。下列说正确的是___________(填序号)
A.a先通入 ,然后b通入 ,然后b通入 ,c中放碱石灰 ,c中放碱石灰 |
B.b先通入 ,然后a通入 ,然后a通入 ,c中放碱石灰 ,c中放碱石灰 |
C.a先通入 ,然后b通入 ,然后b通入 ,c中放蘸稀硫酸的脱脂棉 ,c中放蘸稀硫酸的脱脂棉 |
D.b先通入 ,然后a通入 ,然后a通入 ,c中放蘸稀硫酸的脱脂棉 ,c中放蘸稀硫酸的脱脂棉 |
 、
、 、
、 以及泥沙等杂质,实验室中可用如下流程提纯
以及泥沙等杂质,实验室中可用如下流程提纯 ,下列说法中正确的是___________(填序号)
,下列说法中正确的是___________(填序号)
A.溶液a和 可用一种试剂来代替 可用一种试剂来代替 |
| B.溶液a和溶液b的添加顺序可以互换 |
| C.操作Ⅱ为蒸发结晶,蒸发过程中当蒸发皿中有大量晶体析出时停止加热 |
| D.粗盐提纯的整个操作过程中共有两处需要使用玻璃棒 |
您最近一年使用:0次
2023-02-12更新
|
394次组卷
|
3卷引用:山东省德州市2022-2023学年高一上学期期末考试化学试题
解题方法
6 . 生活离不开化学。家庭厨卫中有许多中学化学常见的物质,它们的主要成分如下表。
回答下列问题:
(1)以上主要成分中属于弱电解质的有___ (填序号)。NaCl中所含化学键类型为____________ 。
(2)当碱面不慎洒落在天然气火焰上,观察到的现象是_____________ 。
(3)KAl(SO4)2·12H2O的电离方程式为_______________ 。
(4)Na2CO3溶液中混有少量NaHCO3,可加适量的NaOH溶液除杂,离子反应方程式为________ ;
Na2CO3固体中若含有少量NaHCO3,可采取的除杂方法为___________ 。
(5)NaHCO3溶液与白醋反应的离子方程式为_________________ 。
(6)84消毒液和洁厕灵不能混合使用,用离子方程式表示其理由:_______________ 。
商品 | 食盐 | 碱面 | 84消毒液 | 发酵粉 |
主要成分 | ① NaCl | ② Na2CO3 | ③ NaClO | ④ NaHCO3 ⑤KAl(SO4)2·12H2O |
商品 | 料酒 | 白醋 | 洁厕灵 | \ |
主要成分 | ⑥C2H5OH | ⑦CH3COOH | ⑧HCl |
回答下列问题:
(1)以上主要成分中属于弱电解质的有
(2)当碱面不慎洒落在天然气火焰上,观察到的现象是
(3)KAl(SO4)2·12H2O的电离方程式为
(4)Na2CO3溶液中混有少量NaHCO3,可加适量的NaOH溶液除杂,离子反应方程式为
Na2CO3固体中若含有少量NaHCO3,可采取的除杂方法为
(5)NaHCO3溶液与白醋反应的离子方程式为
(6)84消毒液和洁厕灵不能混合使用,用离子方程式表示其理由:
您最近一年使用:0次
7 . 氢氧化氧镍(NiOOH)有良好的电化学活性,是合成锂离子电池材料的前驱体。某化工厂用含镍废料(主要成分为NiO,杂质为 、CaO、CuO)制备NiOOH的工艺流程如图。
、CaO、CuO)制备NiOOH的工艺流程如图。

已知几种金属离子沉淀的pH如表:
(1)为了提高“酸浸”中原料的浸出效率,采取的措施不合理的有_______。
(2)料渣1的主要成分是_______ (填化学式)。
(3)“除铜”中发生两个反应,写出其中生成CuS的化学方程式_______ 。
(4)“除铁”在40~50°C下进行,加入 的作用是
的作用是_______ , 的实际消耗量比理论值高的原因是
的实际消耗量比理论值高的原因是_______ ,NaOH用于调节溶液的pH,应调节pH的范围是_______ 。
(5)NiOOH中Ni的化合价为_______ 。“氧化”中会有 生成,反应的离子方程式为
生成,反应的离子方程式为_______ 。
(6)若用2.0t废料(含NiO75%)制得NiOOH 1.6t,则NiOOH的产率为_______ %(保留两位有效数字)。
 、CaO、CuO)制备NiOOH的工艺流程如图。
、CaO、CuO)制备NiOOH的工艺流程如图。
已知几种金属离子沉淀的pH如表:
| 金属离子 |  |  |  |
| 开始沉淀的pH | 1.5 | 6.5 | 7.2 |
| 沉淀完全的pH | 3.2 | 9.7 | 9.2 |
| A.研磨废料 | B.加入大量水 | C.搅拌 | D.适当升高温度 |
(3)“除铜”中发生两个反应,写出其中生成CuS的化学方程式
(4)“除铁”在40~50°C下进行,加入
 的作用是
的作用是 的实际消耗量比理论值高的原因是
的实际消耗量比理论值高的原因是(5)NiOOH中Ni的化合价为
 生成,反应的离子方程式为
生成,反应的离子方程式为(6)若用2.0t废料(含NiO75%)制得NiOOH 1.6t,则NiOOH的产率为
您最近一年使用:0次
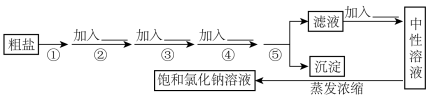
8 . 食盐是日常生活的必需品,也是重要的化工原料。粗盐常含有少量Ca2+、Mg2+、 等杂质,实验室提纯NaCl的流程如图:
等杂质,实验室提纯NaCl的流程如图:
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、稀盐酸、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氧化碳、蒸馏水等。
回答下列问题:
(1)操作①为_______ 。
(2)欲除去粗盐中的Ca2+、Mg2+、 离子,从提供的试剂中选择,操作②③④⑥依次加入的试剂为:
离子,从提供的试剂中选择,操作②③④⑥依次加入的试剂为:_______ 、_______ 、_______ 、_______ (只填化学式)。为证明 已沉淀完全。请你写出检验方法
已沉淀完全。请你写出检验方法_______ 。
(3)上述流程中,①⑤两个过程均要用到玻璃棒,⑤处玻璃棒的作用是_______ 。
(4)食盐是无机化工生产之母,电解饱和食盐水的装置如图。
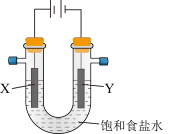
电解饱和食盐水的化学方程式为_______ ;若电解时消耗了117g氯化钠,理论上得到气体的体积为_______ (标准状况)。
 等杂质,实验室提纯NaCl的流程如图:
等杂质,实验室提纯NaCl的流程如图:
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、稀盐酸、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氧化碳、蒸馏水等。
回答下列问题:
(1)操作①为
(2)欲除去粗盐中的Ca2+、Mg2+、
 离子,从提供的试剂中选择,操作②③④⑥依次加入的试剂为:
离子,从提供的试剂中选择,操作②③④⑥依次加入的试剂为: 已沉淀完全。请你写出检验方法
已沉淀完全。请你写出检验方法(3)上述流程中,①⑤两个过程均要用到玻璃棒,⑤处玻璃棒的作用是
(4)食盐是无机化工生产之母,电解饱和食盐水的装置如图。

电解饱和食盐水的化学方程式为
您最近一年使用:0次
名校
解题方法
9 . 2020 年突如其来的“新冠肺炎”使人们认识到日常杀菌消毒的重要性。其中含氯消毒剂在生产生活中有着广泛的用途。
(1)①写出新制氯水中,具有氧化性的含氯微粒有_______ ;
②已知KMnO4与浓盐酸反应的化学方程式如下,该反应也可以用来制取氯气:2KMnO4 +16HCl(浓) = 2KCl + 2MnCl2 + 5Cl2↑+8H2O,15.8 g KMnO4能和_______ mol HCl发生上述反应、产生的Cl2在标准状况下的体积为_______ L;
③实验室还可以利用如下反应制取氯气:KClO3 + 6HCl(浓) = KCl + 3Cl2↑ + 3H2O。若制取标准状况下6.72 L氯气,反应过程中转移电子的物质的量为_______ mol;
(2)常温下,氯气与消石灰浊液反应得漂白精,Ca(ClO)2是漂白精的有效成分,在此次抗击新冠病毒中发挥了重要作用 ,浸泡衣物时加入漂白精在空气中放置一段时间漂白效果更好,原因用化学方程式表示为:_______ ;
(3)根据如图的溶解度曲线,回答下列问题。
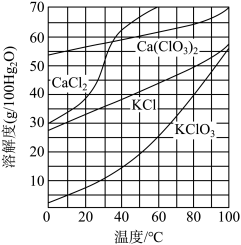
①向滤液中加入过量KCl固体可将溶液中Ca(ClO3)2转化为KClO3固体而析出,若溶液中KClO3的含量为100 g·L-1,从该溶液中得到KClO3固体的方法是_______ 。
② KClO3与SO2在强酸性条件下可反应制得ClO2,SO2被氧化为SO ,该反应的离子方程式为
,该反应的离子方程式为_______ 。
(1)①写出新制氯水中,具有氧化性的含氯微粒有
②已知KMnO4与浓盐酸反应的化学方程式如下,该反应也可以用来制取氯气:2KMnO4 +16HCl(浓) = 2KCl + 2MnCl2 + 5Cl2↑+8H2O,15.8 g KMnO4能和
③实验室还可以利用如下反应制取氯气:KClO3 + 6HCl(浓) = KCl + 3Cl2↑ + 3H2O。若制取标准状况下6.72 L氯气,反应过程中转移电子的物质的量为
(2)常温下,氯气与消石灰浊液反应得漂白精,Ca(ClO)2是漂白精的有效成分,在此次抗击新冠病毒中发挥了重要作用 ,浸泡衣物时加入漂白精在空气中放置一段时间漂白效果更好,原因用化学方程式表示为:
(3)根据如图的溶解度曲线,回答下列问题。

①向滤液中加入过量KCl固体可将溶液中Ca(ClO3)2转化为KClO3固体而析出,若溶液中KClO3的含量为100 g·L-1,从该溶液中得到KClO3固体的方法是
② KClO3与SO2在强酸性条件下可反应制得ClO2,SO2被氧化为SO
 ,该反应的离子方程式为
,该反应的离子方程式为
您最近一年使用:0次
22-23高一·全国·课时练习
10 . 冶炼金属常用以下几种方法:
a.以C、CO或H2作还原剂还原;
b.利用铝热反应原理;
c.电解法;
d.热分解法。
(1)下列金属各采用哪种方法冶炼最佳?
①Fe、Zn、Cu等较不活泼金属_______ ;
②Na、Mg、Al等活泼或较活泼金属_______ ;
③Hg、Ag等不活泼金属_______ ;
④V、Cr、Mn、W等高熔点金属_______ 。
(2)工业上生产钾不能用电解熔融KCl的方法制得,因金属钾易溶于熔融态的KCl中而有危险,难获得钾,且降低电解效率。现生产钾是用金属钠和熔化的KCl反应制取。有关数据如下表:
工业上生产金属钾的化学方程式是:KCl+Na NaCl+K。工业上制金属钾主要运用到上表所列的哪些物理常数?
NaCl+K。工业上制金属钾主要运用到上表所列的哪些物理常数?_______ ;其选择范围是_______ 。
a.以C、CO或H2作还原剂还原;
b.利用铝热反应原理;
c.电解法;
d.热分解法。
(1)下列金属各采用哪种方法冶炼最佳?
①Fe、Zn、Cu等较不活泼金属
②Na、Mg、Al等活泼或较活泼金属
③Hg、Ag等不活泼金属
④V、Cr、Mn、W等高熔点金属
(2)工业上生产钾不能用电解熔融KCl的方法制得,因金属钾易溶于熔融态的KCl中而有危险,难获得钾,且降低电解效率。现生产钾是用金属钠和熔化的KCl反应制取。有关数据如下表:
| 熔点/℃ | 沸点/℃ | 密度/(g·cm-3) | |
| Na | 97.8 | 883 | 0.97 |
| K | 63.7 | 774 | 0.86 |
| NaCl | 801 | 1 413 | 2.165 |
| KCl | 770 | 1 500 | 1.984 |
 NaCl+K。工业上制金属钾主要运用到上表所列的哪些物理常数?
NaCl+K。工业上制金属钾主要运用到上表所列的哪些物理常数?
您最近一年使用:0次
2023-01-31更新
|
375次组卷
|
3卷引用:8.1 自然资源的开发利用——同步学习必备知识



