名校
解题方法
1 . 将少量饱和 溶液分别滴加到下列物质中,得到三种不同的分散系,回答下列问题。
溶液分别滴加到下列物质中,得到三种不同的分散系,回答下列问题。
甲:将饱和 溶液滴加到冷水中。
溶液滴加到冷水中。
乙:将饱和 溶液滴加到NaOH溶液中。
溶液滴加到NaOH溶液中。
丙:将饱和 溶液滴加到沸水中。
溶液滴加到沸水中。
(1)甲属于_______ (填“溶液”或“胶体”或“浊液”),其颜色是_______ 。
(2)乙中分散质粒子直径范围是_______ 。
(3)将乙分散系过滤,向滤渣中加入盐酸,反应的离子方程式为_______ 。
(4)将丙继续加热煮沸得到红褐色透明液体,反应的离子方程式为_______ 。可以用简单的方法判断丙中是否成功制备胶体,该方法是_______ 。
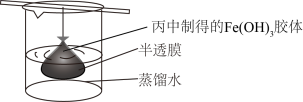
(5)可用如图所示的装置除去 胶体中的杂质离子来提纯
胶体中的杂质离子来提纯 胶体,实验过程中需不断更换烧杯中的蒸馏水。更换蒸馏水若干次后,取少量烧杯中的液体,向其中加入
胶体,实验过程中需不断更换烧杯中的蒸馏水。更换蒸馏水若干次后,取少量烧杯中的液体,向其中加入 溶液,若
溶液,若_______ (填实验现象),则说明该 胶体中的杂质离子已经完全除去。
胶体中的杂质离子已经完全除去。
 溶液分别滴加到下列物质中,得到三种不同的分散系,回答下列问题。
溶液分别滴加到下列物质中,得到三种不同的分散系,回答下列问题。甲:将饱和
 溶液滴加到冷水中。
溶液滴加到冷水中。乙:将饱和
 溶液滴加到NaOH溶液中。
溶液滴加到NaOH溶液中。丙:将饱和
 溶液滴加到沸水中。
溶液滴加到沸水中。(1)甲属于
(2)乙中分散质粒子直径范围是
(3)将乙分散系过滤,向滤渣中加入盐酸,反应的离子方程式为
(4)将丙继续加热煮沸得到红褐色透明液体,反应的离子方程式为
(5)可用如图所示的装置除去
 胶体中的杂质离子来提纯
胶体中的杂质离子来提纯 胶体,实验过程中需不断更换烧杯中的蒸馏水。更换蒸馏水若干次后,取少量烧杯中的液体,向其中加入
胶体,实验过程中需不断更换烧杯中的蒸馏水。更换蒸馏水若干次后,取少量烧杯中的液体,向其中加入 溶液,若
溶液,若 胶体中的杂质离子已经完全除去。
胶体中的杂质离子已经完全除去。
您最近一年使用:0次
2 . 青海省的茶卡盐湖是天然的资源宝库。夏天,将湖水引入湖滩上晒出食盐。冬天,从湖面上捞取纯碱晶体。
(1)湖水晒盐相当于粗盐提纯操作中的________ ,冬季捞碱说明随着温度的降低碳酸钠的溶解度_________ (填“增大”“不变”或“减小”)。
(2)青海省积极布局湖盐产业,开发钠盐下游产品。以氯化钠为基础的产品开发流程如下:

①过程I的化学方程式为___________ 。
②过程Ⅱ的化学方程式为___________ 。
(3)过程Ⅲ得到的钠铝合金是一种轻质的金属材料。钠的含量与合金的性能密切相关,某化学小组称量5.63g钠铝合金,用下面装置测定金属钠的含量。
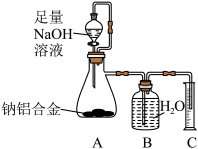
①装置中存在一处明显的错误,写出修正方案___________ 。
②修正装置后进行实验,恢复到室温测得C中水的体积为7015mL,(室温下气体的Vm=23L·mol-1,忽略导管中残留水的体积),计算钠铝合金中金属钠的质量为___________ 。(注:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑)
(1)湖水晒盐相当于粗盐提纯操作中的
(2)青海省积极布局湖盐产业,开发钠盐下游产品。以氯化钠为基础的产品开发流程如下:

①过程I的化学方程式为
②过程Ⅱ的化学方程式为
(3)过程Ⅲ得到的钠铝合金是一种轻质的金属材料。钠的含量与合金的性能密切相关,某化学小组称量5.63g钠铝合金,用下面装置测定金属钠的含量。

①装置中存在一处明显的错误,写出修正方案
②修正装置后进行实验,恢复到室温测得C中水的体积为7015mL,(室温下气体的Vm=23L·mol-1,忽略导管中残留水的体积),计算钠铝合金中金属钠的质量为
您最近一年使用:0次
解题方法
3 . 亚铁盐由于具有较强的还原性,久置于空气中容易氧化变质,日常实验中常以复盐硫酸亚铁铵晶体 代替绿矾(
代替绿矾( )等亚铁盐使用,这样可以延长保存时间,不易氧化变质。已知:硫酸亚铁铵晶体在蒸馏水中的溶解情况如下表:
)等亚铁盐使用,这样可以延长保存时间,不易氧化变质。已知:硫酸亚铁铵晶体在蒸馏水中的溶解情况如下表:
(1)①在制备硫酸亚铁铵晶体时,为了防止被氧化,需除去溶解氧,所配制 溶液、
溶液、 溶液等都必须预先经过
溶液等都必须预先经过___________ (操作)处理后再使用。向 溶液中加入饱和
溶液中加入饱和 溶液,经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥后得到一种浅蓝绿色的晶体,此晶体即为硫酸亚铁铵晶体。
溶液,经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥后得到一种浅蓝绿色的晶体,此晶体即为硫酸亚铁铵晶体。
②在上述洗涤操作步骤中,下列蒸馏水最适合作为洗涤剂的是___________ (填字母)。
A.沸水 B.冰水 C.温水 D.常温
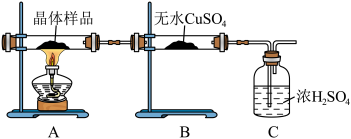
(2)取少量制得晶体按下图进行实验, 变蓝证明含有结晶水,C装置的作用是
变蓝证明含有结晶水,C装置的作用是___________ 。
②另取少量晶体于试管中,加水溶解,___________ (填操作与现象),证明晶体中有 ,用相关的离子方程式说明产生该现象的原理:
,用相关的离子方程式说明产生该现象的原理:___________ 。
 代替绿矾(
代替绿矾( )等亚铁盐使用,这样可以延长保存时间,不易氧化变质。已知:硫酸亚铁铵晶体在蒸馏水中的溶解情况如下表:
)等亚铁盐使用,这样可以延长保存时间,不易氧化变质。已知:硫酸亚铁铵晶体在蒸馏水中的溶解情况如下表:| 溶剂 | 蒸馏水 | ||||
| 温度/℃ | 0 | 20 | 40 | 60 | 80 |
| 溶解度/g | 9.8 | 22.0 | 28.2 | 35.7 | 45.2 |
(1)①在制备硫酸亚铁铵晶体时,为了防止被氧化,需除去溶解氧,所配制
 溶液、
溶液、 溶液等都必须预先经过
溶液等都必须预先经过 溶液中加入饱和
溶液中加入饱和 溶液,经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥后得到一种浅蓝绿色的晶体,此晶体即为硫酸亚铁铵晶体。
溶液,经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥后得到一种浅蓝绿色的晶体,此晶体即为硫酸亚铁铵晶体。②在上述洗涤操作步骤中,下列蒸馏水最适合作为洗涤剂的是
A.沸水 B.冰水 C.温水 D.常温
(2)取少量制得晶体按下图进行实验,
 变蓝证明含有结晶水,C装置的作用是
变蓝证明含有结晶水,C装置的作用是②另取少量晶体于试管中,加水溶解,
 ,用相关的离子方程式说明产生该现象的原理:
,用相关的离子方程式说明产生该现象的原理:
您最近一年使用:0次
4 . Ⅰ.“价类”二维图是学习元素及其化合物的重要工具.如图所示是铁及其化合物的“价类”二维图。__________ 、__________ ;Z在空气中转化为W的化学方程式为__________ 。
(2)含重铬酸根离子 的工业废水有毒,必须经过处理达标后才能排放。工业上常用绿矾
的工业废水有毒,必须经过处理达标后才能排放。工业上常用绿矾 作处理剂,发生反应的离子方程式为
作处理剂,发生反应的离子方程式为 ,则该反应中还原性:
,则该反应中还原性:
______ (填“>”或“<”) 。该反应中,每生成
。该反应中,每生成 ,消耗
,消耗 的质量为
的质量为__________ g。
Ⅱ.硫酸亚铁晶体 在医药上作补血剂。某课外小组取10片补血剂总质量w g,通过一系列反应转变为
在医药上作补血剂。某课外小组取10片补血剂总质量w g,通过一系列反应转变为 来测定该补血剂中铁元素的含量。实验步骤如下:
来测定该补血剂中铁元素的含量。实验步骤如下:
(3)某同学发现部分补血剂药片表面发黄,怀疑该补铁剂已经变质,遂取少量步骤①的滤液,滴加__________ 后,溶液变为红色,证实了怀疑。
(4)步骤②反应的离子方程式为__________ ,下列物质中可以用来代替该步骤中的 是
是__________ (填序号)。
① 溶液 ②氯水 ③稀盐酸 ④碳酸钠
溶液 ②氯水 ③稀盐酸 ④碳酸钠
(5)服用维生素C可使食物中的 转化为
转化为 ,从而实现科学补铁,在这个过程中体现出维生素C的
,从而实现科学补铁,在这个过程中体现出维生素C的__________ 性。假设实验中的损耗忽略不计,则该补血剂含铁元素的质量分数为__________ 。

(2)含重铬酸根离子
 的工业废水有毒,必须经过处理达标后才能排放。工业上常用绿矾
的工业废水有毒,必须经过处理达标后才能排放。工业上常用绿矾 作处理剂,发生反应的离子方程式为
作处理剂,发生反应的离子方程式为 ,则该反应中还原性:
,则该反应中还原性:
 。该反应中,每生成
。该反应中,每生成 ,消耗
,消耗 的质量为
的质量为Ⅱ.硫酸亚铁晶体
 在医药上作补血剂。某课外小组取10片补血剂总质量w g,通过一系列反应转变为
在医药上作补血剂。某课外小组取10片补血剂总质量w g,通过一系列反应转变为 来测定该补血剂中铁元素的含量。实验步骤如下:
来测定该补血剂中铁元素的含量。实验步骤如下:
(3)某同学发现部分补血剂药片表面发黄,怀疑该补铁剂已经变质,遂取少量步骤①的滤液,滴加
(4)步骤②反应的离子方程式为
 是
是①
 溶液 ②氯水 ③稀盐酸 ④碳酸钠
溶液 ②氯水 ③稀盐酸 ④碳酸钠(5)服用维生素C可使食物中的
 转化为
转化为 ,从而实现科学补铁,在这个过程中体现出维生素C的
,从而实现科学补铁,在这个过程中体现出维生素C的
您最近一年使用:0次
2024-01-24更新
|
167次组卷
|
2卷引用:四川省内江市2023-2024学年高一上学期期末检测题化学试题
名校
5 . 硫酸锌广泛应用于工农业生产中。工业上以粗氧化锌(含 等杂质)为原料生产
等杂质)为原料生产 的一种流程的部分过程如下(各过程需控制适宜条件)。
的一种流程的部分过程如下(各过程需控制适宜条件)。
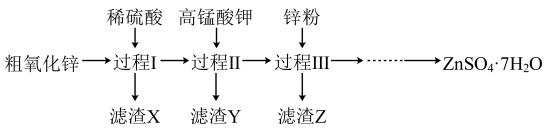
(1)过程Ⅰ、Ⅱ、Ⅲ中,分离出X、Y、Z的实验操作是_______ 。
(2)过程Ⅰ,能与稀硫酸反应的物质有________ 。写出生成氢气的离子方程式:_______ ,因此过程Ⅰ需要持续强制通风,原因是生成的氢气具有______ 性。
(3)过程Ⅱ中,滤渣Y含有 。加入高锰酸钾的主要目的是
。加入高锰酸钾的主要目的是_______ 。
(4)过程Ⅲ中,滤渣Z含铜,生成铜的离子方程式为________ 。
 等杂质)为原料生产
等杂质)为原料生产 的一种流程的部分过程如下(各过程需控制适宜条件)。
的一种流程的部分过程如下(各过程需控制适宜条件)。
(1)过程Ⅰ、Ⅱ、Ⅲ中,分离出X、Y、Z的实验操作是
(2)过程Ⅰ,能与稀硫酸反应的物质有
(3)过程Ⅱ中,滤渣Y含有
 。加入高锰酸钾的主要目的是
。加入高锰酸钾的主要目的是(4)过程Ⅲ中,滤渣Z含铜,生成铜的离子方程式为
您最近一年使用:0次
名校
6 . 铁及其化合物在日常生产生活中应用广泛,研究铁及其化合物的应用意义重大。
(1)所含铁元素只有还原性的物质是___________。
(2)当人体缺铁时,往往需要吃补铁保健品。人体能够吸收的是+2价的铁,但是+2价的铁很容易被氧化。
①如何检验某固体补铁剂中铁元素已被氧化?写出操作过程、现象及结论。
答:研细后用盐酸溶解,___________ 。
②服用维生素C,可使食物中的三价铁离子转化为二价铁离子。由此可推知,维生素C具有___________ (填化学性质)。
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、C1O-、OH-、FeO 、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:
、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:___________
______Fe(OH)3+_______ClO-+_______=_______FeO +_______Cl-+_______
+_______Cl-+_______
(4)工业上用氯化铁腐蚀铜箔、制造电路板。某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:

回答下列问题:
①试剂a是___________ ,操作I用到的玻璃仪器有烧杯、玻璃棒和___________ 。
②滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为___________ 。
③上述流程中操作Ⅲ包括:蒸发浓缩、___________ 、过滤、洗涤。
(1)所含铁元素只有还原性的物质是___________。
| A.Fe | B.FeCl2 | C.FeCl3 | D.Fe2O3 |
(2)当人体缺铁时,往往需要吃补铁保健品。人体能够吸收的是+2价的铁,但是+2价的铁很容易被氧化。
①如何检验某固体补铁剂中铁元素已被氧化?写出操作过程、现象及结论。
答:研细后用盐酸溶解,
②服用维生素C,可使食物中的三价铁离子转化为二价铁离子。由此可推知,维生素C具有
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、C1O-、OH-、FeO
 、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:
、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:______Fe(OH)3+_______ClO-+_______=_______FeO
 +_______Cl-+_______
+_______Cl-+_______(4)工业上用氯化铁腐蚀铜箔、制造电路板。某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:

回答下列问题:
①试剂a是
②滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为
③上述流程中操作Ⅲ包括:蒸发浓缩、
您最近一年使用:0次
名校
7 . 回答下列问题:
(1)从海水中得到的粗盐中常含 、
、 、
、 等杂质离子,可依次加入
等杂质离子,可依次加入_______ 、_______ 、_______ 、稀盐酸来进行提纯。加入适量盐酸的目的是_______ 。
(2)用上述方法得到氯化钠,配制氯化钠饱和溶液进行如下图所示电解实验。
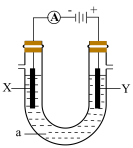
①写出该电解反应的化学方程式_______ 。
②简述检测Y极附近产生的气体的实验方案:_______
(3)下列方法可用于海水淡化的是_______ (填字母)。
A.蒸馏法 B.萃取法 C.过滤法
(4)①“84”消毒液是生活中常见的消毒剂, 与
与 溶液反应制取“84”消毒液的化学方程式为
溶液反应制取“84”消毒液的化学方程式为_______ 。
②“84”消毒液的稀溶液在浸泡餐具过程中,因吸收空气中 使消毒杀菌能力增强,产物中有小苏打,请用化学方程式说明原因:
使消毒杀菌能力增强,产物中有小苏打,请用化学方程式说明原因:_______ 。
(5)目前很多自来水厂使用 来消毒、杀菌。工业制取
来消毒、杀菌。工业制取 的反应:
的反应: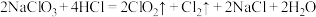 ,请用双线桥表示反应中电子转移情况
,请用双线桥表示反应中电子转移情况_______ 。
(6)物质的制备是化学学科的基本研究方向。
①室温下,将氨水和 溶液混合,可制得
溶液混合,可制得 溶液。离子方程式为
溶液。离子方程式为_______ 。
②软锰矿(主要成分 )的水悬浊液可吸收烟气中的
)的水悬浊液可吸收烟气中的 并同时制备
并同时制备 。制备
。制备 反应的化学方程式为
反应的化学方程式为_______ 。
(1)从海水中得到的粗盐中常含
 、
、 、
、 等杂质离子,可依次加入
等杂质离子,可依次加入(2)用上述方法得到氯化钠,配制氯化钠饱和溶液进行如下图所示电解实验。

①写出该电解反应的化学方程式
②简述检测Y极附近产生的气体的实验方案:
(3)下列方法可用于海水淡化的是
A.蒸馏法 B.萃取法 C.过滤法
(4)①“84”消毒液是生活中常见的消毒剂,
 与
与 溶液反应制取“84”消毒液的化学方程式为
溶液反应制取“84”消毒液的化学方程式为②“84”消毒液的稀溶液在浸泡餐具过程中,因吸收空气中
 使消毒杀菌能力增强,产物中有小苏打,请用化学方程式说明原因:
使消毒杀菌能力增强,产物中有小苏打,请用化学方程式说明原因:(5)目前很多自来水厂使用
 来消毒、杀菌。工业制取
来消毒、杀菌。工业制取 的反应:
的反应: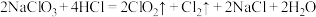 ,请用双线桥表示反应中电子转移情况
,请用双线桥表示反应中电子转移情况(6)物质的制备是化学学科的基本研究方向。
①室温下,将氨水和
 溶液混合,可制得
溶液混合,可制得 溶液。离子方程式为
溶液。离子方程式为②软锰矿(主要成分
 )的水悬浊液可吸收烟气中的
)的水悬浊液可吸收烟气中的 并同时制备
并同时制备 。制备
。制备 反应的化学方程式为
反应的化学方程式为
您最近一年使用:0次
8 . 某化工厂欲以工业生产废料(金属铁、铝及其氧化物)为原料制取PAFC(聚合氯化铁铝)[AlFe(OH)nCl6-n]m,设计生产流程如下,请回答下列问题:

(1)用10mol/L的浓盐酸配制2mol/L的稀盐酸500mL, 所取浓盐酸的体积________ mL,所用玻璃仪器除量筒、玻璃棒和胶头滴管外,还有_______ 。
A.500mL容量瓶 B.蒸发皿 C.烧瓶
(2)写出Fe2O3粉末与盐酸反应的离子方程式:_______________ 。
(3)取少量酸性溶液滴加几滴KSCN试剂,溶液变为______ 色,证明含有Fe3+。
(4)通入氯气的目的是___________________ 。
(5)加入NaOH调节pH时,氢氧化钠不宜过多,生成一种红褐色沉淀,写出溶液中Fe3+与过量NaOH反应的离子方程式:______________________ 。

(1)用10mol/L的浓盐酸配制2mol/L的稀盐酸500mL, 所取浓盐酸的体积
A.500mL容量瓶 B.蒸发皿 C.烧瓶
(2)写出Fe2O3粉末与盐酸反应的离子方程式:
(3)取少量酸性溶液滴加几滴KSCN试剂,溶液变为
(4)通入氯气的目的是
(5)加入NaOH调节pH时,氢氧化钠不宜过多,生成一种红褐色沉淀,写出溶液中Fe3+与过量NaOH反应的离子方程式:
您最近一年使用:0次
解题方法
9 . 我国拥有很长的海岸线,具有丰富的海洋资源。
Ⅰ.盐卤是海水晒盐后的富含镁盐的溶液,其中除含镁盐外,还含有其他盐类(如图甲所示)。
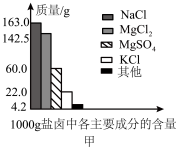
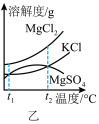
(1)根据图甲所示,写出盐卤中含量最多的盐为___________ (填化学式)其电子式为___________
(2)图乙是盐卤中某些物质的溶解度曲线,将盐卤加热到 ℃以上,根据溶解度曲线,首先析出的晶体应是
℃以上,根据溶解度曲线,首先析出的晶体应是___________ 。(填化学式)
(3)如图是常用于混合物的分离和提纯的装置:
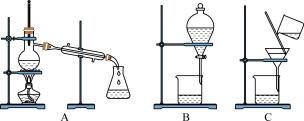
粗盐的提纯应选择图___________ (填字母,下同)装置,若实验中为了除去粗盐中的 、
、 、
、 等杂质离子加入试剂的顺序可以是
等杂质离子加入试剂的顺序可以是___________ 。
A.NaOH、Na2CO3、BaCl2、HCl B.NaOH、BaCl2、Na2CO3、HCl
C.Na2CO3、BaCl2、NaOH、HCl D.BaCl2、NaOH、Na2CO3、HCl
Ⅱ.海带是一种含碘量很高的海藻,从中提取的碘广泛应用于医药、食品和化工。实验室里从海带中提取碘的流程如图。
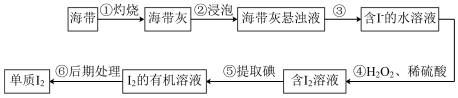
(4)实验步骤①会用到下列仪器中的___________ (填字母)
a.酒精灯 b.蒸发皿 c.坩埚 d.泥三角
(5)设计实验证明第③步操作后滤液中K+的存在,___________ 。
(6)“提取碘”存在以下两种方案。
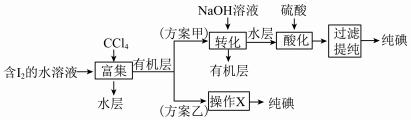
①方案乙中“操作X”的名称是___________ 。
②该流程可循环利用的物质是___________ 。
③采用方案乙得到纯碘的产率较低,原因是___________ 。
Ⅰ.盐卤是海水晒盐后的富含镁盐的溶液,其中除含镁盐外,还含有其他盐类(如图甲所示)。

(1)根据图甲所示,写出盐卤中含量最多的盐为
(2)图乙是盐卤中某些物质的溶解度曲线,将盐卤加热到
 ℃以上,根据溶解度曲线,首先析出的晶体应是
℃以上,根据溶解度曲线,首先析出的晶体应是
(3)如图是常用于混合物的分离和提纯的装置:

粗盐的提纯应选择图
 、
、 、
、 等杂质离子加入试剂的顺序可以是
等杂质离子加入试剂的顺序可以是A.NaOH、Na2CO3、BaCl2、HCl B.NaOH、BaCl2、Na2CO3、HCl
C.Na2CO3、BaCl2、NaOH、HCl D.BaCl2、NaOH、Na2CO3、HCl
Ⅱ.海带是一种含碘量很高的海藻,从中提取的碘广泛应用于医药、食品和化工。实验室里从海带中提取碘的流程如图。

(4)实验步骤①会用到下列仪器中的
a.酒精灯 b.蒸发皿 c.坩埚 d.泥三角
(5)设计实验证明第③步操作后滤液中K+的存在,
(6)“提取碘”存在以下两种方案。

①方案乙中“操作X”的名称是
②该流程可循环利用的物质是
③采用方案乙得到纯碘的产率较低,原因是
您最近一年使用:0次
10 . 废旧锂离子电池的回收利用意义重大,其正极废料的主要成分是 、铝、炭黑及其他微量杂质,回收利用的流程如下:
、铝、炭黑及其他微量杂质,回收利用的流程如下:________ ,“废渣1”的主要成分是_______ 。
(2)已知Li在化合物中显 价,
价, 中Co的化合价为
中Co的化合价为_____ ,“酸浸”步骤中 固体溶解的化学方程式为
固体溶解的化学方程式为_______ ,反应中 的作用为
的作用为_______ 。
(3)“酸浸”后的溶液中含有少量 、
、 、
、 ,滤渣2的主要成分是
,滤渣2的主要成分是______ 。
(4)沉钴过程发生的反应属于______ (填反应类型)。
(5)“母液”中的溶质成分是_______ ,生成 固体的离子方程式为
固体的离子方程式为________ 。
 、铝、炭黑及其他微量杂质,回收利用的流程如下:
、铝、炭黑及其他微量杂质,回收利用的流程如下: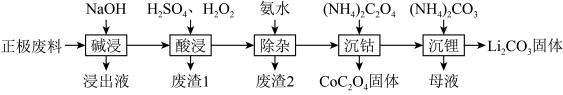
(2)已知Li在化合物中显
 价,
价, 中Co的化合价为
中Co的化合价为 固体溶解的化学方程式为
固体溶解的化学方程式为 的作用为
的作用为(3)“酸浸”后的溶液中含有少量
 、
、 、
、 ,滤渣2的主要成分是
,滤渣2的主要成分是(4)沉钴过程发生的反应属于
(5)“母液”中的溶质成分是
 固体的离子方程式为
固体的离子方程式为
您最近一年使用:0次



