名校
1 . 填空
(1)胆矾的化学式为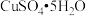 。
。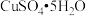 属于
属于___________ 。 (选填“纯净物”或“混合物”); 1mol 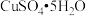 中约含有
中约含有___________ 个S原子
(2)湿法炼铜产生酸性废水,含有的H2SO4、CuSO4、 ZnSO4, 可用铁炭混合物(铁粉和活性炭的混合物)除去。其他条件不变,废水pH对Cu2+、Zn2+去除率的影响如图所示。
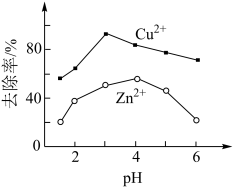
①pH<3时,铁炭混合物表面有大量气泡产生,产生该现象的化学方程式为___________ 。
②相同pH条件下,Cu2+的去除率远高于Zn2+的原因可能是___________ 。
(3)如图是某输液瓶标签上的部分内容。由此可知,葡萄糖由___________ 种元素组成,其中碳元素的质量分数为___________ 。要把 10 g 这种葡萄糖溶液稀释为 2%的溶液,需要加水的质量为___________ g。
(1)胆矾的化学式为
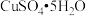 。
。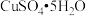 属于
属于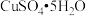 中约含有
中约含有(2)湿法炼铜产生酸性废水,含有的H2SO4、CuSO4、 ZnSO4, 可用铁炭混合物(铁粉和活性炭的混合物)除去。其他条件不变,废水pH对Cu2+、Zn2+去除率的影响如图所示。

①pH<3时,铁炭混合物表面有大量气泡产生,产生该现象的化学方程式为
②相同pH条件下,Cu2+的去除率远高于Zn2+的原因可能是
(3)如图是某输液瓶标签上的部分内容。由此可知,葡萄糖由
| 葡萄糖注射液 (C6H12O6) 【成分】葡萄糖,水 【规格】500mL 质量分数为 5% 【性状】液体,味甜 【贮藏】密闭保存 |
您最近一年使用:0次
2 . 某 样品中含有
样品中含有 杂质,为测定试样中的质量分数,某同学设计了三种方案:方案一:取
杂质,为测定试样中的质量分数,某同学设计了三种方案:方案一:取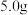 样品溶于水,加入适当指示剂,逐滴加入
样品溶于水,加入适当指示剂,逐滴加入 盐酸,待完全反应时,测定所消耗的盐酸的体积。回答下列问题:
盐酸,待完全反应时,测定所消耗的盐酸的体积。回答下列问题:
(1)上述测定需配制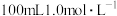 的盐酸;
的盐酸;
①若用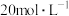 浓盐酸配制溶液,需量取浓盐酸
浓盐酸配制溶液,需量取浓盐酸_____  。
。
②配制过程中不需要用到的仪器是_____ (填仪器名称)。

③配制过程中若出现以下情况,将导致所配制溶液浓度偏低的是_____ (填字母)
A.没有洗涤烧杯和玻璃棒
B.如果加水超过了刻度线,取出水使液面恰好到刻度线
C.量取浓盐酸时仰视刻度线
D.定容时俯视刻度线
(2)若测得消耗盐酸的体积为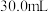 ,样品中
,样品中 的质量分数为
的质量分数为_____ 。
方案二:按下述操作流程进行测定:
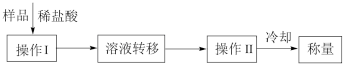
回答下列问题:
(3)操作Ⅱ的名称是_____ 。
(4)流程中称量的是_____ (填化学式)的质量。
方案三:称取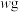 样品按如图装置进行测定。
样品按如图装置进行测定。
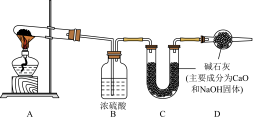
(5)装置A中反应的化学方程式为_____ 。
(6)装置 的作用是
的作用是_____ 。
 样品中含有
样品中含有 杂质,为测定试样中的质量分数,某同学设计了三种方案:方案一:取
杂质,为测定试样中的质量分数,某同学设计了三种方案:方案一:取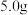 样品溶于水,加入适当指示剂,逐滴加入
样品溶于水,加入适当指示剂,逐滴加入 盐酸,待完全反应时,测定所消耗的盐酸的体积。回答下列问题:
盐酸,待完全反应时,测定所消耗的盐酸的体积。回答下列问题:(1)上述测定需配制
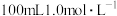 的盐酸;
的盐酸;①若用
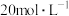 浓盐酸配制溶液,需量取浓盐酸
浓盐酸配制溶液,需量取浓盐酸 。
。②配制过程中不需要用到的仪器是

③配制过程中若出现以下情况,将导致所配制溶液浓度偏低的是
A.没有洗涤烧杯和玻璃棒
B.如果加水超过了刻度线,取出水使液面恰好到刻度线
C.量取浓盐酸时仰视刻度线
D.定容时俯视刻度线
(2)若测得消耗盐酸的体积为
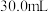 ,样品中
,样品中 的质量分数为
的质量分数为方案二:按下述操作流程进行测定:

回答下列问题:
(3)操作Ⅱ的名称是
(4)流程中称量的是
方案三:称取
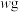 样品按如图装置进行测定。
样品按如图装置进行测定。
(5)装置A中反应的化学方程式为
(6)装置
 的作用是
的作用是
您最近一年使用:0次
名校
解题方法
3 . 经检测,某化工厂排出的废水呈酸性,且其中含有大量  、
、 、
、 、
、 、
、 。回答下列问题:
。回答下列问题:
(1)下列离子中,能大量存在于该废水中的是_______ 填标号
填标号
(2)取 该废水于烧杯,逐滴加入
该废水于烧杯,逐滴加入 溶液至呈碱性过程中,原废水中存在的离子的量会发生变化的是
溶液至呈碱性过程中,原废水中存在的离子的量会发生变化的是 、
、____  用离子符号表示
用离子符号表示 。
。
(3)某化学社团小组成员欲除去废水样品中的 和
和 ,最终得到中性溶液,设计的方案流程如图:
,最终得到中性溶液,设计的方案流程如图:
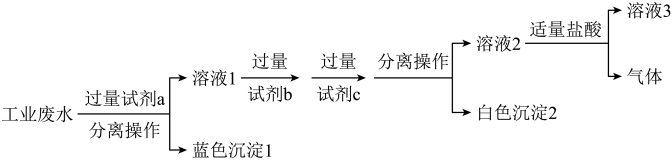
 试剂
试剂 为
为_______  写化学式
写化学式 ;溶液
;溶液 所含溶质离子有
所含溶质离子有 、
、________ 。
 “分离操作”的名称是
“分离操作”的名称是______ ,需用到的玻璃仪器主要有______ 。
 向“白色沉淀
向“白色沉淀 ”中加入足量盐酸,发生反应的离子方程式为
”中加入足量盐酸,发生反应的离子方程式为______ 。
 、
、 、
、 、
、 、
、 。回答下列问题:
。回答下列问题:(1)下列离子中,能大量存在于该废水中的是_______
 填标号
填标号
A. | B. | C. | D. |
 该废水于烧杯,逐滴加入
该废水于烧杯,逐滴加入 溶液至呈碱性过程中,原废水中存在的离子的量会发生变化的是
溶液至呈碱性过程中,原废水中存在的离子的量会发生变化的是 、
、 用离子符号表示
用离子符号表示 。
。(3)某化学社团小组成员欲除去废水样品中的
 和
和 ,最终得到中性溶液,设计的方案流程如图:
,最终得到中性溶液,设计的方案流程如图:
 试剂
试剂 为
为 写化学式
写化学式 ;溶液
;溶液 所含溶质离子有
所含溶质离子有 、
、 “分离操作”的名称是
“分离操作”的名称是 向“白色沉淀
向“白色沉淀 ”中加入足量盐酸,发生反应的离子方程式为
”中加入足量盐酸,发生反应的离子方程式为
您最近一年使用:0次
2023-07-30更新
|
544次组卷
|
8卷引用:山东省青岛市黄岛区2020-2021学年高一上学期期中考试化学试题
4 . 软锰矿(主要成分 ,杂质金属元素Fe、Al、Mg等)的水悬浊液可吸收烟气中
,杂质金属元素Fe、Al、Mg等)的水悬浊液可吸收烟气中 并同时制备
并同时制备
(1)制备 反应的化学方程式为
反应的化学方程式为______ ,质量为26.10g纯净 最多能吸收
最多能吸收______ L(标准状况) 。
。
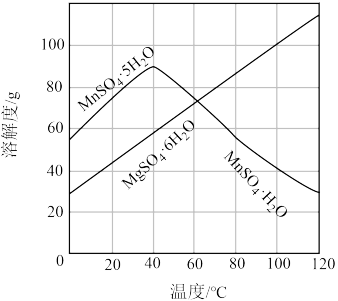
(2)如图为 、
、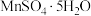 、
、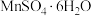 等晶体的溶解度曲线,请设计从
等晶体的溶解度曲线,请设计从 和
和 混合溶液中结晶
混合溶液中结晶 晶体的实验方案
晶体的实验方案______ 。
(3)准确称取0.3420g 样品置于锥形瓶中,加入适量
样品置于锥形瓶中,加入适量 和
和 溶液,加热使
溶液,加热使 全部反应生成
全部反应生成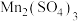 ,用
,用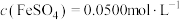 的标准溶液与
的标准溶液与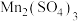 恰好反应[反应方程式:
恰好反应[反应方程式: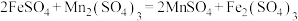 ],消耗
],消耗 溶液40.00mL。计算
溶液40.00mL。计算 样品的纯度
样品的纯度_____ 。(请写出计算过程)
 ,杂质金属元素Fe、Al、Mg等)的水悬浊液可吸收烟气中
,杂质金属元素Fe、Al、Mg等)的水悬浊液可吸收烟气中 并同时制备
并同时制备
(1)制备
 反应的化学方程式为
反应的化学方程式为 最多能吸收
最多能吸收 。
。(2)如图为
 、
、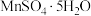 、
、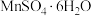 等晶体的溶解度曲线,请设计从
等晶体的溶解度曲线,请设计从 和
和 混合溶液中结晶
混合溶液中结晶 晶体的实验方案
晶体的实验方案
(3)准确称取0.3420g
 样品置于锥形瓶中,加入适量
样品置于锥形瓶中,加入适量 和
和 溶液,加热使
溶液,加热使 全部反应生成
全部反应生成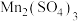 ,用
,用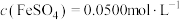 的标准溶液与
的标准溶液与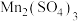 恰好反应[反应方程式:
恰好反应[反应方程式: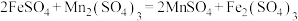 ],消耗
],消耗 溶液40.00mL。计算
溶液40.00mL。计算 样品的纯度
样品的纯度
您最近一年使用:0次
5 . 海洋资源的利用具有非常广阔的前景。
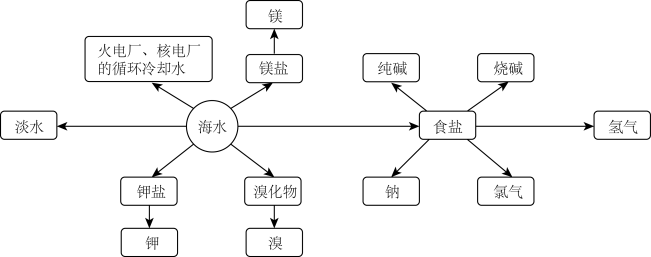
回答下列问题:
(1)实验室模拟蒸馏法淡化海水时,应向蒸馏烧瓶中加入沸石,目的是_______ 。
(2)粗盐中可溶性杂质离子包含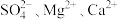 ,要除去这些杂质离子得到精盐水,加入试剂的顺序可为
,要除去这些杂质离子得到精盐水,加入试剂的顺序可为_______ (填字母)。
a. 溶液、
溶液、 溶液、
溶液、 溶液、盐酸
溶液、盐酸
b. 溶液、
溶液、 溶液、
溶液、 溶液、盐酸
溶液、盐酸
c. 溶液、
溶液、 溶液、
溶液、 溶液、盐酸
溶液、盐酸
(3)无水 在熔融状态下通电会产生
在熔融状态下通电会产生 和
和 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
(4)从海带中提取碘的实验过程如下图所示:
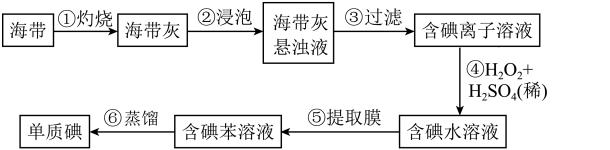
i.步骤①中灼烧海带时,应将海带放入_______ (填仪器名称)中灼烧。
ii.请写出步骤④反应的离子方程式:_______ 。

回答下列问题:
(1)实验室模拟蒸馏法淡化海水时,应向蒸馏烧瓶中加入沸石,目的是
(2)粗盐中可溶性杂质离子包含
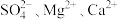 ,要除去这些杂质离子得到精盐水,加入试剂的顺序可为
,要除去这些杂质离子得到精盐水,加入试剂的顺序可为a.
 溶液、
溶液、 溶液、
溶液、 溶液、盐酸
溶液、盐酸b.
 溶液、
溶液、 溶液、
溶液、 溶液、盐酸
溶液、盐酸c.
 溶液、
溶液、 溶液、
溶液、 溶液、盐酸
溶液、盐酸(3)无水
 在熔融状态下通电会产生
在熔融状态下通电会产生 和
和 ,该反应的化学方程式为
,该反应的化学方程式为(4)从海带中提取碘的实验过程如下图所示:

i.步骤①中灼烧海带时,应将海带放入
ii.请写出步骤④反应的离子方程式:
您最近一年使用:0次
6 . 海带中含有碘元素,从海带中提取碘的实验过程如下所示。
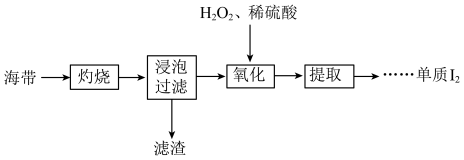
(1)“灼烧”时用到下列仪器中的___________。
(2)“浸泡过滤”后滤液中含有I-,“氧化”的离子方程式为___________ 。
(3)检验“氧化”产生I2的操作:取“氧化”后的少量溶液于试管中,___________ (实验操作及现象)。
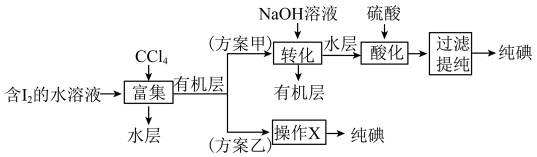
(4)“提取”存在以下两种方案。
已知: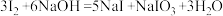 ;酸性条件下,I2在水溶液中的溶解度很小。
;酸性条件下,I2在水溶液中的溶解度很小。
①方案乙中“操作X”的名称是___________ 。
②方案甲中,“酸化”步骤氧化剂与还原剂物质的量之比为___________ 。
③该流程可循环利用的物质是___________ 。
④采用方案乙得到纯碘的产率较低,原因是___________ 。

(1)“灼烧”时用到下列仪器中的___________。
| A.酒精灯 | B.漏斗 | C.蒸发皿 | D.坩埚 |
(3)检验“氧化”产生I2的操作:取“氧化”后的少量溶液于试管中,
(4)“提取”存在以下两种方案。

已知:
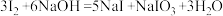 ;酸性条件下,I2在水溶液中的溶解度很小。
;酸性条件下,I2在水溶液中的溶解度很小。①方案乙中“操作X”的名称是
②方案甲中,“酸化”步骤氧化剂与还原剂物质的量之比为
③该流程可循环利用的物质是
④采用方案乙得到纯碘的产率较低,原因是
您最近一年使用:0次
名校
7 . 自古至今,铁及其化合物在人类生产生活中的使用发挥了巨大的作用。
(1)四大发明之一的司南是由天然磁石制成的,其主要成分是___________ (填化学式) 。
(2)由于Fe(OH)2易被氧化,所以制备时常隔绝空气制备,写出Fe(OH)2露置在空气中被氧化的化学方程式___________ 。
(3)某工业废渣wg (主要含二氧化硅、氧化铁、氧化镁)中提取氧化铁的工业流程如图(部分操作和条件略):
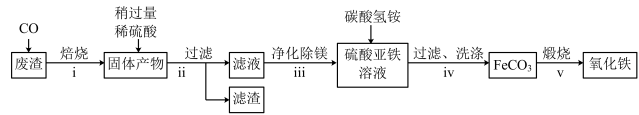
提示:二氧化硅不溶于稀硫酸。
①验证硫酸亚铁溶液中是否存在Fe3+的常用的试剂是___________ (填化学式)。
②步骤Ⅴ中,发生反应的化学方程式为___________ 。
③若提取过程中铁元素的损耗忽略不计,最终获得n g的氧化铁。则废渣中铁元素的质量分数为___________ 。
(1)四大发明之一的司南是由天然磁石制成的,其主要成分是
(2)由于Fe(OH)2易被氧化,所以制备时常隔绝空气制备,写出Fe(OH)2露置在空气中被氧化的化学方程式
(3)某工业废渣wg (主要含二氧化硅、氧化铁、氧化镁)中提取氧化铁的工业流程如图(部分操作和条件略):

提示:二氧化硅不溶于稀硫酸。
①验证硫酸亚铁溶液中是否存在Fe3+的常用的试剂是
②步骤Ⅴ中,发生反应的化学方程式为
③若提取过程中铁元素的损耗忽略不计,最终获得n g的氧化铁。则废渣中铁元素的质量分数为
您最近一年使用:0次
2023-07-10更新
|
327次组卷
|
2卷引用:福建省福州第一中学2022-2023学年高一下学期期末考试化学试题
名校
解题方法
8 . 硅是带来人类文明的重要元素之一,硅与二氧化硅广泛应用于通讯行业。
(1)工业上常用石英砂与焦炭在高温下反应制粗硅,其化学方程式是___________ 。
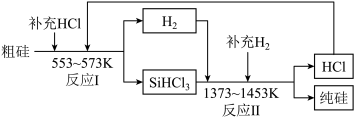
(2)工业上可以通过如图所示的流程制取纯硅:___________ 。
②整个过程中必须严格控制无氧。在有氧环境下,除了有不安全因素外还可能使产品中混有杂质___________ 。整个过程中可以循环利用的物质是___________ (填化学式)。
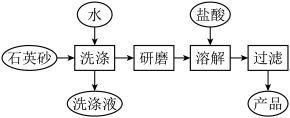
(3)如图是用海边的石英砂(含氯化钠、氧化铝等杂质)制备二氧化硅粗产品的工艺流程。___________ 。
②将洗净的石英砂研磨成粉末,目的是___________ 。
③在以上流程中,能否将盐酸改为NaOH溶液,请说明理由___________ 。
(1)工业上常用石英砂与焦炭在高温下反应制粗硅,其化学方程式是
(2)工业上可以通过如图所示的流程制取纯硅:
②整个过程中必须严格控制无氧。在有氧环境下,除了有不安全因素外还可能使产品中混有杂质
(3)如图是用海边的石英砂(含氯化钠、氧化铝等杂质)制备二氧化硅粗产品的工艺流程。
②将洗净的石英砂研磨成粉末,目的是
③在以上流程中,能否将盐酸改为NaOH溶液,请说明理由
您最近一年使用:0次
2023-07-06更新
|
207次组卷
|
5卷引用:辽宁省沈阳市第二中学2022-2023学年高一下学期第一阶段测试化学试题
9 . 以硫铁矿(主要成分为 ,含少量的
,含少量的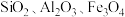 )为原料制备高铁酸钾
)为原料制备高铁酸钾 ,其可用于去除水体中的As(III)。已知:
,其可用于去除水体中的As(III)。已知: 氧化性强,易溶于水,微溶于
氧化性强,易溶于水,微溶于 浓溶液。
浓溶液。
(1)制备 。需要将焙烧后的硫铁矿粉经过“酸浸
。需要将焙烧后的硫铁矿粉经过“酸浸 还原
还原 除铝
除铝 氧化”等过程。
氧化”等过程。
①酸浸。将焙烧后的硫铁矿粉,缓慢加入一定浓度的稀硫酸中充分反应,过滤。酸浸时需适当提高溶液的温度,其目的是_______ 。
②还原。向滤液中加入 固体,充分反应至溶液中
固体,充分反应至溶液中 全部被还原,同时生成
全部被还原,同时生成 。其反应的离子方程式为
。其反应的离子方程式为_______ 。
③除铝。向还原后的溶液中加入 固体,不断搅拌,使
固体,不断搅拌,使 完全转化为
完全转化为 ,同时产生一种气体,过滤,得
,同时产生一种气体,过滤,得 溶液。此过程中产生的气体是
溶液。此过程中产生的气体是_______ 。
(2)制备高铁酸钾。向 和
和 混合溶液中加入
混合溶液中加入 ,得到
,得到 溶液,再向溶液中加入饱和
溶液,再向溶液中加入饱和 溶液,过滤得到
溶液,过滤得到 固体。
固体。
①制备 的离子方程式为
的离子方程式为_______ 。
②向反应后的溶液中加入饱和 溶液能将
溶液能将 转化为
转化为 ,其原因可能是
,其原因可能是_______ 。
(3) 的应用。已知:
的应用。已知: (Ⅴ)更容易被
(Ⅴ)更容易被 (Ⅲ)吸附去除。向某废水样品导[
(Ⅲ)吸附去除。向某废水样品导[ 元素主要以
元素主要以 (Ⅲ)存在]加入
(Ⅲ)存在]加入 或
或 后,水中铁浓度对
后,水中铁浓度对 去除率的影响如图所示。在铁浓度相同条件下,使用
去除率的影响如图所示。在铁浓度相同条件下,使用 对
对 的去除率比使用
的去除率比使用 时高的原因是
时高的原因是_______ 。
 ,含少量的
,含少量的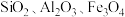 )为原料制备高铁酸钾
)为原料制备高铁酸钾 ,其可用于去除水体中的As(III)。已知:
,其可用于去除水体中的As(III)。已知: 氧化性强,易溶于水,微溶于
氧化性强,易溶于水,微溶于 浓溶液。
浓溶液。(1)制备
 。需要将焙烧后的硫铁矿粉经过“酸浸
。需要将焙烧后的硫铁矿粉经过“酸浸 还原
还原 除铝
除铝 氧化”等过程。
氧化”等过程。①酸浸。将焙烧后的硫铁矿粉,缓慢加入一定浓度的稀硫酸中充分反应,过滤。酸浸时需适当提高溶液的温度,其目的是
②还原。向滤液中加入
 固体,充分反应至溶液中
固体,充分反应至溶液中 全部被还原,同时生成
全部被还原,同时生成 。其反应的离子方程式为
。其反应的离子方程式为③除铝。向还原后的溶液中加入
 固体,不断搅拌,使
固体,不断搅拌,使 完全转化为
完全转化为 ,同时产生一种气体,过滤,得
,同时产生一种气体,过滤,得 溶液。此过程中产生的气体是
溶液。此过程中产生的气体是(2)制备高铁酸钾。向
 和
和 混合溶液中加入
混合溶液中加入 ,得到
,得到 溶液,再向溶液中加入饱和
溶液,再向溶液中加入饱和 溶液,过滤得到
溶液,过滤得到 固体。
固体。①制备
 的离子方程式为
的离子方程式为②向反应后的溶液中加入饱和
 溶液能将
溶液能将 转化为
转化为 ,其原因可能是
,其原因可能是(3)
 的应用。已知:
的应用。已知: (Ⅴ)更容易被
(Ⅴ)更容易被 (Ⅲ)吸附去除。向某废水样品导[
(Ⅲ)吸附去除。向某废水样品导[ 元素主要以
元素主要以 (Ⅲ)存在]加入
(Ⅲ)存在]加入 或
或 后,水中铁浓度对
后,水中铁浓度对 去除率的影响如图所示。在铁浓度相同条件下,使用
去除率的影响如图所示。在铁浓度相同条件下,使用 对
对 的去除率比使用
的去除率比使用 时高的原因是
时高的原因是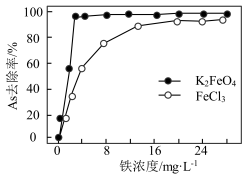
您最近一年使用:0次
名校
10 . 溶液在日常生活、工农业生产和科学研究中具有广泛用途。
(1)60℃时,KNO3的溶解度为_______ 。
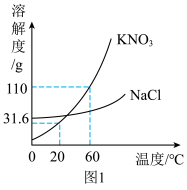
(2)20℃时,将20gKNO3加入到50g水中,充分溶解后所得溶液的质量为_______ g。
(3)除去KNO3溶液中混有的少量的NaCl,提纯的方法是_______ 。
(4)60℃,将KNO3和NaCl两种物质的饱和溶液降温至20℃,质量分数的大小关系为_______ 。
(5)探究温度对溶解度的影响,如图2所示。固体X是NH4NO3或NaOH,固体Y是KNO3或Ca(OH)2,烧杯中盛放20℃Y的饱和溶液(有少量Y的固体则余),往试管中滴入适量水,烧杯中固体逐渐消失,写出X与Y可能的组合有_______ 。
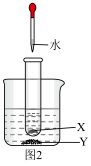
(1)60℃时,KNO3的溶解度为

(2)20℃时,将20gKNO3加入到50g水中,充分溶解后所得溶液的质量为
(3)除去KNO3溶液中混有的少量的NaCl,提纯的方法是
(4)60℃,将KNO3和NaCl两种物质的饱和溶液降温至20℃,质量分数的大小关系为
(5)探究温度对溶解度的影响,如图2所示。固体X是NH4NO3或NaOH,固体Y是KNO3或Ca(OH)2,烧杯中盛放20℃Y的饱和溶液(有少量Y的固体则余),往试管中滴入适量水,烧杯中固体逐渐消失,写出X与Y可能的组合有

您最近一年使用:0次



