名校
1 . 氯元素能与许多元素形成种类繁多的化合物,这些含氯化合物在生活及工农业生产中发挥着重要的作用。完成下列填空:
(1)从海水中获取粗盐的方法是_______ 。
(2)利用电解饱和食盐水可以制备氢气、氯气、氢氧化钠。电解时阳极产物为_______ ,该产物的检验方法为_______ 。
(3)工业上用氯气和消石灰反应制备漂白粉,其有效成分是_______ (填化学式);
(4)H2与Cl2在点燃条件下可以制取HCl。某同学对HCl性质进行如下预测:
①从物质类别上看,HCl属于酸,其水溶液能与碳酸钙反应,相应的离子方程式为_______ 。
②从化合价角度看,HCl能与KMnO4溶液发生氧化还原反应产生黄绿色气体, 被还原成Mn2+,写出该反应的化学方程式,并用单桥线标出电子转移的方向和数目。
被还原成Mn2+,写出该反应的化学方程式,并用单桥线标出电子转移的方向和数目。_______ 。盐酸在反应中表现出来的性质是_______ 。
(5)已知HClO4是强酸,HClO4在水中的电离方程式为_______ 。
(1)从海水中获取粗盐的方法是
(2)利用电解饱和食盐水可以制备氢气、氯气、氢氧化钠。电解时阳极产物为
(3)工业上用氯气和消石灰反应制备漂白粉,其有效成分是
(4)H2与Cl2在点燃条件下可以制取HCl。某同学对HCl性质进行如下预测:
①从物质类别上看,HCl属于酸,其水溶液能与碳酸钙反应,相应的离子方程式为
②从化合价角度看,HCl能与KMnO4溶液发生氧化还原反应产生黄绿色气体,
 被还原成Mn2+,写出该反应的化学方程式,并用单桥线标出电子转移的方向和数目。
被还原成Mn2+,写出该反应的化学方程式,并用单桥线标出电子转移的方向和数目。(5)已知HClO4是强酸,HClO4在水中的电离方程式为
您最近一年使用:0次
名校
2 . 侯德榜是我国制碱工业的先驱,为纯碱和氮肥工业的发展作出了杰出贡献,工业纯碱中可能混有少量NaCl,同学们对工业纯碱样品展开探究。
(1)如下图甲取样品于锥形瓶中,加入足量稀盐酸。反应结束后,根据干燥管增重计算 的质量分数。
的质量分数。

若结果大于100%,可能的原因是_______ 。
(2)图乙为 和NaCl的溶解度曲线。为提纯含少量NaCl的纯碱样品,将其浓溶液从
和NaCl的溶解度曲线。为提纯含少量NaCl的纯碱样品,将其浓溶液从 ℃冷却至
℃冷却至 ℃,
℃, ~
~ 的最优范围是
的最优范围是_______ (填字母)。
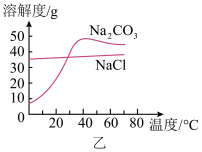
A.40~10 B.60~30 C.70~40
(1)如下图甲取样品于锥形瓶中,加入足量稀盐酸。反应结束后,根据干燥管增重计算
 的质量分数。
的质量分数。
若结果大于100%,可能的原因是
(2)图乙为
 和NaCl的溶解度曲线。为提纯含少量NaCl的纯碱样品,将其浓溶液从
和NaCl的溶解度曲线。为提纯含少量NaCl的纯碱样品,将其浓溶液从 ℃冷却至
℃冷却至 ℃,
℃, ~
~ 的最优范围是
的最优范围是
A.40~10 B.60~30 C.70~40
您最近一年使用:0次
名校
解题方法
3 . 抗原检测盒中T线处是使用的胶体金(Au)标记物,一种从被FeS2包裹的含金矿物中提金的工艺流程如下:
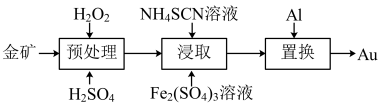
(1)①“预处理”时,FeS2被氧化为Fe2(SO4)3,写出该反应的离子方程式_______ 。
②研究发现H2O2在Fe2+的催化作用下产生具有强氧化能力的中间体·OH,·OH将金表面的FeS2氧化溶出。FeS2溶出率与硫酸初始浓度的关系如图所示,随着硫酸初始浓度的增大,FeS2溶出率逐渐提高的主要原因是_______ 。

(2)“置换”时需维持无氧环境,其主要原因是_______ 。
(3)测定样品中Au的含量:准确称取0.1000g试样,加入王水,将Au转化成具有强氧化性的氯金酸(HAuCl4),在除去硝酸根后的溶液中,边不断搅拌,边向溶液中加入过量0.4000mol·L-1 FeSO4溶液30.00mL,将HAuCl4完全还原为Au:滴加二苯胺磺酸钠作指示剂,用0.1000mol·L-1 K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液18.00mL。
已知: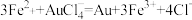

计算样品中金的质量分数(写出计算过程)_______ 。

(1)①“预处理”时,FeS2被氧化为Fe2(SO4)3,写出该反应的离子方程式
②研究发现H2O2在Fe2+的催化作用下产生具有强氧化能力的中间体·OH,·OH将金表面的FeS2氧化溶出。FeS2溶出率与硫酸初始浓度的关系如图所示,随着硫酸初始浓度的增大,FeS2溶出率逐渐提高的主要原因是

(2)“置换”时需维持无氧环境,其主要原因是
(3)测定样品中Au的含量:准确称取0.1000g试样,加入王水,将Au转化成具有强氧化性的氯金酸(HAuCl4),在除去硝酸根后的溶液中,边不断搅拌,边向溶液中加入过量0.4000mol·L-1 FeSO4溶液30.00mL,将HAuCl4完全还原为Au:滴加二苯胺磺酸钠作指示剂,用0.1000mol·L-1 K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液18.00mL。
已知:
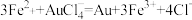

计算样品中金的质量分数(写出计算过程)
您最近一年使用:0次
解题方法
4 . 纯碱是一种重要的工业原料,可用于生活洗涤、食品加工和工业制玻璃等,可用侯氏制碱法制备,其流程如下(部分物质已略去):
已知:通常状况下,1体积水大约溶解1体积 或700体积
或700体积 ;
; 溶于水后,溶液显碱性。
溶于水后,溶液显碱性。

(1)为除去食盐水中的 、
、 、
、 ,可先
,可先_______ (填选项字母),过滤后加适量盐酸,再蒸发浓缩得饱和溶液。
A.加NaOH溶液,后加 溶液,再加钡试剂溶液
溶液,再加钡试剂溶液
B.加NaOH溶液,后加钡试剂溶液,再加 溶液
溶液
C.加钡试剂溶液,后加NaOH溶液,再加 溶液
溶液
除去 时,该钡试剂最好为
时,该钡试剂最好为_______ 。
A. B.
B. C.
C.
(2)向饱和食盐水中先通入的气体为_______ ,分析其原因_______ 。
(3)过程①的实验操作为_______ 、洗涤、干燥,检验所得小苏打中不含 的方法为
的方法为_______ 。
(4)过程②的化学方程式为_______ 。
(5)该制备可得到的副产品为_______ 。
已知:通常状况下,1体积水大约溶解1体积
 或700体积
或700体积 ;
; 溶于水后,溶液显碱性。
溶于水后,溶液显碱性。
(1)为除去食盐水中的
 、
、 、
、 ,可先
,可先A.加NaOH溶液,后加
 溶液,再加钡试剂溶液
溶液,再加钡试剂溶液B.加NaOH溶液,后加钡试剂溶液,再加
 溶液
溶液C.加钡试剂溶液,后加NaOH溶液,再加
 溶液
溶液除去
 时,该钡试剂最好为
时,该钡试剂最好为A.
 B.
B. C.
C.
(2)向饱和食盐水中先通入的气体为
(3)过程①的实验操作为
 的方法为
的方法为(4)过程②的化学方程式为
(5)该制备可得到的副产品为
您最近一年使用:0次
名校
解题方法
5 . 铁是人类较早使用的金属之一,完成下列问题。
(1)下列铁的化合物中,可以由单质直接化合得到的是___________(用字母代号填)。
(2)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,与水反应可生成透明的红褐色胶体。
上述反应的离子方程式如下,请将方程式补写完整_______ 。
___________ +_______H2O=_______Fe(OH)3(胶体)+________O2↑+_________OH-
+_______H2O=_______Fe(OH)3(胶体)+________O2↑+_________OH-
(3)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
①写出FeCl3溶液与金属铜发生反应的化学方程式___________ 。
②某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,采用下列步骤:

请写出上述过程中滤渣③中所含成分的化学式_________ ,物质⑥的化学式___________ 。
(4)把1.1g铁、铝混合物溶于200ml5mol/L盐酸中,反应后盐酸的浓度变为4.6mol/L(溶液体积变化忽略不计)。求①反应中消耗HCl的物质的量________________ 。
②该混合物中铝的物质的量________________ ,铁的物质的量 _________ 。
(1)下列铁的化合物中,可以由单质直接化合得到的是___________(用字母代号填)。
| A.Fe(OH)2 | B.FeCl3 | C.Fe(OH)3 | D.Fe3O4 |
上述反应的离子方程式如下,请将方程式补写完整
___________
 +_______H2O=_______Fe(OH)3(胶体)+________O2↑+_________OH-
+_______H2O=_______Fe(OH)3(胶体)+________O2↑+_________OH-(3)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
①写出FeCl3溶液与金属铜发生反应的化学方程式
②某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,采用下列步骤:

请写出上述过程中滤渣③中所含成分的化学式
(4)把1.1g铁、铝混合物溶于200ml5mol/L盐酸中,反应后盐酸的浓度变为4.6mol/L(溶液体积变化忽略不计)。求①反应中消耗HCl的物质的量
②该混合物中铝的物质的量
您最近一年使用:0次
2023-01-07更新
|
290次组卷
|
2卷引用:四川省成都高新实验中学2022-2023学年高一上学期期末检测化学试题
名校
解题方法
6 . 某磁铁矿石A的主要成分是磁性氧化铁(Fe3O4),还含少量的Al2O3、Cu2O。某工厂利用此矿石进行有关物质的回收利用,工艺流程如图:(已知Cu2O不溶于水和碱,但溶于酸:Cu2O+2H+=Cu+Cu2++H2O)。根据流程回答下列问题:
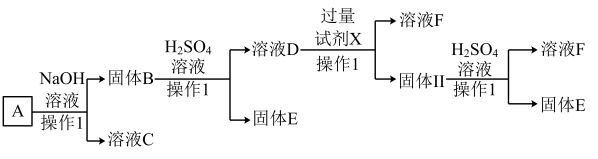
(1)溶液C的主要成分是_______ 。
(2)在溶液F中滴加NaOH溶液的现象是_______ ;发生的化学反应方程式为_______ 。
(3)检验溶液F中金属离子的方法是:_______ (请写出实验操作和现象、结论)

(1)溶液C的主要成分是
(2)在溶液F中滴加NaOH溶液的现象是
(3)检验溶液F中金属离子的方法是:
您最近一年使用:0次
解题方法
7 . 某工厂的工业废水中含有大量的FeSO4和较多的Cu2+。为了减少污染并变废为宝,工厂计划从该废水中回收FeSO4和金属铜。请根据以下流程图,回答下列问题:
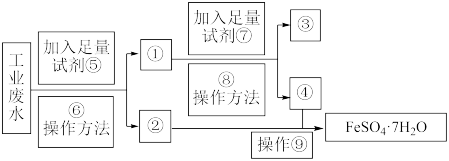
(1)⑥操作方法的名称是_______ ;操作⑨包括:蒸发浓缩、_______ 、过滤、洗涤、低温干燥。
(2)加入试剂⑤发生反应的离子方程式为_______ 。
(3)试剂⑦的化学式为_______ 。
(4)某兴趣小组同学欲鉴别④中的金属阳离子,设计如下实验:
甲同学取2.0 mL ④溶液,滴加氢氧化钠溶液,产生白色沉淀且很快变为灰绿色,最后变为红褐色沉淀,其中涉及氧化还原反应的化学方程式为_______ 。
乙同学取2.0 mL ④溶液,先加入几滴KSCN溶液,无明显现象,再加入几滴氯水,溶液变红,其中涉及氧化还原反应的离子方程式为_______ 。

(1)⑥操作方法的名称是
(2)加入试剂⑤发生反应的离子方程式为
(3)试剂⑦的化学式为
(4)某兴趣小组同学欲鉴别④中的金属阳离子,设计如下实验:
甲同学取2.0 mL ④溶液,滴加氢氧化钠溶液,产生白色沉淀且很快变为灰绿色,最后变为红褐色沉淀,其中涉及氧化还原反应的化学方程式为
乙同学取2.0 mL ④溶液,先加入几滴KSCN溶液,无明显现象,再加入几滴氯水,溶液变红,其中涉及氧化还原反应的离子方程式为
您最近一年使用:0次
名校
8 . 混合物的除杂
| 混合物(括号内为杂质) | 除杂试剂 | 发生反应的离子方程式 |
 (Fe3+) (Fe3+) | ① | |
 溶液( 溶液( 溶液) 溶液) | ② | |
 (Cu2+) (Cu2+) | ③ | |
| Fe(Al) | ④ | |
 ( ( ) ) | ⑤ |
您最近一年使用:0次
解题方法
9 . 选用化学方法除去下列物质中混有的少量杂质,写出有关反应的离子方程式。
(1)氧化铁中混有氧化铝_______ ,_______ 。
(2)氧化铜中混有氧化钠_______ ,_______ 。
(3)铜粉中混有氧化铜_______ ,_______ 。
(4)铁粉中混有氧化亚铁_______ ,_______ 。
(1)氧化铁中混有氧化铝
(2)氧化铜中混有氧化钠
(3)铜粉中混有氧化铜
(4)铁粉中混有氧化亚铁
您最近一年使用:0次
名校
解题方法
10 . 钠长石是地表岩石最重要的造岩矿物,也是工业生产的重要原料。钠长石富含钠元素,同时还有少量的钙和铁元素,铁元素在矿石中既有+2 价 Fe(II)也有+3 价 Fe(III)。钠长石的化学式为:NaxFe4CaO7,以该矿石为原料制备金属钠的工艺流程如下:
请回答下列问题:
(1)“粉碎研磨”的作用是_______ 。
(2)写出 NaClO 与溶液 A 反应的离子方程式_______ 。下面物质中可以替换 NaClO 的是_______ (填字母)。
A.H2O2 B.NaCl C.KMnO4 D.Na2O2
(3)“难溶物 1”的成份是_______ 。(写化学式)
(4)写出制备金属钠的反应方程式_______ 。
(5)溶液 C 中有 Na+还有少量 Ca2+,可用试剂_______ (写化学式)除去 Ca2+。
(6)钠长石中铁元素的化合价有+2 和+3,且 Fe(II)和 Fe(III)的个数比为 3:1,则钠长石的化学式中 x=_______ 。
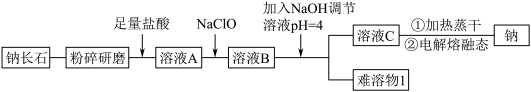
| Ca2+ | Fe2+ | Fe3+ | |
| Mn+完全沉淀时的pH | 12.0 | 5.8 | 4.0 |
(1)“粉碎研磨”的作用是
(2)写出 NaClO 与溶液 A 反应的离子方程式
A.H2O2 B.NaCl C.KMnO4 D.Na2O2
(3)“难溶物 1”的成份是
(4)写出制备金属钠的反应方程式
(5)溶液 C 中有 Na+还有少量 Ca2+,可用试剂
(6)钠长石中铁元素的化合价有+2 和+3,且 Fe(II)和 Fe(III)的个数比为 3:1,则钠长石的化学式中 x=
您最近一年使用:0次
2022-12-21更新
|
534次组卷
|
6卷引用:重庆市巴蜀中学2022-2023学年高一上学期期中考试化学试题



