1 . 现有含有 杂质的
杂质的 样品1.95g,某同学在实验室用如图装置(部分夹持仪器已省略)测定其杂质含量:
样品1.95g,某同学在实验室用如图装置(部分夹持仪器已省略)测定其杂质含量:
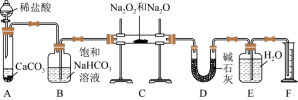
已知:碱石灰主要含有氧化钙和氢氧化钠
回答下列问题:
(1)将仪器连接好后,首先要进行的实验操作是_____ 。
(2)装置B中饱和碳酸氢钠的作用是除去 中HCl气体,该过程涉及的离子反应方程式是
中HCl气体,该过程涉及的离子反应方程式是_____ 。
(3)写出装置C中 和
和 反应的化学方程式:
反应的化学方程式:_____ 。
(4)若无装置D,测得样品中 的质量分数
的质量分数_____ (填“偏高”“偏低”或“无影响”)。
(5)1.95g样品充分反应后,待冷却后读出装置F中水的体积,将其折算成产生气体的质量为0.24g,则样品中 的质量分数为
的质量分数为_____ 。
(6)若除去 粉末中的
粉末中的 ,采用的简单方法为
,采用的简单方法为_____ 。
(7)若将 投入到含有下列离子的溶液中:
投入到含有下列离子的溶液中: 、
、 、
、 、
、 、
、 、
、 ,反应完毕后,溶液中上述离子数目几乎不变的有
,反应完毕后,溶液中上述离子数目几乎不变的有__________ (填离子符号)。
 杂质的
杂质的 样品1.95g,某同学在实验室用如图装置(部分夹持仪器已省略)测定其杂质含量:
样品1.95g,某同学在实验室用如图装置(部分夹持仪器已省略)测定其杂质含量:
已知:碱石灰主要含有氧化钙和氢氧化钠
回答下列问题:
(1)将仪器连接好后,首先要进行的实验操作是
(2)装置B中饱和碳酸氢钠的作用是除去
 中HCl气体,该过程涉及的离子反应方程式是
中HCl气体,该过程涉及的离子反应方程式是(3)写出装置C中
 和
和 反应的化学方程式:
反应的化学方程式:(4)若无装置D,测得样品中
 的质量分数
的质量分数(5)1.95g样品充分反应后,待冷却后读出装置F中水的体积,将其折算成产生气体的质量为0.24g,则样品中
 的质量分数为
的质量分数为(6)若除去
 粉末中的
粉末中的 ,采用的简单方法为
,采用的简单方法为(7)若将
 投入到含有下列离子的溶液中:
投入到含有下列离子的溶液中: 、
、 、
、 、
、 、
、 、
、 ,反应完毕后,溶液中上述离子数目几乎不变的有
,反应完毕后,溶液中上述离子数目几乎不变的有
您最近一年使用:0次
2024-04-07更新
|
79次组卷
|
2卷引用:江西省宜春市丰城市第九中学日新班2023-2024学年高二下学期开学考试化学试题
名校
2 . 某含锰废料中主要含 及少量的
及少量的 、
、 、
、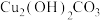 ,以此为原料制备
,以此为原料制备 的流程如下:
的流程如下:

Ⅰ.氢氧化物开始沉淀和完全沉淀的 如下表:
如下表:
Ⅱ.常温下 、
、 。
。
回答下列问题:
(1)写出一种加快酸浸速率的方法______ ,滤渣1的主要成分是______ (填化学式)。
(2)“氧化1”的目的是______ (用离子方程式表示)。
(3)“调 ”时,试剂X为
”时,试剂X为______ (任写一种), 的调节范围为
的调节范围为______ 。
(4)“除铜”时,当溶液中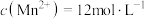 ,溶液中
,溶液中 =
=______  。
。
(5)“氧化2”制备 (恰好完全反应)时,
(恰好完全反应)时,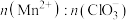 =
=______ 。
 及少量的
及少量的 、
、 、
、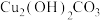 ,以此为原料制备
,以此为原料制备 的流程如下:
的流程如下:
Ⅰ.氢氧化物开始沉淀和完全沉淀的
 如下表:
如下表:氢氧化物 |
|
|
|
|
开始沉淀时 | 8.36 | 6.3 | 2.7 | 4.7 |
完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
 、
、 。
。回答下列问题:
(1)写出一种加快酸浸速率的方法
(2)“氧化1”的目的是
(3)“调
 ”时,试剂X为
”时,试剂X为 的调节范围为
的调节范围为(4)“除铜”时,当溶液中
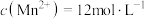 ,溶液中
,溶液中 =
= 。
。(5)“氧化2”制备
 (恰好完全反应)时,
(恰好完全反应)时,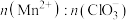 =
=
您最近一年使用:0次
名校
3 . 综合利用废弃物,对资源利用和环境保护具有现实意义。以废铁屑(含少量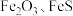 等杂质)为原料,制备硫酸亚铁晶体(
等杂质)为原料,制备硫酸亚铁晶体( ),流程示意图如下。
),流程示意图如下。
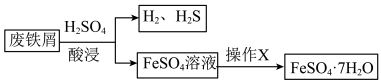
(1)酸浸过程中, 的作用是
的作用是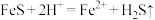 、
、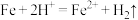 、
、___________ (用离子方程式表示)。
(2)酸浸时间对所得溶液的成分影响如下表所示。
① 时检验,溶液变红,写出离子方程式
时检验,溶液变红,写出离子方程式___________
② 时检验,用离子方程式表示溶液未变红的原因
时检验,用离子方程式表示溶液未变红的原因___________ 。
③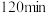 时检验,溶液复又变红,用文字说明原因
时检验,溶液复又变红,用文字说明原因___________ 。
(3)已知: 受热易失水。操作X为:
受热易失水。操作X为: ___________ 。
(4)测定所得硫酸亚铁晶体中 的含量,步骤如下:
的含量,步骤如下:
Ⅰ.称取 硫酸亚铁晶体样品,配制成
硫酸亚铁晶体样品,配制成 溶液。
溶液。
Ⅱ.取出 溶液,加入适量稀硫酸,滴入
溶液,加入适量稀硫酸,滴入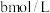 的
的 溶液,至反应完全共消耗
溶液,至反应完全共消耗 溶液
溶液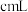 。
。
①依题意完善Ⅱ中 氧化
氧化 的离子方程式
的离子方程式________

 ___________
___________
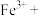 ___________
___________
②计算硫酸亚铁晶体样品中 的质量分数
的质量分数___________ 。
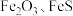 等杂质)为原料,制备硫酸亚铁晶体(
等杂质)为原料,制备硫酸亚铁晶体( ),流程示意图如下。
),流程示意图如下。
(1)酸浸过程中,
 的作用是
的作用是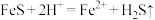 、
、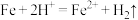 、
、(2)酸浸时间对所得溶液的成分影响如下表所示。
| 酸浸时间 | 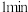 | 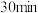 |  |
用 溶液检验 溶液检验 | 变红 | 未变红 | 变红 |
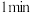 时检验,溶液变红,写出离子方程式
时检验,溶液变红,写出离子方程式②
 时检验,用离子方程式表示溶液未变红的原因
时检验,用离子方程式表示溶液未变红的原因③
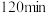 时检验,溶液复又变红,用文字说明原因
时检验,溶液复又变红,用文字说明原因(3)已知:
 受热易失水。操作X为:
受热易失水。操作X为: (4)测定所得硫酸亚铁晶体中
 的含量,步骤如下:
的含量,步骤如下:Ⅰ.称取
 硫酸亚铁晶体样品,配制成
硫酸亚铁晶体样品,配制成 溶液。
溶液。Ⅱ.取出
 溶液,加入适量稀硫酸,滴入
溶液,加入适量稀硫酸,滴入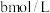 的
的 溶液,至反应完全共消耗
溶液,至反应完全共消耗 溶液
溶液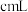 。
。①依题意完善Ⅱ中
 氧化
氧化 的离子方程式
的离子方程式
 ___________
___________
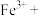 ___________
___________②计算硫酸亚铁晶体样品中
 的质量分数
的质量分数
您最近一年使用:0次
2024-03-27更新
|
221次组卷
|
4卷引用:江西省丰城中学2023-2024学年高一下学期开学化学试题
解题方法
4 . 研究发现,在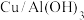 催化剂上使用等离子体催化能将
催化剂上使用等离子体催化能将 和
和 直接转化为
直接转化为 和
和 。某小组以硫酸烧渣(主要成分为
。某小组以硫酸烧渣(主要成分为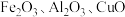 和
和 等)制备
等)制备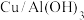 催化剂的流程如图所示:
催化剂的流程如图所示:
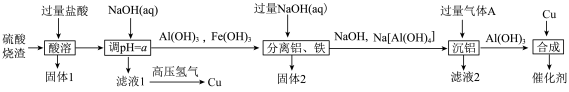
几种金属离子沉淀的pH如表所示:
回答下列问题:
(1)灼烧固体2得到的主要成分是___________ (填化学式)。气体A是_________ (填名称)。
(2)“酸溶”中,适当加热可提高反应速率,但是要控制温度,其原因是____________________ 。a的范围为____________________ 。
(3)滤液1中通入高压氢制备铜的离子方程式为_______________________ 。
(4)滤液2的pH__________________ (填“>”“<”或“=”)7。
(5)该催化剂能将 和
和 转化成
转化成 、
、 ,这四种分子中能与水分子形成氢键的有
,这四种分子中能与水分子形成氢键的有______________________ (填化学式)。
 催化剂上使用等离子体催化能将
催化剂上使用等离子体催化能将 和
和 直接转化为
直接转化为 和
和 。某小组以硫酸烧渣(主要成分为
。某小组以硫酸烧渣(主要成分为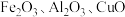 和
和 等)制备
等)制备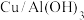 催化剂的流程如图所示:
催化剂的流程如图所示:
几种金属离子沉淀的pH如表所示:
| 金属离子 |  |  |  |
| 开始沉淀pH | 1.9 | 3.4 | 7.4 |
| 完全沉淀pH | 3.7 | 4.7 | 9.6 |
(1)灼烧固体2得到的主要成分是
(2)“酸溶”中,适当加热可提高反应速率,但是要控制温度,其原因是
(3)滤液1中通入高压氢制备铜的离子方程式为
(4)滤液2的pH
(5)该催化剂能将
 和
和 转化成
转化成 、
、 ,这四种分子中能与水分子形成氢键的有
,这四种分子中能与水分子形成氢键的有
您最近一年使用:0次
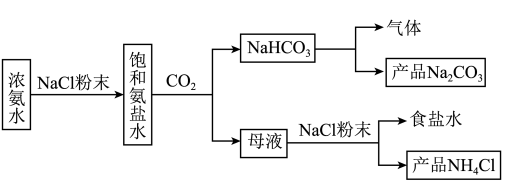
5 . 某小组在实验室模拟并改进侯氏制碱法制备 ,改进后流程如图所示:
,改进后流程如图所示:
下列说法错误的是
 ,改进后流程如图所示:
,改进后流程如图所示:
下列说法错误的是
A.可用稀硝酸、硝酸银溶液检验产品 中是否含有 中是否含有 杂质 杂质 |
B.生成 的总反应的离子方程式为 的总反应的离子方程式为 |
C.流程中可循环使用的试剂仅为 |
D.母液中含有较多 ,可能使产品 ,可能使产品 不纯 不纯 |
您最近一年使用:0次
名校
6 . 镍及其化合物在工业上有广泛用途,以某地红土镍矿(主要成分NiO、MgO、 、
、 和铁的氧化物)为原料,采用酸溶法制取
和铁的氧化物)为原料,采用酸溶法制取 和
和 ,工业流程如图所示:
,工业流程如图所示:

已知:①常温下, 易溶于水,
易溶于水, 和NiOOH不溶于水;
和NiOOH不溶于水; 。
。
②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
回答下列问题:
(1)“滤液1”中加入 的作用是
的作用是___________ (用离子反应方程式表示)。
(2)操作Ⅱ为达到实验目的,由表中的数据判断通入 调节溶液pH的范围是
调节溶液pH的范围是___________ 。
(3)“滤液1”中是否存在 ,可用
,可用___________ 检验。
(4)“沉镍”中pH调为8.5,则滤液中 的浓度为
的浓度为___________  。
。
(5)操作V是___________ 、冷却结晶、过滤、洗涤。
(6) 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为___________ 。
 、
、 和铁的氧化物)为原料,采用酸溶法制取
和铁的氧化物)为原料,采用酸溶法制取 和
和 ,工业流程如图所示:
,工业流程如图所示:
已知:①常温下,
 易溶于水,
易溶于水, 和NiOOH不溶于水;
和NiOOH不溶于水; 。
。②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
| 沉淀物 |  |  |  |  |  |
| 开始沉淀时的pH | 7.1 | 7.6 | 2.7 | 3.4 | 9.2 |
沉淀完全(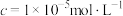 )时的pH )时的pH | 9.0 | 9.6 | 3.2 | 4.7 | 11.1 |
(1)“滤液1”中加入
 的作用是
的作用是(2)操作Ⅱ为达到实验目的,由表中的数据判断通入
 调节溶液pH的范围是
调节溶液pH的范围是(3)“滤液1”中是否存在
 ,可用
,可用(4)“沉镍”中pH调为8.5,则滤液中
 的浓度为
的浓度为 。
。(5)操作V是
(6)
 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
您最近一年使用:0次
名校
7 . 电解二氧化锰具有高能量密度、长寿命、低自放电率等优点,被广泛应用于移动电源、电动汽车、无人机等领域。工业上利用碳酸锰矿(含碳酸亚铁及其它重金属化合物)通过一系列过程制备电解二氧化锰的原理如下:
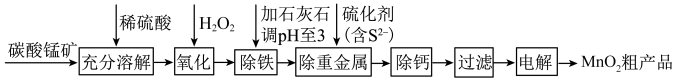
已知:在生产时对应温度下,有关物质的溶度积常数如下:
回答下列问题:
(1)为了加快碳酸锰矿的溶解,可采取的措施有___________ (答出一种即可)。
(2)氧化过程的目的是___________ 。
(3)石灰石除铁的原理是___________ (结合方程式回答)。
(4)电解是在酸性环境下进行,生成二氧化锰的电极反应式为___________ 。
(5)在电解过程中,其中一个电极生成的气体物质可以用于制成固体氧化物燃料电池,这种固体在高温下允许 通过,其负极发生的电极反应式为
通过,其负极发生的电极反应式为___________ 。
(6)电解时 的浓度和酸度会影响最后产品的质量。实验室可以用酸性高锰酸钾溶液通过滴定的方式测定过滤后溶液中
的浓度和酸度会影响最后产品的质量。实验室可以用酸性高锰酸钾溶液通过滴定的方式测定过滤后溶液中 的浓度,其原理为:
的浓度,其原理为: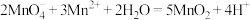 。某同学进行了如下操作:取过滤后的溶液10mL,稀释至100mL,取25mL稀释后的溶液于锥形瓶中,用浓度为
。某同学进行了如下操作:取过滤后的溶液10mL,稀释至100mL,取25mL稀释后的溶液于锥形瓶中,用浓度为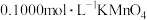 溶液进行滴定,滴定终点时,用去的
溶液进行滴定,滴定终点时,用去的 溶液体积平均值为14.50mL。
溶液体积平均值为14.50mL。
①滴定终点时的现象是___________ 。
②经计算,此次实验测得的原过滤后溶液中 的浓度为
的浓度为___________ 。
③滴定终点后读数时发现滴定管尖嘴处有一个气泡,若其它环节无误,则此次实验测得的 浓度
浓度___________ (填“偏大”“偏小”或“不受影响”)。

已知:在生产时对应温度下,有关物质的溶度积常数如下:
| 物质 |  |  |
 | 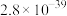 | 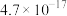 |
(1)为了加快碳酸锰矿的溶解,可采取的措施有
(2)氧化过程的目的是
(3)石灰石除铁的原理是
(4)电解是在酸性环境下进行,生成二氧化锰的电极反应式为
(5)在电解过程中,其中一个电极生成的气体物质可以用于制成固体氧化物燃料电池,这种固体在高温下允许
 通过,其负极发生的电极反应式为
通过,其负极发生的电极反应式为(6)电解时
 的浓度和酸度会影响最后产品的质量。实验室可以用酸性高锰酸钾溶液通过滴定的方式测定过滤后溶液中
的浓度和酸度会影响最后产品的质量。实验室可以用酸性高锰酸钾溶液通过滴定的方式测定过滤后溶液中 的浓度,其原理为:
的浓度,其原理为: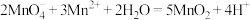 。某同学进行了如下操作:取过滤后的溶液10mL,稀释至100mL,取25mL稀释后的溶液于锥形瓶中,用浓度为
。某同学进行了如下操作:取过滤后的溶液10mL,稀释至100mL,取25mL稀释后的溶液于锥形瓶中,用浓度为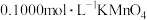 溶液进行滴定,滴定终点时,用去的
溶液进行滴定,滴定终点时,用去的 溶液体积平均值为14.50mL。
溶液体积平均值为14.50mL。①滴定终点时的现象是
②经计算,此次实验测得的原过滤后溶液中
 的浓度为
的浓度为③滴定终点后读数时发现滴定管尖嘴处有一个气泡,若其它环节无误,则此次实验测得的
 浓度
浓度
您最近一年使用:0次
名校
解题方法
8 . 草酸(HOOC-COOH)是一种常见的有机酸,利用淀粉制备草酸的实验流程如图:
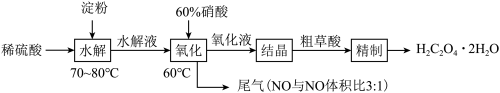
回答下列问题:
(1)“水解”时,检验淀粉是否水解完全,所用的试剂是_____ ;“水解”及“氧化”步骤中适宜的加热方式是_______ 。
(2)“氧化”时实验装置如图所示(夹持及加热装置已略):
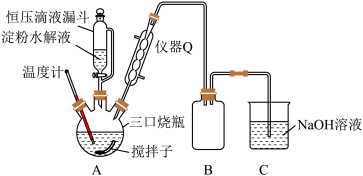
①仪器Q的名称是__________ 。
②三口(颈)烧瓶中生成H2C2O4·2H2O的化学方程式为__________ 。
③装置B的作用是________ ,装置C的作用是_________ 。
(3)已知在20℃、70℃时,草酸的溶解度依次为为9.5 g/(l00g水),84.5g/(l00g水),则粗草酸“精制”需采用的提纯方法为____ 。
(4)探究H2C2O4的性质:
①向NaHCO3溶液中加入草酸溶液,产生大量气体,可得出草酸的酸性比碳酸_____ (填“强”或“弱”)。
②向草酸中加入足量C2H5OH和适量浓硫酸加热,产生有芳香气味的油状物。该生成物为_____ (写结构简式)。

回答下列问题:
(1)“水解”时,检验淀粉是否水解完全,所用的试剂是
(2)“氧化”时实验装置如图所示(夹持及加热装置已略):

①仪器Q的名称是
②三口(颈)烧瓶中生成H2C2O4·2H2O的化学方程式为
③装置B的作用是
(3)已知在20℃、70℃时,草酸的溶解度依次为为9.5 g/(l00g水),84.5g/(l00g水),则粗草酸“精制”需采用的提纯方法为
(4)探究H2C2O4的性质:
①向NaHCO3溶液中加入草酸溶液,产生大量气体,可得出草酸的酸性比碳酸
②向草酸中加入足量C2H5OH和适量浓硫酸加热,产生有芳香气味的油状物。该生成物为
您最近一年使用:0次
2023-07-03更新
|
82次组卷
|
3卷引用:江西省宜春市丰城中学2023-2024学年高二下学期开学考试化学试题
名校
解题方法
9 . 某含锰废料中主要含MnCO3及少量的FeCO3、SiO2、Cu2(OH)2CO3,以此为原料制备MnO2的流程如下:
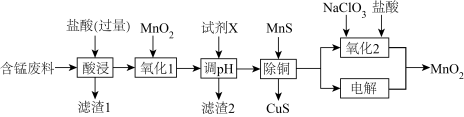
Ⅰ.氢氧化物开始沉淀和完全沉淀的pH如下表:
Ⅱ.常温下Ksp(MnS)=2.0×10-10、Ksp(CuS)=6.0×10-36。
回答下列问题:
(1)滤渣1的主要成分是_________ (填化学式)。
(2)“氧化1”的目的是_________ (用离子方程式表示)。
(3)“调pH”时,试剂X为_________ (任写一种),pH的调节范围为_________ 。
(4)“除铜”时,当溶液中c(Mn2+)=12mol·L-1,溶液中c(Cu2+)=_________  。
。
(5)“氧化2”制备MnO2 (恰好完全反应)时,n(Mn2+):n(ClO )=
)=_________ ( ClO →Cl-);“电解”制备MnO2的阳极电极反应式为
→Cl-);“电解”制备MnO2的阳极电极反应式为_________ 。

Ⅰ.氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 |
| 开始沉淀时pH | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时pH | 9.8 | 8.3 | 3.7 | 6.7 |
回答下列问题:
(1)滤渣1的主要成分是
(2)“氧化1”的目的是
(3)“调pH”时,试剂X为
(4)“除铜”时,当溶液中c(Mn2+)=12mol·L-1,溶液中c(Cu2+)=
 。
。(5)“氧化2”制备MnO2 (恰好完全反应)时,n(Mn2+):n(ClO
 )=
)= →Cl-);“电解”制备MnO2的阳极电极反应式为
→Cl-);“电解”制备MnO2的阳极电极反应式为
您最近一年使用:0次
2022-11-25更新
|
126次组卷
|
4卷引用:江西省部分学校2023-2024学年高二下学期开学考试化学试题
名校
10 . 为研究废旧电池的再利用,实验室利用旧电池的铜帽(主要成分为Zn和Cu)回收Cu并制备ZnO的部分实验过程如图所示。下列叙述错误的是
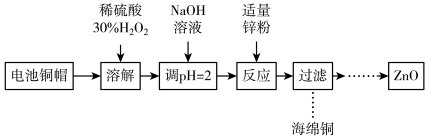

| A.“溶解” 操作中溶液温度不宜过高 |
| B.铜帽溶解后,将溶液加热至沸腾以除去溶液中过量的氧气或H2O2 |
| C.过滤后滤液中只有ZnSO4 |
| D.本流程涉及置换反应 |
您最近一年使用:0次
2022-03-03更新
|
83次组卷
|
3卷引用:江西省宜春市丰城中学2023-2024学年高二下学期开学考试化学试题







