名校
解题方法
1 . 一种利用富锂卤水(含Li+、Na+、Mg2+、Cl-、硼酸根等)中制备碳酸锂的工艺如下:

已知:室温下相关物质的Ksp如下表。
(1)i中操作的名称是_______ 、分液。
(2)ii可除去80%的Mg2+,该过程中生成Mg2(OH)2CO3反应的离子方程式为_______ 。
(3)iii中,得到的沉淀3的成分有_______ 。
(4)有人提出:可省略向溶液3中加入草酸钠这一步,该建议_______ (填“可行”或“不可行”),理由是_______ 。
(5)一种测定碳酸锂产品纯度的方法如下:
步骤I.取agLi2CO3产品,加入c1mol∙L-1V1mLH2SO4标准溶液,固体完全溶解;
步骤Ⅱ.加热溶液,缓缓煮沸一段时间后自然冷却至室温;
步骤Ⅲ.以酚酞为指示剂,用c2mol∙L-1NaOH标准溶液滴定至终点,消耗溶液体积为V2mL。
已知:杂质不与H2SO4、NaOH溶液反应。该Li2CO3产品纯度为_______ (写出计算式,用质量分数表示)。
②步骤Ⅱ的目的是_______ ;若省略步骤Ⅱ,直接进行步骤Ⅲ,将导致测得的Li2CO3,产品纯度_______ (填“偏高”“偏低”或“无影响”)。

已知:室温下相关物质的Ksp如下表。
| 化合物 | MgCO3 | Mg(OH)2 | CaC2O4 | CaCO3 | Ca(OH)2 | Li2CO3 |
| Ksp | 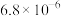 |  | 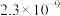 | 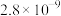 | 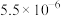 | 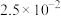 |
(1)i中操作的名称是
(2)ii可除去80%的Mg2+,该过程中生成Mg2(OH)2CO3反应的离子方程式为
(3)iii中,得到的沉淀3的成分有
(4)有人提出:可省略向溶液3中加入草酸钠这一步,该建议
(5)一种测定碳酸锂产品纯度的方法如下:
步骤I.取agLi2CO3产品,加入c1mol∙L-1V1mLH2SO4标准溶液,固体完全溶解;
步骤Ⅱ.加热溶液,缓缓煮沸一段时间后自然冷却至室温;
步骤Ⅲ.以酚酞为指示剂,用c2mol∙L-1NaOH标准溶液滴定至终点,消耗溶液体积为V2mL。
已知:杂质不与H2SO4、NaOH溶液反应。该Li2CO3产品纯度为
②步骤Ⅱ的目的是
您最近一年使用:0次
名校
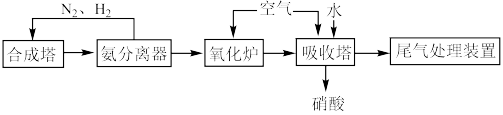
2 . 硝酸是一种重要的化工原料,某工厂利用氨催化法制备硝酸的工艺流程如下。_____________ 。
(2)原料气在氧化炉中不同温度和催化剂条件下生成不同产物(如图所示)。900℃时发生的主要反应的化学方程式为_____________ 。_____________ 。
(4)工业制硝酸的尾气中含有NO、NO2,通常用NaOH溶液吸收,发生的反应有:
反应I: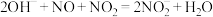
反应Ⅱ:
①反应I生成 时,转移电子的物质的量为
时,转移电子的物质的量为__________ mol。
②当尾气中NO2的含量小于50%时,向NaOH溶液中加入H2O2能提升氮氧化物的去除率,原因是_______________ 。
(5)上述工业流程中体现绿色化学理念的设计是______________ (写出1条)。
(2)原料气在氧化炉中不同温度和催化剂条件下生成不同产物(如图所示)。900℃时发生的主要反应的化学方程式为

(4)工业制硝酸的尾气中含有NO、NO2,通常用NaOH溶液吸收,发生的反应有:
反应I:
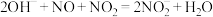
反应Ⅱ:

①反应I生成
 时,转移电子的物质的量为
时,转移电子的物质的量为②当尾气中NO2的含量小于50%时,向NaOH溶液中加入H2O2能提升氮氧化物的去除率,原因是
(5)上述工业流程中体现绿色化学理念的设计是
您最近一年使用:0次
2024-03-24更新
|
137次组卷
|
3卷引用:北京市中关村中学2023-2024学年高一下学期开学考化学试题
名校
解题方法
3 . 利用蛇纹石提镁后的中和渣(主要成分为 及:
及: 等杂质)提取高附加值的铁红
等杂质)提取高附加值的铁红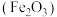 的一种工艺流程如下图所示.
的一种工艺流程如下图所示.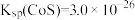 、
、
②溶液中离子浓度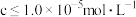 时可认为完全沉淀
时可认为完全沉淀
请回答下列问题:
(1)滤渣1的成分为______________ (填化学式),滤液2中主要的金属阳离子为______________ 。
(2)还原过程中发生反应的离子方程式为______________ ,可用试剂______________ 检验还原是否完全。
(3)欲制备高纯铁红,净化过程溶液中各离子的去除率与pH的关系如下图,则应控制pH为______________ 。 浓度均为
浓度均为 逐渐加入
逐渐加入 ,则先沉淀的离子为
,则先沉淀的离子为______________ ,结合计算说明两种离子能否彻底先后分离______________ 。
(5)煅烧过程中发生的化学方程式为______________ 。
(6)一种测定铁红产品纯度的方法如下:称取 铁红,溶于一定量的硫酸之中,配成
铁红,溶于一定量的硫酸之中,配成 溶液从其中量取
溶液从其中量取 溶液,加入过量的
溶液,加入过量的 ,充分反应后,用
,充分反应后,用 硫代硫酸钠
硫代硫酸钠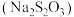 标准液滴定至终点,发生反应:
标准液滴定至终点,发生反应: .平行滴定三次,硫代硫酸钠平均消耗体积为
.平行滴定三次,硫代硫酸钠平均消耗体积为 .则铁红产品的纯度为
.则铁红产品的纯度为______________ (用c、V、m表示)。
 及:
及: 等杂质)提取高附加值的铁红
等杂质)提取高附加值的铁红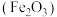 的一种工艺流程如下图所示.
的一种工艺流程如下图所示.
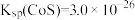 、
、
②溶液中离子浓度
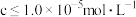 时可认为完全沉淀
时可认为完全沉淀请回答下列问题:
(1)滤渣1的成分为
(2)还原过程中发生反应的离子方程式为
(3)欲制备高纯铁红,净化过程溶液中各离子的去除率与pH的关系如下图,则应控制pH为

 浓度均为
浓度均为 逐渐加入
逐渐加入 ,则先沉淀的离子为
,则先沉淀的离子为(5)煅烧过程中发生的化学方程式为
(6)一种测定铁红产品纯度的方法如下:称取
 铁红,溶于一定量的硫酸之中,配成
铁红,溶于一定量的硫酸之中,配成 溶液从其中量取
溶液从其中量取 溶液,加入过量的
溶液,加入过量的 ,充分反应后,用
,充分反应后,用 硫代硫酸钠
硫代硫酸钠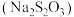 标准液滴定至终点,发生反应:
标准液滴定至终点,发生反应: .平行滴定三次,硫代硫酸钠平均消耗体积为
.平行滴定三次,硫代硫酸钠平均消耗体积为 .则铁红产品的纯度为
.则铁红产品的纯度为
您最近一年使用:0次
名校
解题方法
4 . 回收废旧锂离子电池中的金属元素,可以有效缓解原料供应紧张、环境污染等问题。
Ⅰ.碳还原焙烧-水浸法可实现三元锂离子电池正极材料中锂的优先提取:将正极材料与一定量炭粉充分混合、焙烧,得到 和
和 等;再浸于水,得到含
等;再浸于水,得到含 的浸出液。
的浸出液。
已知: 微溶于水;溶解度:
微溶于水;溶解度: 。
。
(1)焙烧过程中未得到 单质,若计算
单质,若计算 的
的 ,需要知道哪些反应的
,需要知道哪些反应的
_______ 。
(2)水浸过程中通入 可提高锂的浸出率。用化学方程式解释原因
可提高锂的浸出率。用化学方程式解释原因_______ 。
Ⅱ. 是钴酸锂电池正极材料的主要成分,某研究小组以柠檬酸(
是钴酸锂电池正极材料的主要成分,某研究小组以柠檬酸(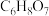 ,三元弱酸)和作为浸出剂,浸出
,三元弱酸)和作为浸出剂,浸出 ,并用电解的方法从浸出液中回收
,并用电解的方法从浸出液中回收 。
。
已知:
i.在浸出过程中,柠檬酸表现出酸性,同时电离产生的阴离子与 形成配合物,有利于钴的浸出。与
形成配合物,有利于钴的浸出。与 形成配合物的能力:
形成配合物的能力: ;
;
iⅱ.浸出液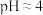 时,
时, 是
是 (Ⅱ)的主要存在形式;
(Ⅱ)的主要存在形式;
稳定性: ;
;
iii.
(3) 的作用是
的作用是_______ 。
(4)相同时间内,柠檬酸起始浓度对钴浸出率的影响如图所示。当柠檬酸浓度从 增加到
增加到 时,钴的浸出率逐渐下降,可能的原因是
时,钴的浸出率逐渐下降,可能的原因是_______ 。_______ (填“阳极”或“阴极”)。
② 在电极放电的电极反应式为
在电极放电的电极反应式为_______ 。
③电解时间相同时,电解液初始 对
对 回收率和电流效率的影响如图所示。随着
回收率和电流效率的影响如图所示。随着 的升高,
的升高, 的回收率先增加后下降的可能原因是
的回收率先增加后下降的可能原因是_______ 。
Ⅰ.碳还原焙烧-水浸法可实现三元锂离子电池正极材料中锂的优先提取:将正极材料与一定量炭粉充分混合、焙烧,得到
 和
和 等;再浸于水,得到含
等;再浸于水,得到含 的浸出液。
的浸出液。已知:
 微溶于水;溶解度:
微溶于水;溶解度: 。
。(1)焙烧过程中未得到
 单质,若计算
单质,若计算 的
的 ,需要知道哪些反应的
,需要知道哪些反应的
(2)水浸过程中通入
 可提高锂的浸出率。用化学方程式解释原因
可提高锂的浸出率。用化学方程式解释原因Ⅱ.
 是钴酸锂电池正极材料的主要成分,某研究小组以柠檬酸(
是钴酸锂电池正极材料的主要成分,某研究小组以柠檬酸(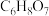 ,三元弱酸)和作为浸出剂,浸出
,三元弱酸)和作为浸出剂,浸出 ,并用电解的方法从浸出液中回收
,并用电解的方法从浸出液中回收 。
。已知:
i.在浸出过程中,柠檬酸表现出酸性,同时电离产生的阴离子与
 形成配合物,有利于钴的浸出。与
形成配合物,有利于钴的浸出。与 形成配合物的能力:
形成配合物的能力: ;
;iⅱ.浸出液
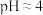 时,
时, 是
是 (Ⅱ)的主要存在形式;
(Ⅱ)的主要存在形式;稳定性:
 ;
;iii.

(3)
 的作用是
的作用是(4)相同时间内,柠檬酸起始浓度对钴浸出率的影响如图所示。当柠檬酸浓度从
 增加到
增加到 时,钴的浸出率逐渐下降,可能的原因是
时,钴的浸出率逐渐下降,可能的原因是

②
 在电极放电的电极反应式为
在电极放电的电极反应式为③电解时间相同时,电解液初始
 对
对 回收率和电流效率的影响如图所示。随着
回收率和电流效率的影响如图所示。随着 的升高,
的升高, 的回收率先增加后下降的可能原因是
的回收率先增加后下降的可能原因是
您最近一年使用:0次
2024-03-01更新
|
137次组卷
|
2卷引用:北京市第一六一中学2023-2024学年高三下学期开学考化学试题
名校
5 . 某工业废水中存在大量的H+、Na+、NO 、Cu2+、SO
、Cu2+、SO ,欲提取NaNO3,设计工艺流程如图所示。下列关于流程中实验操作的说法,不正确的是
,欲提取NaNO3,设计工艺流程如图所示。下列关于流程中实验操作的说法,不正确的是
 、Cu2+、SO
、Cu2+、SO ,欲提取NaNO3,设计工艺流程如图所示。下列关于流程中实验操作的说法,不正确的是
,欲提取NaNO3,设计工艺流程如图所示。下列关于流程中实验操作的说法,不正确的是
| A.过程i~iii所加试剂均需过量 |
| B.过程ii和iii所加试剂可互换 |
| C.操作1、2、3均为过滤 |
D.取少量滤液2,滴加Na2SO4溶液,若产生白色沉淀,则说明SO 被除尽 被除尽 |
您最近一年使用:0次
2024-03-01更新
|
198次组卷
|
3卷引用:北京九中2023-2024学年高一下学期开学测试化学试题
名校
6 . 某工业废水中存在大量的H+、Na+、NO 、Cu2+、SO
、Cu2+、SO ,欲提取NaNO3,设计工艺流程如图所示。下列关于流程中物质与反应的说法,正确的是
,欲提取NaNO3,设计工艺流程如图所示。下列关于流程中物质与反应的说法,正确的是
 、Cu2+、SO
、Cu2+、SO ,欲提取NaNO3,设计工艺流程如图所示。下列关于流程中物质与反应的说法,正确的是
,欲提取NaNO3,设计工艺流程如图所示。下列关于流程中物质与反应的说法,正确的是
| A.过程i除去的离子为:Cu2+ |
| B.试剂a为BaCl2 |
| C.沉淀3为BaCO3 |
D.过程iv所涉及的离子反应为:CO +2H+=H2O+CO2↑ +2H+=H2O+CO2↑ |
您最近一年使用:0次
2024-03-01更新
|
183次组卷
|
4卷引用:北京九中2023-2024学年高一下学期开学测试化学试题
北京九中2023-2024学年高一下学期开学测试化学试题北京市中关村中学2023-2024学年高一下学期开学考化学试题北京市第十五中学2023-2024学年高一下学期期中考试化学试题(已下线)5.1.3 硫酸根离子检验、粗盐的提纯
名校
解题方法
7 . 室温下,用含少量Mg2+的MnSO4溶液制备MnCO3的过程如图所示。
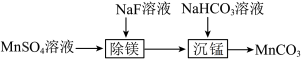
已知Ksp(MgF2)=5.2×10-11,Ka(HF)=6.3×10-4。下列说法正确的是

已知Ksp(MgF2)=5.2×10-11,Ka(HF)=6.3×10-4。下列说法正确的是
| A.0.1mol/LNaF溶液中c(F-)=c(Na+)+c(H+) |
B.“除镁”得到的上层清液中;c(Mg2+)= |
C.“沉锰”步骤中的离子方程式为2 +Mn2+=MnCO3↓+H2O+CO2↑ +Mn2+=MnCO3↓+H2O+CO2↑ |
D.“沉锰”后的滤液中:c(Na+)+c(H+)=c(OH-)+c( )+2c( )+2c( ) ) |
您最近一年使用:0次
2024-02-29更新
|
192次组卷
|
2卷引用:北京市中国人民大学附属中学2023-2024学年高三下学期开学考试化学试题
8 . 下列实验操作能够达到相应实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 鉴别溶液中的 和 和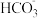 | 取样,分别加入足量澄清石灰水,观察溶液是否变浑浊 |
| B | 鉴别稀硫酸、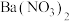 溶液、 溶液、 溶液 溶液 | 取样,分别加入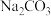 溶液,观察现象 溶液,观察现象 |
| C | 除去粗盐中的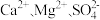 | 试剂添加顺序:先加 溶液,再加 溶液,再加 溶液, 最后加 溶液, 最后加 溶液 溶液 |
| D | 除去苯中的苯酚 | 加入足量的浓溴水,过滤 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-01-27更新
|
133次组卷
|
2卷引用:北京市第四中学顺义分校2023-2024学年高三下学期3月开学考试化学试题
名校
9 . 我国是世界产盐大国,海盐、湖盐和井盐的总产量居世界第二位。某同学进行粗盐的提纯并配制溶液、检验纯度实验。
(一)粗盐的提纯
(1)粗盐中含有泥沙、Ca2+、Mg2+、SO 杂质,请选择合适的操作补全实验流程。
杂质,请选择合适的操作补全实验流程。_______
将粗盐溶解→加入NaOH溶液→___________→___________→___________→___________→结晶得到精盐
加入稀盐酸 B.加入稀硫酸 C.过滤 D.加入BaCl2溶液 E.加入Na2CO3溶液
(2)以上流程中加酸的目的是(用离子方程式表示)___________
(二)一定浓度溶液的配制:用制得的精盐配制100 mL 1.00 mol/L NaCl溶液
(3)实验中用到的玻璃仪器,除了烧杯、量筒、胶头滴管外,还需要___________
(4)定容时的操作:当液面离容量瓶刻度线1~2cm时,___________ ,再将容量瓶塞盖好,反复上下颠倒,摇匀。
(5)下列操作会使配得的NaCl溶液浓度偏低的是___________。
(三)纯度测定
取25.00mL所配溶液于锥形瓶中,加入几滴K2CrO4溶液(指示反应终点),在不断摇动下,滴加1.00mol/L AgNO3溶液反应。平行测试3次,平均消耗AgNO3溶液23.50mL。
(6)制得的NaCl的纯度是___________ 。
(一)粗盐的提纯
(1)粗盐中含有泥沙、Ca2+、Mg2+、SO
 杂质,请选择合适的操作补全实验流程。
杂质,请选择合适的操作补全实验流程。将粗盐溶解→加入NaOH溶液→___________→___________→___________→___________→结晶得到精盐
加入稀盐酸 B.加入稀硫酸 C.过滤 D.加入BaCl2溶液 E.加入Na2CO3溶液
(2)以上流程中加酸的目的是(用离子方程式表示)
(二)一定浓度溶液的配制:用制得的精盐配制100 mL 1.00 mol/L NaCl溶液
(3)实验中用到的玻璃仪器,除了烧杯、量筒、胶头滴管外,还需要
(4)定容时的操作:当液面离容量瓶刻度线1~2cm时,
(5)下列操作会使配得的NaCl溶液浓度偏低的是___________。
| A.没有进行洗涤操作 |
| B.定容时俯视容量瓶的刻度线 |
| C.摇匀后发现液面低于容量瓶刻度线,再滴加蒸馏水至刻度线 |
| D.转移洗涤液时洒到容量瓶外,继续用该未清洗的容量瓶重新配制 |
(三)纯度测定
取25.00mL所配溶液于锥形瓶中,加入几滴K2CrO4溶液(指示反应终点),在不断摇动下,滴加1.00mol/L AgNO3溶液反应。平行测试3次,平均消耗AgNO3溶液23.50mL。
(6)制得的NaCl的纯度是
您最近一年使用:0次
2023-11-17更新
|
173次组卷
|
5卷引用:北京市首都师范大学附属中学2023-2024学年高一下学期开学化学试题
名校
解题方法
10 . 对石油开采和炼制过程中产生的含硫废水(其中硫元素的主要化合价是﹣2价)进行处理,防止污染环境。
已知:i.﹣2价硫元素易被氧化为S或
ii.在25℃时,1体积水可溶解约2.6体积的 气体
气体
iii. 、
、 、
、 在水溶液中的物质的量含物分数随pH的分布曲线如图
在水溶液中的物质的量含物分数随pH的分布曲线如图
向pH≈10的含硫废水中加入适量 溶液,产生黑色沉淀且溶液的pH降低。
溶液,产生黑色沉淀且溶液的pH降低。
①pH≈10的含硫废水中含﹣2价硫元素的主要微粒是___________ 。
②用化学平衡移动原理解释pH降低的原因:___________ 。
③初始pH=10时,除硫效果好。初始pH<4,硫的沉淀率很低,原因是___________ 。
(2)氧化法处理含硫废水
向含硫废水中加入稀 调节溶液的pH为6。
调节溶液的pH为6。
①根据电离常数计算溶液中
___________ :1。
②再加入0.15mol/L 溶液,溶液的pH变化如图。结合离子方程式解释10min后pH减小的原因:
溶液,溶液的pH变化如图。结合离子方程式解释10min后pH减小的原因:___________ 。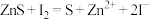 、
、
①处理后的废水中﹣2价硫元素的含量是___________ mg/L。
②加入 溶液后,需控制溶液的pH为弱酸性。当溶液呈中性时,部分﹣2价硫元素被氧化为
溶液后,需控制溶液的pH为弱酸性。当溶液呈中性时,部分﹣2价硫元素被氧化为 ,使测得的﹣2价硫元素含量
,使测得的﹣2价硫元素含量___________ (填“偏大”或“偏小”)。
已知:i.﹣2价硫元素易被氧化为S或

ii.在25℃时,1体积水可溶解约2.6体积的
 气体
气体iii.
 、
、 、
、 在水溶液中的物质的量含物分数随pH的分布曲线如图
在水溶液中的物质的量含物分数随pH的分布曲线如图
向pH≈10的含硫废水中加入适量
 溶液,产生黑色沉淀且溶液的pH降低。
溶液,产生黑色沉淀且溶液的pH降低。①pH≈10的含硫废水中含﹣2价硫元素的主要微粒是
②用化学平衡移动原理解释pH降低的原因:
③初始pH=10时,除硫效果好。初始pH<4,硫的沉淀率很低,原因是
(2)氧化法处理含硫废水
向含硫废水中加入稀
 调节溶液的pH为6。
调节溶液的pH为6。①根据电离常数计算溶液中

②再加入0.15mol/L
 溶液,溶液的pH变化如图。结合离子方程式解释10min后pH减小的原因:
溶液,溶液的pH变化如图。结合离子方程式解释10min后pH减小的原因:

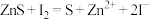 、
、
①处理后的废水中﹣2价硫元素的含量是
②加入
 溶液后,需控制溶液的pH为弱酸性。当溶液呈中性时,部分﹣2价硫元素被氧化为
溶液后,需控制溶液的pH为弱酸性。当溶液呈中性时,部分﹣2价硫元素被氧化为 ,使测得的﹣2价硫元素含量
,使测得的﹣2价硫元素含量
您最近一年使用:0次
2023-05-11更新
|
744次组卷
|
6卷引用:北京市第四中学2023-2024学年高三下学期开学摸底测验化学试题
(已下线)北京市第四中学2023-2024学年高三下学期开学摸底测验化学试题北京市西城区2023届高三二模化学试题北京市第二十中学2023-2024学年高三上学期12月月考化学试题 北京市第一○一中学2023-2024学年高三上学期12月统练六化学试题 北京师范大学附属中学2023-2024学年高三上学期12月月考化学(2)试题(已下线)FHgkyldyjhx09



