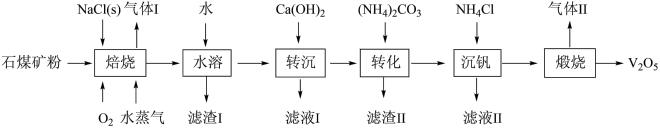
1 . 五氧化二钒(V2O5)可用于冶炼钒铁、用作合金添加剂、化工催化剂等。工业上利用石煤矿粉(主要含V2O3及少量Al2O3、SiO2)为原料生产V2O5的工艺流程如下:
①“水溶”、“转沉”、“转化”后,所得含钒物质分别为NaVO3、Ca3(VO4)2、(NH4)3VO4。
②不同pH下,正五价钒在溶液中主要存在形式见下表:
③25℃时,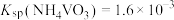 。
。
回答下列问题:
(1)“焙烧”时,V2O3发生反应的化学方程式为_____ 。
(2)“滤渣Ⅰ”的成分为_____ (填化学式,下同),“滤液Ⅰ”中溶质的成分为_____ 。
(3)先“转沉”后“转化”的目的是_____ 。
(4)“滤渣Ⅱ”经高温煅烧后水浸,所得物质可导入到_____ 操作中循环使用。
(5)“沉钒”中析出NH4VO3晶体时,需要加入过量NH4Cl,其原因是_____ (写出两条)。
(6)25℃时,测得“转化”后所得滤液中 ,为使“沉钒”时,钒元素的沉淀率达到98%,应调节溶液中
,为使“沉钒”时,钒元素的沉淀率达到98%,应调节溶液中 至少为
至少为_____  。
。
(7)“煅烧”NH4VO3,制得产品V2O5,但反应体系中,若不及时分离出气体Ⅱ,部分V2O5。会转化成V2O4。已知V2O5转化成V2O4过程中,消耗的氧化剂与还原剂的物质的量之比为3∶2,则V2O5转化成V2O4的化学方程式为_____ 。
①“水溶”、“转沉”、“转化”后,所得含钒物质分别为NaVO3、Ca3(VO4)2、(NH4)3VO4。
②不同pH下,正五价钒在溶液中主要存在形式见下表:
| pH | 4~6 | 6~8 | 8~10 | 10~12 |
| 主要离子 |  |  |  |  |
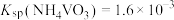 。
。回答下列问题:
(1)“焙烧”时,V2O3发生反应的化学方程式为
(2)“滤渣Ⅰ”的成分为
(3)先“转沉”后“转化”的目的是
(4)“滤渣Ⅱ”经高温煅烧后水浸,所得物质可导入到
(5)“沉钒”中析出NH4VO3晶体时,需要加入过量NH4Cl,其原因是
(6)25℃时,测得“转化”后所得滤液中
 ,为使“沉钒”时,钒元素的沉淀率达到98%,应调节溶液中
,为使“沉钒”时,钒元素的沉淀率达到98%,应调节溶液中 至少为
至少为 。
。(7)“煅烧”NH4VO3,制得产品V2O5,但反应体系中,若不及时分离出气体Ⅱ,部分V2O5。会转化成V2O4。已知V2O5转化成V2O4过程中,消耗的氧化剂与还原剂的物质的量之比为3∶2,则V2O5转化成V2O4的化学方程式为
您最近一年使用:0次
2023-08-30更新
|
203次组卷
|
2卷引用:2024届陕西省高三下学期二模理综试题-高中化学
2 . 以锌焙砂(主要成分为ZnO,含少量Cu2+、Mn2+等离子)为原料,制备2Zn(OH)2·ZnCO3的工艺流程如下:
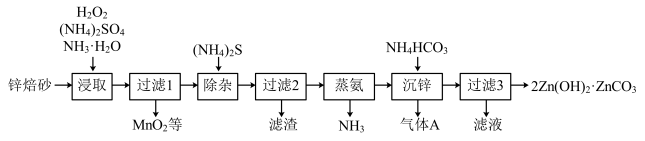
以下说法错误的是

以下说法错误的是
| A.“过滤”操作中必需使用到的玻璃仪器有烧杯、漏斗和玻璃棒 |
| B.“沉锌”过程发生反应后释放的气体A为CO2 |
| C.“浸取”过程中H2O2表现还原性 |
| D.“过滤3”所得滤液可循环使用,其主要成分的化学式是(NH4)2SO4 |
您最近一年使用:0次
名校
3 . 以含钴废渣(主要成分CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备Co2O3的一种实验流程如下:

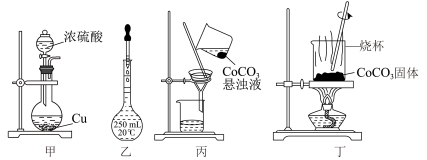
| A.用装置甲制备“酸浸”所需的SO2 |
| B.用装置乙配制“酸浸”所需的1mol·L-1H2SO4溶液 |
| C.用装置丙过滤“沉钴”所得悬浊液 |
| D.用装置丁灼烧CoCO3固体制Co2O3 |
您最近一年使用:0次
2022-08-13更新
|
2037次组卷
|
26卷引用:2024届陕西省渭南市临渭区高三下学期三模理综试题-高中化学
2024届陕西省渭南市临渭区高三下学期三模理综试题-高中化学2024届陕西省渭南市富平县高三下学期二模理综试题-高中化学江苏省宿迁市2021届高三第二次调研抽测化学卷山东省济宁市2021届高三下学期二模考试化学试题山东省青岛市2023届高三上学期模拟考试化学试题江苏省东台市安丰中学等六校2024届高三下学期4月联考模拟化学试题江苏基地学校2021届高三上学期第一次大联考试题(12月) 化学试题(已下线)押山东卷第05题 实验装置的评价-备战2021年高考化学临考题号押题(山东卷)(已下线)第27讲 化学实验基础知识和技能(精练)-2022年高考化学一轮复习讲练测山东省师范大学附属中学2022届高三上学期开学考试化学试题(已下线)专题11 化学实验基础-备战2022年高考化学真题及地市好题专项集训【山东专用】山西省太原市第五十六中学2021-2022学年高三上学期第一次月考化学试题江苏省常熟市2021-2022学年高三上学期阶段性抽测二化学试题(已下线)解密11 化学实验(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)查补易混易错点08 化学实验基础-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)查补易混易错点08 化学实验基础-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)湖北省襄阳市第五中学2022 届高三适应性考试(三)化学试题湖北省襄阳市第五中学2022届高三下学期5月适应性考试(三)化学试题四川省成都外国语学校2021-2022学年高二下学期6月月考化学试题(已下线)考点50 物质的分离、提纯和检验-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)微专题43 常见物质的分离、提纯和鉴别-备战2023年高考化学考点微专题(全国版)(已下线)第九章 化学实验基础及综合实验(测)-2023年高考化学一轮复习讲练测(全国通用)(已下线)易错点10 硫元素及其化合物-备战2023年高考化学考试易错题湖北省华中师范大学第一附属中学2023届高三第二次学业质量评价检测化学试题江苏省海安高级中学2022-2023学年高三下学期第五次阶段考试化学试题(已下线)第2讲 物质的分离与提纯
4 . 化学与生活息息相关,下列说法正确的是
| A.“美人首饰侯王印,尽是沙中浪底来”,淘金原理与化学上的萃取一致 |
| B.丝绸、宣纸及尼龙的主要成分均为合成纤维 |
| C.中国“天眼”用到的碳化硅是一种新型的无机非金属材料 |
| D.“嫦娥五号”使用的太阳能电池和锂离子电池组,均可将化学能转变成电能 |
您最近一年使用:0次
2022-06-21更新
|
414次组卷
|
2卷引用:陕西省西安工业大学附属中学2021-2022学年高三下学期第七次适应性训练理综化学试题
解题方法
5 . 对硝基苯甲酸(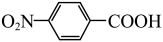 )是一种广泛用于医药、染料、感光材料等的重要精细化工中间体。工业上以对硝基甲苯(
)是一种广泛用于医药、染料、感光材料等的重要精细化工中间体。工业上以对硝基甲苯(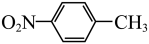 )、Cr(SO)3等物质为主要原料,通过间接电合成法制备对硝基苯甲酸,生产工艺流程如下:
)、Cr(SO)3等物质为主要原料,通过间接电合成法制备对硝基苯甲酸,生产工艺流程如下:
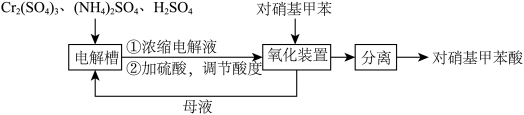
已知:①对硝基甲苯:黄色晶体,熔点为51.7℃,沸点为238.5℃,不溶于水,易溶于乙醇、乙醚、氯仿和苯。②对硝基苯甲酸:黄色晶体,熔点为242℃,沸点为359℃,微溶于水,溶于乙醇,能升华。
回答下列问题:
(1)电解制备Cr2O72-:用H型隔膜电解槽电解制备Cr2O72-,装置如下图1所示。外接电源的负极为__ (填“A”或“B”),反应II的离子方程式为_______ 。
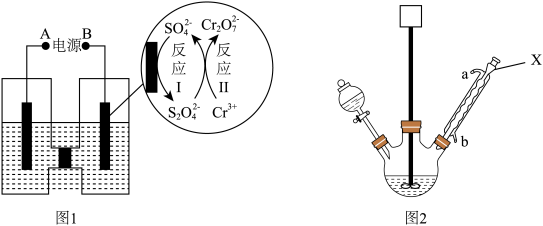
(2)氧化制备对硝基苯甲酸:用上图2所示装置制备对硝基苯甲酸,具体过程如下:
步骤1:向250 mL三颈烧瓶中依次加入一定量含Cr2O72-的电解液、对硝基甲苯,搅拌、水浴升温到设定温度,恒温下进行反应,直至反应液由棕红色变为墨绿色时为止。
步骤2:待反应混合物冷却至室温后,与适量冰水充分混合,抽滤。滤液返回电解槽中重新电解。
步骤3:把步骤2中抽滤所得固体溶于5%的热NaOH溶液中(约60℃),待温度降到50℃时,抽滤,向滤液中加入过量2 mol/L H2SO4,析出黄色沉淀,再抽滤,并用冷水洗涤,然后在低于80℃的条件下烘干,可得粗产品。
①仪器X的名称是_____ ,冷却水应从___ 口进入(填“a”或“b”)。
②步骤2中,抽滤所得固体的主要成分是_____ 。
③步骤3中,用NaOH溶液处理后,需待温度降到50℃时进行抽滤的原因是______ 。
④制得的粗产品需要进一步纯化,根据对硝基苯甲酸的有关性质可知,对其进行纯化还可以采用_____ 法完成。
⑤该合成技术的优点是实现了____ (填化学式)的循环利用,绿色环保。
(3)测定对硝基苯甲酸的纯度:称取1.670 g粗产品,配成100 mL溶液,取25.00 mL溶液,用0.1000 mol·L-1 KOH溶液滴定,重复滴定四次,每次消耗KOH溶液的体积如下表所示。已知:对硝基苯甲酸的摩尔质量为167.0 g·mol-1,则对硝基苯甲酸的纯度为_____ 。
 )是一种广泛用于医药、染料、感光材料等的重要精细化工中间体。工业上以对硝基甲苯(
)是一种广泛用于医药、染料、感光材料等的重要精细化工中间体。工业上以对硝基甲苯( )、Cr(SO)3等物质为主要原料,通过间接电合成法制备对硝基苯甲酸,生产工艺流程如下:
)、Cr(SO)3等物质为主要原料,通过间接电合成法制备对硝基苯甲酸,生产工艺流程如下:
已知:①对硝基甲苯:黄色晶体,熔点为51.7℃,沸点为238.5℃,不溶于水,易溶于乙醇、乙醚、氯仿和苯。②对硝基苯甲酸:黄色晶体,熔点为242℃,沸点为359℃,微溶于水,溶于乙醇,能升华。
回答下列问题:
(1)电解制备Cr2O72-:用H型隔膜电解槽电解制备Cr2O72-,装置如下图1所示。外接电源的负极为

(2)氧化制备对硝基苯甲酸:用上图2所示装置制备对硝基苯甲酸,具体过程如下:
步骤1:向250 mL三颈烧瓶中依次加入一定量含Cr2O72-的电解液、对硝基甲苯,搅拌、水浴升温到设定温度,恒温下进行反应,直至反应液由棕红色变为墨绿色时为止。
步骤2:待反应混合物冷却至室温后,与适量冰水充分混合,抽滤。滤液返回电解槽中重新电解。
步骤3:把步骤2中抽滤所得固体溶于5%的热NaOH溶液中(约60℃),待温度降到50℃时,抽滤,向滤液中加入过量2 mol/L H2SO4,析出黄色沉淀,再抽滤,并用冷水洗涤,然后在低于80℃的条件下烘干,可得粗产品。
①仪器X的名称是
②步骤2中,抽滤所得固体的主要成分是
③步骤3中,用NaOH溶液处理后,需待温度降到50℃时进行抽滤的原因是
④制得的粗产品需要进一步纯化,根据对硝基苯甲酸的有关性质可知,对其进行纯化还可以采用
⑤该合成技术的优点是实现了
(3)测定对硝基苯甲酸的纯度:称取1.670 g粗产品,配成100 mL溶液,取25.00 mL溶液,用0.1000 mol·L-1 KOH溶液滴定,重复滴定四次,每次消耗KOH溶液的体积如下表所示。已知:对硝基苯甲酸的摩尔质量为167.0 g·mol-1,则对硝基苯甲酸的纯度为
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积( mL) | 23.00 | 23.10 | 21.40 | 22.90 |
您最近一年使用:0次
名校
解题方法
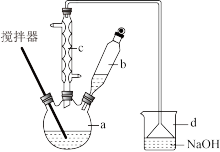
6 . 碘酸钙[Ca(IO3)2]广泛用于食品工业、口腔洗涤,防腐等领域,某化学兴趣小组在实验室利用碘在酸性条件下被氯酸钾氧化成碘酸氢钾(KIO3·HIO3),溶液经氢氧化钾中和后,与氯化钙发生复分解反应制备碘酸钙,其制备步骤及装置(水浴加热装置略去)如图:

物质的摩尔质量如下表:
请回答下列问题:
(1)加入b中盐酸后,碘在酸性条件下被氯酸钾氧化成碘酸氢钾(KIO3·HIO3),反应中有黄绿色的气体生成,该反应的化学方程式为___ 。
(2)步骤②与“直接加热”相比,“水浴加热”的优点为___ 。
(3)步骤④加入氯化钙后,得到白色悬浊液,说明KIO3的溶解度___ (填“大于”“小于”或“等于”)Ca(IO3)2。
(4)步骤⑤冰水浴冷却的目的为___ 。
(5)步骤⑥的操作名称为___ 。
(6)步骤⑦洗涤后检验沉淀是否洗涤干净的方法为___ 。
(7)最终得到2..60g碘酸钙产品,则产率为___ %(保留2小数)。


物质的摩尔质量如下表:
| 物质 | I2 | KClO3 | Ca(IO3)2 |
| 摩尔质量/g·mol-1 | 354 | 122.5 | 390 |
请回答下列问题:
(1)加入b中盐酸后,碘在酸性条件下被氯酸钾氧化成碘酸氢钾(KIO3·HIO3),反应中有黄绿色的气体生成,该反应的化学方程式为
(2)步骤②与“直接加热”相比,“水浴加热”的优点为
(3)步骤④加入氯化钙后,得到白色悬浊液,说明KIO3的溶解度
(4)步骤⑤冰水浴冷却的目的为
(5)步骤⑥的操作名称为
(6)步骤⑦洗涤后检验沉淀是否洗涤干净的方法为
(7)最终得到2..60g碘酸钙产品,则产率为
您最近一年使用:0次



