1 . 氯化亚铜(CuCl)是一种易水解的白色固体。以低品位铜矿砂(主要成分CuS)为原料制备CuCl的工艺流程如图所示。
(1)“酸溶1”时,CuS作_______ (填“氧化剂”或“还原剂”)。
(2)“除锰”时,Cu2+转化为Cu(NH3)4CO3,Mn2+转化为MnCO3沉淀。沉锰的反应化学方程式为_______ 。将生成的MnCO3分离出来的实验操作为_______ 。
(3)“酸溶2”投料后,以一定的速率搅拌反应,可提高铜浸出率的措施有_______ (只答一种方法)。
(4)合成步骤加入Na2SO3的速率不宜过快,否则会产生_______ 气体。
(5)“洗涤”应先用稀盐酸洗涤,其目的是_______ 。

(1)“酸溶1”时,CuS作
(2)“除锰”时,Cu2+转化为Cu(NH3)4CO3,Mn2+转化为MnCO3沉淀。沉锰的反应化学方程式为
(3)“酸溶2”投料后,以一定的速率搅拌反应,可提高铜浸出率的措施有
(4)合成步骤加入Na2SO3的速率不宜过快,否则会产生
(5)“洗涤”应先用稀盐酸洗涤,其目的是
您最近半年使用:0次
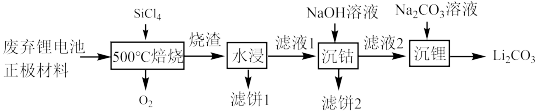
2 . 近几年新能源汽车呈现爆发式增长,对于锂电池的需求量越来越大,而碳酸锂是锂电池的重要原料之一,对废旧锂离子电池进行资源化和无害化处理具有重要的经济和环境效益,利用SiCl4对废弃的锂电池正极材料LiCoO2)进行氧化处理以回收Li等金属的工艺流程如下:
(1)Co在元素周期表的位置是___________ ,Co2+与Co3+的未成对电子数之比为___________ 。
(2)“烧渣”是LiCl、CoCl2和SiO2的混合物。“ 焙烧”反应生成的氧化产物与还原产物的物质的量之比为
焙烧”反应生成的氧化产物与还原产物的物质的量之比为___________ 。
(3)“滤饼2”的主要成分为___________ (填化学式)。利用Li2CO3与CoCO3按n(Li):n(Co)=1:1的比例配合,然后在空气中于 烧结可合成锂电池正极材料LiCoO2,反应的化学方程式为
烧结可合成锂电池正极材料LiCoO2,反应的化学方程式为___________ 。
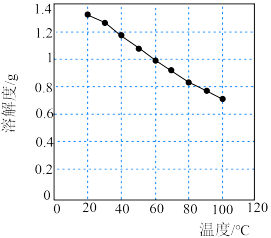
(4)碳酸锂的溶解度随温度变化如图所示。向滤液2中加入Na2CO3溶液,将温度升至90℃是为了提高沉淀反应速率和___________ 。得到碳酸锂沉淀的操作为___________ (填标号)。
(5)常温下,取 “滤液2”,其中
“滤液2”,其中 ,为使锂元素的回收率不低于
,为使锂元素的回收率不低于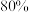 ,则至少应加入
,则至少应加入 固体的质量为
固体的质量为___________ g[已知常温下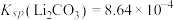 。计算结果保留3位小数。
。计算结果保留3位小数。
(6)由 进一步制得的
进一步制得的 具有反萤石结构,晶胞如图所示。
具有反萤石结构,晶胞如图所示。 在晶胞中的位置为
在晶胞中的位置为___________ 。
② 晶体的密度为
晶体的密度为 ,则晶胞参数(棱长)为
,则晶胞参数(棱长)为___________ nm(列出计算式,阿伏加德罗常数的值为 )。
)。
(1)Co在元素周期表的位置是
(2)“烧渣”是LiCl、CoCl2和SiO2的混合物。“
 焙烧”反应生成的氧化产物与还原产物的物质的量之比为
焙烧”反应生成的氧化产物与还原产物的物质的量之比为(3)“滤饼2”的主要成分为
 烧结可合成锂电池正极材料LiCoO2,反应的化学方程式为
烧结可合成锂电池正极材料LiCoO2,反应的化学方程式为(4)碳酸锂的溶解度随温度变化如图所示。向滤液2中加入Na2CO3溶液,将温度升至90℃是为了提高沉淀反应速率和
(5)常温下,取
 “滤液2”,其中
“滤液2”,其中 ,为使锂元素的回收率不低于
,为使锂元素的回收率不低于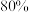 ,则至少应加入
,则至少应加入 固体的质量为
固体的质量为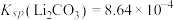 。计算结果保留3位小数。
。计算结果保留3位小数。(6)由
 进一步制得的
进一步制得的 具有反萤石结构,晶胞如图所示。
具有反萤石结构,晶胞如图所示。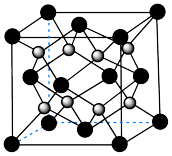
 在晶胞中的位置为
在晶胞中的位置为②
 晶体的密度为
晶体的密度为 ,则晶胞参数(棱长)为
,则晶胞参数(棱长)为 )。
)。
您最近半年使用:0次
3 . 市售食用油中常添加叔丁基对苯二酚(TBHQ)作抗氧化剂。实验室制备TBHQ的原理:
①在下图1装置的三颈烧瓶中依次加入1.1 g对苯二酚、8 mL 85%磷酸和10 mL甲苯。
②用热水浴加热使反应瓶中混合物升温至90℃,用滴管向反应瓶中分批滴加1 mL叔丁醇(密度为0.775 g·cm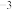 ),控制温度在90~95℃搅拌20 min,直至混合物中的固体全部溶解。
),控制温度在90~95℃搅拌20 min,直至混合物中的固体全部溶解。
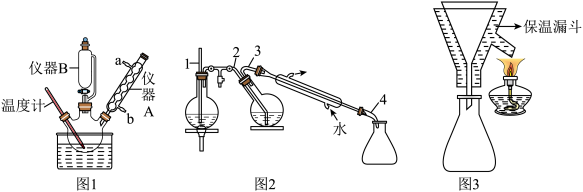
③趁热将反应物转入分液漏斗中,分出磷酸层,向有机层加入10 mL水,进行水蒸气蒸馏,如下图2。蒸馏完毕,将剩余物趁热过滤,弃去不溶物,如下图3所示。滤液转入烧杯中,若剩余液体体积不足10 mL,应补加热水,使产物被热水所提取。
④将滤液在冰浴中冷却,析出白色晶体,抽滤,并用少量冷水洗涤两次,在氮气中干燥。得到1 g产品。
回答下列问题:
(1)仪器B的名称是______ ,三颈烧瓶宜选择的规格是______ (填标号)。
A.50mL B.100mL C.200mL D.500mL
(2)本实验中甲苯的作用是______ ,步骤②中分批加入叔丁醇的目的是____________ 。
(3)步骤③中用水蒸气蒸馏的目的是____________ ,蒸馏终点的现象是____________ 。
(4)步骤③趁热过滤的目的是____________ 。
(5)如果上图3锥形瓶内壁有白色晶体析出,需采取的措施是____ 。步骤④“在氮气中干燥”的优点是____ 。
(6)TBHQ的产率为______ (保留3位有效数字)%。
 +(CH3)3COH
+(CH3)3COH
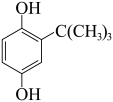 +H2O
+H2O
①在下图1装置的三颈烧瓶中依次加入1.1 g对苯二酚、8 mL 85%磷酸和10 mL甲苯。
②用热水浴加热使反应瓶中混合物升温至90℃,用滴管向反应瓶中分批滴加1 mL叔丁醇(密度为0.775 g·cm
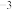 ),控制温度在90~95℃搅拌20 min,直至混合物中的固体全部溶解。
),控制温度在90~95℃搅拌20 min,直至混合物中的固体全部溶解。③趁热将反应物转入分液漏斗中,分出磷酸层,向有机层加入10 mL水,进行水蒸气蒸馏,如下图2。蒸馏完毕,将剩余物趁热过滤,弃去不溶物,如下图3所示。滤液转入烧杯中,若剩余液体体积不足10 mL,应补加热水,使产物被热水所提取。
④将滤液在冰浴中冷却,析出白色晶体,抽滤,并用少量冷水洗涤两次,在氮气中干燥。得到1 g产品。
| 物质 | 甲苯 | 对苯二酚 | 2—叔丁基对苯二酚 | 磷酸 | 甲苯—水共沸物 |
| 熔点/℃ | -94 | 175.5 | 128 | 42.35 | |
| 沸点/℃ | 110.63 | 286 | 295 | 213 | 84.1 |
(1)仪器B的名称是
A.50mL B.100mL C.200mL D.500mL
(2)本实验中甲苯的作用是
(3)步骤③中用水蒸气蒸馏的目的是
(4)步骤③趁热过滤的目的是
(5)如果上图3锥形瓶内壁有白色晶体析出,需采取的措施是
(6)TBHQ的产率为
您最近半年使用:0次
名校
4 . 高纯二氧化硅是一种纯度极高的精细化工产品。一种利用氟硅酸(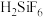 )制备高纯
)制备高纯 的工艺流程如图所示,请回答下列问题:
的工艺流程如图所示,请回答下列问题:
②“制备 ”时发生的反应为
”时发生的反应为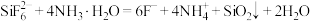 。
。
(1)氨水中含有的分子有 、
、________ (填化学式);“中和”时发生反应的化学方程式为________ ;“制备 ”时,常常加热至60℃以加快反应速率,不选择更高温度的原因可能是
”时,常常加热至60℃以加快反应速率,不选择更高温度的原因可能是________ 。
(2)“过滤分离”所得的滤液中,溶质的主要成分属于盐类的是________ (填化学式);“水洗”时,将滤饼放入烧杯中,加蒸馏水,搅拌热洗1h,减压抽滤(装置如图所示)分离,重复操作两到三次,下列说法正确的是________ (填标号)。
B.带磨口玻璃塞的试剂瓶常用于盛装强酸溶液、强碱溶液
C.“水洗”时,热水洗涤的目的是提高滤饼表面部分杂质的溶解度和溶解速率,提高洗涤效果
D.与普通过滤操作相比,“减压抽滤”可加快过滤速度,并获得较干燥的固体
E.“水洗”时,往最后一次洗涤液中滴加NaOH溶液,试管口放置的湿润的红色石蕊试纸不变蓝,说明滤饼已经洗涤干净
(3)“煅烧”时的温度控制在1000~1300℃之间,以降低产物中杂质含量。“煅烧”需要用到的仪器有________ (填标号);某工厂用2.4吨氟硅酸(其余试剂均过量)按上述方法制备高纯二氧化硅,最终获得0.95吨高纯二氧化硅(纯度视为100%),则 的产率为
的产率为________ (产率= )。
)。
 )制备高纯
)制备高纯 的工艺流程如图所示,请回答下列问题:
的工艺流程如图所示,请回答下列问题:
②“制备
 ”时发生的反应为
”时发生的反应为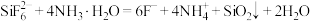 。
。(1)氨水中含有的分子有
 、
、 ”时,常常加热至60℃以加快反应速率,不选择更高温度的原因可能是
”时,常常加热至60℃以加快反应速率,不选择更高温度的原因可能是(2)“过滤分离”所得的滤液中,溶质的主要成分属于盐类的是

B.带磨口玻璃塞的试剂瓶常用于盛装强酸溶液、强碱溶液
C.“水洗”时,热水洗涤的目的是提高滤饼表面部分杂质的溶解度和溶解速率,提高洗涤效果
D.与普通过滤操作相比,“减压抽滤”可加快过滤速度,并获得较干燥的固体
E.“水洗”时,往最后一次洗涤液中滴加NaOH溶液,试管口放置的湿润的红色石蕊试纸不变蓝,说明滤饼已经洗涤干净
(3)“煅烧”时的温度控制在1000~1300℃之间,以降低产物中杂质含量。“煅烧”需要用到的仪器有
 的产率为
的产率为 )。
)。
您最近半年使用:0次
5 . 化学源于生活,她与我们生活息息相关。
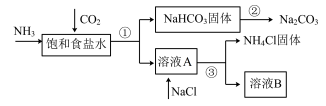
Ⅰ.我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如下图所示(部分物质已略去)。
(1)①~③所涉及的操作方法中,包含过滤的是_______ (填序号)。
(2)根据上图,将化学方程式补充完整:
_______ 
_______ 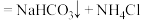
(3)煅烧 固体的化学方程式是
固体的化学方程式是_______ 。
(4)关于上述过程,下列说法中正确的是_______ (填字母)。
a. 不可循环使用
不可循环使用
b.副产物 可用作肥料
可用作肥料
c.反应过程中应先通入极易溶于水的 ,使溶液显碱性,然后再通入
,使溶液显碱性,然后再通入 气体
气体
Ⅱ.氧化还原反应是一类重要的化学反应,广泛应用于生产和生活中。
(5)氢化钠( )在野外被用作生氢剂,其原理是
)在野外被用作生氢剂,其原理是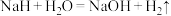 ,该反应中氧化剂是
,该反应中氧化剂是_______ ,还原剂是_______ ;被氧化与被还原元素的物质的量之比为:_______ 。
(6)某离子反应中涉及 、
、 、
、 、
、 、
、 、
、 六种微粒。其中
六种微粒。其中 、
、 的物质的量随时间变化的曲线如图所示。下列判断不正确的是
的物质的量随时间变化的曲线如图所示。下列判断不正确的是_______ 。
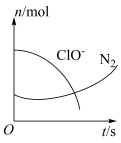
a.该反应的氧化剂是
b.消耗 还原剂,转移
还原剂,转移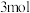 电子
电子
c.氧化剂与还原剂的物质的量之比为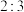
d.当生成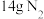 时,消耗的
时,消耗的 为
为
e.氧化性: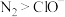
(7)高铁酸钠( ),易溶于水,是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂。工业上制备高铁酸钠有多种方法。在次氯酸钠溶液中加入氢氧化钠和硫酸铁可制备高铁酸钠,此法被称为次氯酸盐氧化法。高铁酸钠(
),易溶于水,是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂。工业上制备高铁酸钠有多种方法。在次氯酸钠溶液中加入氢氧化钠和硫酸铁可制备高铁酸钠,此法被称为次氯酸盐氧化法。高铁酸钠( )中铁元素的价态为
)中铁元素的价态为_______ ;写出制备高铁酸钠的离子方程式_______ 。
Ⅰ.我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如下图所示(部分物质已略去)。

(1)①~③所涉及的操作方法中,包含过滤的是
(2)根据上图,将化学方程式补充完整:


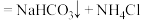
(3)煅烧
 固体的化学方程式是
固体的化学方程式是(4)关于上述过程,下列说法中正确的是
a.
 不可循环使用
不可循环使用b.副产物
 可用作肥料
可用作肥料c.反应过程中应先通入极易溶于水的
 ,使溶液显碱性,然后再通入
,使溶液显碱性,然后再通入 气体
气体Ⅱ.氧化还原反应是一类重要的化学反应,广泛应用于生产和生活中。
(5)氢化钠(
 )在野外被用作生氢剂,其原理是
)在野外被用作生氢剂,其原理是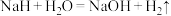 ,该反应中氧化剂是
,该反应中氧化剂是(6)某离子反应中涉及
 、
、 、
、 、
、 、
、 、
、 六种微粒。其中
六种微粒。其中 、
、 的物质的量随时间变化的曲线如图所示。下列判断不正确的是
的物质的量随时间变化的曲线如图所示。下列判断不正确的是
a.该反应的氧化剂是

b.消耗
 还原剂,转移
还原剂,转移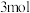 电子
电子c.氧化剂与还原剂的物质的量之比为
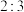
d.当生成
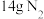 时,消耗的
时,消耗的 为
为
e.氧化性:
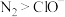
(7)高铁酸钠(
 ),易溶于水,是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂。工业上制备高铁酸钠有多种方法。在次氯酸钠溶液中加入氢氧化钠和硫酸铁可制备高铁酸钠,此法被称为次氯酸盐氧化法。高铁酸钠(
),易溶于水,是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂。工业上制备高铁酸钠有多种方法。在次氯酸钠溶液中加入氢氧化钠和硫酸铁可制备高铁酸钠,此法被称为次氯酸盐氧化法。高铁酸钠( )中铁元素的价态为
)中铁元素的价态为
您最近半年使用:0次
名校
6 . Li2CO3是制备锂离子电极材料LiFePO4的重要原料。以盐湖卤水(主要含有NaCl、MgCl2、LiCl和Na2B4O7等)为原料提取Li2CO3并制备LiFePO4的工艺流程如图所示:

已知:“日晒蒸发喷雾干燥”后固体含NaCl、LiCl、MgCl2•6H2O等。
(1)硼酸在水中的溶解度随温度的变化关系如图所示:
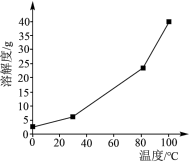
已知:H3BO3+H2O⇌[B(OH)4]-+H+。6.2gH3BO3最多与______ mL2.5mol/LNaOH溶液完全反应。“酸化脱硼”中采用______ (填“加热”或“冷却”),其目的是______ 。
(2)“水浸”后的溶液中溶质的主要成分是______ 。
(3)“蒸发分解”生成Li2CO3的化学方程式为______ 。
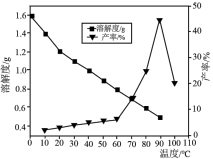
(4)已知不同温度下蒸发分解得到Li2CO3的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是______ ,制得的Li2CO3沉淀需要进行洗涤,具体操作为______ 。
(5)制备LiFePO4时同时生成CO2,其中FePO4与C6H12O6物质的量之比为24:1,该化学反应方程式为______ 。

已知:“日晒蒸发喷雾干燥”后固体含NaCl、LiCl、MgCl2•6H2O等。
(1)硼酸在水中的溶解度随温度的变化关系如图所示:

已知:H3BO3+H2O⇌[B(OH)4]-+H+。6.2gH3BO3最多与
(2)“水浸”后的溶液中溶质的主要成分是
(3)“蒸发分解”生成Li2CO3的化学方程式为
(4)已知不同温度下蒸发分解得到Li2CO3的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是

(5)制备LiFePO4时同时生成CO2,其中FePO4与C6H12O6物质的量之比为24:1,该化学反应方程式为
您最近半年使用:0次
7 . 以银锰精矿(主要含Ag2S、MnS、FeS2)和氧化锰矿(主要含MnO2)为原料联合提取精银、Mn及MnO2的一种流程示意图如下。

已知:酸性条件下,MnO2的氧化性强于Fe3+。
(1)“浸锰”是在H2SO4溶液中使矿石中的锰元素浸出的过程,能同时去除FeS2,且有利于后续银的浸出,矿石中的银以Ag2S的形式残留于浸锰渣中。
①“浸锰”过程中,MnS发生反应的离子方程式是_______ 。
②在H2SO4溶液中,银锰精矿中的FeS2和氧化锰矿中的MnO2发生反应,则浸锰液中主要的金属阳离子有_______ 。
(2)“浸银”时,使用过量FeCl3、HCl、CaCl2的混合液作为浸出剂,将Ag2S中的银以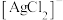 形式浸出。
形式浸出。
①将“浸银”反应的离子方程式补充完整:_______ 。
_______Fe3++Ag2S+_______⇌_______+_______[AgCl2]-+S
②浸出剂中H+的作用:_______ 。
(3)“电解精炼”时,将粗银粉进行“固态化”处理,制成“粗银电极”,下图为电解精炼银的示意图,回答下列问题:
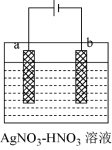
①_______ 极为“粗银电极”(填“a”或“b”)。
②若b极有少量红棕色气体产生,则生成该气体的电极反应式为_______ ;当电路中通过0.025NA电子时,b极质量增加2.16g,则b极产生的气体在标况下的体积为_______ mL(保留三位有效数字)。

已知:酸性条件下,MnO2的氧化性强于Fe3+。
(1)“浸锰”是在H2SO4溶液中使矿石中的锰元素浸出的过程,能同时去除FeS2,且有利于后续银的浸出,矿石中的银以Ag2S的形式残留于浸锰渣中。
①“浸锰”过程中,MnS发生反应的离子方程式是
②在H2SO4溶液中,银锰精矿中的FeS2和氧化锰矿中的MnO2发生反应,则浸锰液中主要的金属阳离子有
(2)“浸银”时,使用过量FeCl3、HCl、CaCl2的混合液作为浸出剂,将Ag2S中的银以
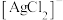 形式浸出。
形式浸出。①将“浸银”反应的离子方程式补充完整:
_______Fe3++Ag2S+_______⇌_______+_______[AgCl2]-+S
②浸出剂中H+的作用:
(3)“电解精炼”时,将粗银粉进行“固态化”处理,制成“粗银电极”,下图为电解精炼银的示意图,回答下列问题:

①
②若b极有少量红棕色气体产生,则生成该气体的电极反应式为
您最近半年使用:0次
8 . 我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如下图所示(部分物质已略去)。
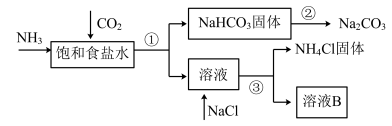
(1)根据上图,将化学方程式补充完整:________
NH3+CO2+___________+___________=NaHCO3↓+NH4Cl
(2)过程①对应的分离操作名称是___________ 。
(3)下列说法中,正确的是___________ (填字母)。
a.CO2可循环使用
b.副产物NH4Cl可用作肥料
c.溶液B中一定含有Na+、 、Cl-
、Cl-

(1)根据上图,将化学方程式补充完整:
NH3+CO2+___________+___________=NaHCO3↓+NH4Cl
(2)过程①对应的分离操作名称是
(3)下列说法中,正确的是
a.CO2可循环使用
b.副产物NH4Cl可用作肥料
c.溶液B中一定含有Na+、
 、Cl-
、Cl-
您最近半年使用:0次
9 . 我国科学家侯德榜发明了联合制碱法,对世界制碱工业做出了卓越贡献。联合制碱法以氯化钠、氨及二氧化碳为原料,同时生产纯碱和氯化铵两种产品
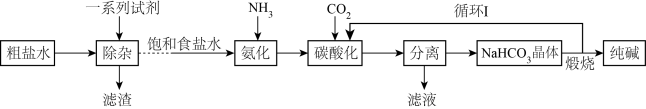
(1)粗盐水中含有Ca2+、 、Mg2+,“除杂”时依次加入过量的NaOH、BaCl2、Na2CO3。加入Na2CO3的目的
、Mg2+,“除杂”时依次加入过量的NaOH、BaCl2、Na2CO3。加入Na2CO3的目的_______ 。在实验室分离出“滤渣”所需的玻璃仪器有玻璃棒、烧杯、_______ 。
(2)“氨化”和“碳酸化”的顺序不能对调,理由是_______ 。在循环1中,参与循环的物质是_______ 。
(3)上述流程中,NaCl转化为NaHCO3的化学方程式_______ 。
(4)根据NaCl和NH4Cl的溶解度曲线(见图),从“滤液”中制得NH4Cl晶体的操作包括_______ 、过滤、洗涤、干燥。

(5)纯碱样品中常含有少量NaHCO3杂质。为测定样品中Na2CO3的质量分数,设计下列三种实验方案。不能达到实验目的的是_______ 。
A.称取a克样品,充分加热后,固体质量减少b克
B.称取a克样品,加入足量稀盐酸。将所得气体通入过量的碱石灰,充分吸收后
C.称取a克样品,加入足量稀盐酸。充分反应后,将所得溶液蒸发结晶

(1)粗盐水中含有Ca2+、
 、Mg2+,“除杂”时依次加入过量的NaOH、BaCl2、Na2CO3。加入Na2CO3的目的
、Mg2+,“除杂”时依次加入过量的NaOH、BaCl2、Na2CO3。加入Na2CO3的目的(2)“氨化”和“碳酸化”的顺序不能对调,理由是
(3)上述流程中,NaCl转化为NaHCO3的化学方程式
(4)根据NaCl和NH4Cl的溶解度曲线(见图),从“滤液”中制得NH4Cl晶体的操作包括

(5)纯碱样品中常含有少量NaHCO3杂质。为测定样品中Na2CO3的质量分数,设计下列三种实验方案。不能达到实验目的的是
A.称取a克样品,充分加热后,固体质量减少b克
B.称取a克样品,加入足量稀盐酸。将所得气体通入过量的碱石灰,充分吸收后
C.称取a克样品,加入足量稀盐酸。充分反应后,将所得溶液蒸发结晶
您最近半年使用:0次
10 . 为了实现中国人自己研制 的梦想,揭开索尔维法生产的秘密,打破洋人的封锁,侯德榜把全部身心都投入到研究和改进
的梦想,揭开索尔维法生产的秘密,打破洋人的封锁,侯德榜把全部身心都投入到研究和改进 生产工艺上,经过5年艰苦的摸索,终于在1926年生产出合格的
生产工艺上,经过5年艰苦的摸索,终于在1926年生产出合格的 产品。其生产工艺流程如图所示:
产品。其生产工艺流程如图所示:

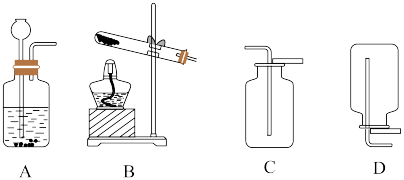
已知制备中涉及化学方程式如下:
I.
II.
III.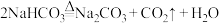
回答下列问题:
(1) 俗称
俗称___________ ,其水溶液的
___________ (填“ ”“
”“ ”或“
”或“ ”)7。
”)7。
(2)反应I需要通入 ,下列可用于实验室制备
,下列可用于实验室制备 的装置是
的装置是___________ (填字母,下同),收集 的装置是
的装置是___________ 。
(3)反应III表现出 的化学性质是
的化学性质是___________ 。
(4)“操作”的名称是___________ ,该操作在实验室中必须用到的玻璃仪器有玻璃棒、___________ 。
(5)写出滤液中溶质的一种用途:___________ 。
(6)为了检验某含有 杂质的
杂质的 样品的纯度,现将
样品的纯度,现将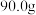 样品充分加热,固体质量变为
样品充分加热,固体质量变为 ,则该样品的纯度(质量分数)约为
,则该样品的纯度(质量分数)约为___________ (保留一位小数)。
 的梦想,揭开索尔维法生产的秘密,打破洋人的封锁,侯德榜把全部身心都投入到研究和改进
的梦想,揭开索尔维法生产的秘密,打破洋人的封锁,侯德榜把全部身心都投入到研究和改进 生产工艺上,经过5年艰苦的摸索,终于在1926年生产出合格的
生产工艺上,经过5年艰苦的摸索,终于在1926年生产出合格的 产品。其生产工艺流程如图所示:
产品。其生产工艺流程如图所示:
已知制备中涉及化学方程式如下:
I.

II.

III.
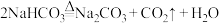
回答下列问题:
(1)
 俗称
俗称
 ”“
”“ ”或“
”或“ ”)7。
”)7。(2)反应I需要通入
 ,下列可用于实验室制备
,下列可用于实验室制备 的装置是
的装置是 的装置是
的装置是
(3)反应III表现出
 的化学性质是
的化学性质是(4)“操作”的名称是
(5)写出滤液中溶质的一种用途:
(6)为了检验某含有
 杂质的
杂质的 样品的纯度,现将
样品的纯度,现将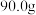 样品充分加热,固体质量变为
样品充分加热,固体质量变为 ,则该样品的纯度(质量分数)约为
,则该样品的纯度(质量分数)约为
您最近半年使用:0次



