1 . 锌电解阳极泥(主要成分为MnO2、PbSO4和ZnO,还有少量锰铅氧化物Pb2Mn8O16和Ag)是冶锌过程中产生的废渣,一种回收锌电解阳极泥中金属元素锌、锰、铅和银的工艺如图。回答下列问题:

已知:①MnSO4∙H2O易溶于水,不溶于乙醇。
②在较高温度及酸性催化条件下,葡萄糖能发生如下反应:

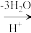
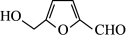

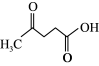 +HCOOH
+HCOOH
(1)已知Pb2Mn8O16中Pb为+2价,Mn为+2价和+4价,则氧化物中+2价和+4价Mn的个数比为____ 。
(2)“还原酸浸”过程中主要反应的离子方程式为____ 。
(3)实际锰浸出最适宜的葡萄糖加入量远大于理论加入量,其原因是____ ,为提高葡萄糖的有效利用率,除充分搅拌外还可采取的措施为____ 。
(4)整个流程中可循环利用的物质是____ 。获得MnSO4∙H2O晶体的一系列操作是指蒸发结晶、趁热过滤、洗涤、干燥,其中洗涤的具体操作是____ 。
(5)加入Na2CO3溶液的目的是将PbSO4转化为PbCO3,Na2CO3溶液的最小浓度为____ mol·L–1(保留两位小数)。判断沉淀转化能否彻底进行并说明理由____ 。[已知:20℃时Ksp(PbSO4)=1.6×10-8mol2·L-2,Ksp(PbCO3)=7.4×10-14mol2·L-2,1.262≈1.6]

已知:①MnSO4∙H2O易溶于水,不溶于乙醇。
②在较高温度及酸性催化条件下,葡萄糖能发生如下反应:

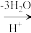


 +HCOOH
+HCOOH(1)已知Pb2Mn8O16中Pb为+2价,Mn为+2价和+4价,则氧化物中+2价和+4价Mn的个数比为
(2)“还原酸浸”过程中主要反应的离子方程式为
(3)实际锰浸出最适宜的葡萄糖加入量远大于理论加入量,其原因是
(4)整个流程中可循环利用的物质是
(5)加入Na2CO3溶液的目的是将PbSO4转化为PbCO3,Na2CO3溶液的最小浓度为
您最近一年使用:0次
2022-03-12更新
|
1160次组卷
|
5卷引用:山东省烟台市、德州市2021-2022学年下学期高三一模化学试题
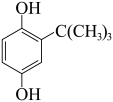
2 . 市售食用油中常添加叔丁基对苯二酚(TBHQ)作抗氧化剂。实验室制备TBHQ的原理:
①在下图1装置的三颈烧瓶中依次加入1.1 g对苯二酚、8 mL 85%磷酸和10 mL甲苯。
②用热水浴加热使反应瓶中混合物升温至90℃,用滴管向反应瓶中分批滴加1 mL叔丁醇(密度为0.775 g·cm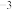 ),控制温度在90~95℃搅拌20 min,直至混合物中的固体全部溶解。
),控制温度在90~95℃搅拌20 min,直至混合物中的固体全部溶解。
③趁热将反应物转入分液漏斗中,分出磷酸层,向有机层加入10 mL水,进行水蒸气蒸馏,如下图2。蒸馏完毕,将剩余物趁热过滤,弃去不溶物,如下图3所示。滤液转入烧杯中,若剩余液体体积不足10 mL,应补加热水,使产物被热水所提取。
④将滤液在冰浴中冷却,析出白色晶体,抽滤,并用少量冷水洗涤两次,在氮气中干燥。得到1 g产品。
回答下列问题:
(1)仪器B的名称是______ ,三颈烧瓶宜选择的规格是______ (填标号)。
A.50mL B.100mL C.200mL D.500mL
(2)本实验中甲苯的作用是______ ,步骤②中分批加入叔丁醇的目的是____________ 。
(3)步骤③中用水蒸气蒸馏的目的是____________ ,蒸馏终点的现象是____________ 。
(4)步骤③趁热过滤的目的是____________ 。
(5)如果上图3锥形瓶内壁有白色晶体析出,需采取的措施是____ 。步骤④“在氮气中干燥”的优点是____ 。
(6)TBHQ的产率为______ (保留3位有效数字)%。
 +(CH3)3COH
+(CH3)3COH
 +H2O
+H2O
①在下图1装置的三颈烧瓶中依次加入1.1 g对苯二酚、8 mL 85%磷酸和10 mL甲苯。
②用热水浴加热使反应瓶中混合物升温至90℃,用滴管向反应瓶中分批滴加1 mL叔丁醇(密度为0.775 g·cm
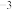 ),控制温度在90~95℃搅拌20 min,直至混合物中的固体全部溶解。
),控制温度在90~95℃搅拌20 min,直至混合物中的固体全部溶解。③趁热将反应物转入分液漏斗中,分出磷酸层,向有机层加入10 mL水,进行水蒸气蒸馏,如下图2。蒸馏完毕,将剩余物趁热过滤,弃去不溶物,如下图3所示。滤液转入烧杯中,若剩余液体体积不足10 mL,应补加热水,使产物被热水所提取。
④将滤液在冰浴中冷却,析出白色晶体,抽滤,并用少量冷水洗涤两次,在氮气中干燥。得到1 g产品。
| 物质 | 甲苯 | 对苯二酚 | 2—叔丁基对苯二酚 | 磷酸 | 甲苯—水共沸物 |
| 熔点/℃ | -94 | 175.5 | 128 | 42.35 | |
| 沸点/℃ | 110.63 | 286 | 295 | 213 | 84.1 |
(1)仪器B的名称是
A.50mL B.100mL C.200mL D.500mL
(2)本实验中甲苯的作用是
(3)步骤③中用水蒸气蒸馏的目的是
(4)步骤③趁热过滤的目的是
(5)如果上图3锥形瓶内壁有白色晶体析出,需采取的措施是
(6)TBHQ的产率为
您最近一年使用:0次
2024-04-10更新
|
816次组卷
|
3卷引用:2024届辽宁省抚顺市六校协作体高三下学期第三次模拟化学试卷
解题方法
3 . 某种常见补铁药物的主要成分为琥珀酸亚铁。该药品不溶于水但能溶于常见稀酸。某学习小组同学分别设计实验检验药片中Fe2+的存在并测定Fe2+的含量(假设杂质不参与反应)。回答下列问题:
(1)甲同学为了检验药品中的Fe2+ ,将药物碾碎、水溶后过滤。取少量所得滤液于两支试管中,分别加入K3[Fe(CN)6]溶液和KSCN溶液,观察并记录实验现象。
①甲同学过滤时的下列操作规范的是_______ (填编号)。
a.用玻璃棒引流
b.漏斗口未紧靠烧杯内壁
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高于漏斗边缘
e.用玻璃棒在漏斗中搅动以加快过滤速度
②滤液加入K3[Fe(CN)6]溶液或KSCN溶液均未出现明显现象,其主要原因为_______ 。
(2)乙同学设计如下实验测定药片中Fe2+的含量。
步骤一:取本品10片,碾碎后加入一定浓度试剂a,在适当的条件下配成100mL溶液。
步骤二:准确量取20.00mL步骤一所得溶液放入烧杯中。
步骤三:向烧杯中加入过量H2O2溶液,后加入过量NaOH溶液生成沉淀,将沉淀过滤、洗涤、干燥后灼烧至固体质量恒定,得0. 64g固体。
①步骤一中加入的试剂a为_______ 。
②步骤三中,加入H2O2溶液发生反应的离子方程式为_______ ,灼烧后 所得固体的颜色为 _______ ,灼烧时需要使用下列仪器中的 _______ (填编号)。
a.酒精灯 b.坩埚 c.蒸发皿 d.铁架台(带铁圈) e.三脚架
③若将步骤三中的H2O2 溶液换为Cl2也能达到目的,但使用H2O2溶液的好处是_______ 。
④由实验数据计算,每片药片中约含Fe2+_______ mg。
(3)医生建议该药品与维生素C同时服用以增强补铁效果,原因是利用了维生素C的_______ (选填“氧化性”、“ 还原性”或“碱性”。)
(1)甲同学为了检验药品中的Fe2+ ,将药物碾碎、水溶后过滤。取少量所得滤液于两支试管中,分别加入K3[Fe(CN)6]溶液和KSCN溶液,观察并记录实验现象。
①甲同学过滤时的下列操作规范的是
a.用玻璃棒引流
b.漏斗口未紧靠烧杯内壁
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高于漏斗边缘
e.用玻璃棒在漏斗中搅动以加快过滤速度
②滤液加入K3[Fe(CN)6]溶液或KSCN溶液均未出现明显现象,其主要原因为
(2)乙同学设计如下实验测定药片中Fe2+的含量。
步骤一:取本品10片,碾碎后加入一定浓度试剂a,在适当的条件下配成100mL溶液。
步骤二:准确量取20.00mL步骤一所得溶液放入烧杯中。
步骤三:向烧杯中加入过量H2O2溶液,后加入过量NaOH溶液生成沉淀,将沉淀过滤、洗涤、干燥后灼烧至固体质量恒定,得0. 64g固体。
①步骤一中加入的试剂a为
②步骤三中,加入H2O2溶液发生反应的离子方程式为
a.酒精灯 b.坩埚 c.蒸发皿 d.铁架台(带铁圈) e.三脚架
③若将步骤三中的H2O2 溶液换为Cl2也能达到目的,但使用H2O2溶液的好处是
④由实验数据计算,每片药片中约含Fe2+
(3)医生建议该药品与维生素C同时服用以增强补铁效果,原因是利用了维生素C的
您最近一年使用:0次
解题方法
4 . 过氧化钙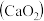 是一种用途广泛的优良供氧剂,常温下为白色固体,能溶于酸,难溶于水、乙醇,且本身无毒,不污染环境,某实验小组制备
是一种用途广泛的优良供氧剂,常温下为白色固体,能溶于酸,难溶于水、乙醇,且本身无毒,不污染环境,某实验小组制备 过程如下。
过程如下。
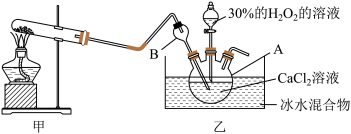
Ⅰ.制备
利用反应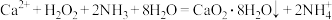 ,在碱性环境下制取
,在碱性环境下制取 的装置如图:
的装置如图:
(1) 的电子式为
的电子式为_______ 。
(2)写出甲装置中反应的化学方程式_______ 。
(3)仪器A的名称为_______ ;仪器B的作用是_______ 。
(4)乙中反应温度需控制在0℃左右的原因是该反应是放热反应,温度低有利于提高 的产率和
的产率和_______ 。
(5)反应结束后,分离提纯 的过程中,洗涤的操作为
的过程中,洗涤的操作为_______ 。
Ⅱ.制得产品并定量检测
(6) 脱水干燥即得
脱水干燥即得 产品。经检测知某
产品。经检测知某 产品中含有
产品中含有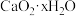 和
和 ,已知
,已知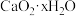 受热分解有
受热分解有 、
、 和
和 生成。①称取
生成。①称取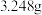 产品,加热,在标准状况下生成
产品,加热,在标准状况下生成 气体。②另取等量产品,溶于适量的稀盐酸后,加入足量的
气体。②另取等量产品,溶于适量的稀盐酸后,加入足量的 溶液得到沉淀
溶液得到沉淀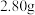 ,则该产品中
,则该产品中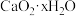 的x值为
的x值为_______ 。
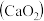 是一种用途广泛的优良供氧剂,常温下为白色固体,能溶于酸,难溶于水、乙醇,且本身无毒,不污染环境,某实验小组制备
是一种用途广泛的优良供氧剂,常温下为白色固体,能溶于酸,难溶于水、乙醇,且本身无毒,不污染环境,某实验小组制备 过程如下。
过程如下。Ⅰ.制备

利用反应
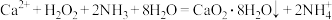 ,在碱性环境下制取
,在碱性环境下制取 的装置如图:
的装置如图:
(1)
 的电子式为
的电子式为(2)写出甲装置中反应的化学方程式
(3)仪器A的名称为
(4)乙中反应温度需控制在0℃左右的原因是该反应是放热反应,温度低有利于提高
 的产率和
的产率和(5)反应结束后,分离提纯
 的过程中,洗涤的操作为
的过程中,洗涤的操作为Ⅱ.制得产品并定量检测
(6)
 脱水干燥即得
脱水干燥即得 产品。经检测知某
产品。经检测知某 产品中含有
产品中含有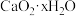 和
和 ,已知
,已知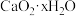 受热分解有
受热分解有 、
、 和
和 生成。①称取
生成。①称取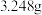 产品,加热,在标准状况下生成
产品,加热,在标准状况下生成 气体。②另取等量产品,溶于适量的稀盐酸后,加入足量的
气体。②另取等量产品,溶于适量的稀盐酸后,加入足量的 溶液得到沉淀
溶液得到沉淀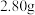 ,则该产品中
,则该产品中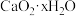 的x值为
的x值为
您最近一年使用:0次
解题方法
5 . 天然气是绿色、优质的能源。开采的天然气中通常会含有杂质H2S和CO2。实验室利用如下装置除去杂质并测定H2S的含量。

已知: FeS 难溶于水可溶于稀硫酸,CuS 既不溶于水又不溶于稀硫酸。
可供选择的试剂有: FeSO4溶液、CuSO4溶液、NaOH溶液、NaCl溶液。
回答下列问题:
(1)A中的试剂是___________ 。
(2)为测量H2S的含量,停止通气后,对洗气瓶中混合物应进行的操作是___________ 、______ 、干燥、称量。其中第一步操作用到的玻璃仪器有玻璃棒、烧杯、___________ 。
(3)若通入22.4L标准状况下的气体,测得生成3.84g沉淀, 则此天然气中H2S的体积分数为___________ %。
(4)室温下,氢硫酸(H2S)和碳酸的电离平衡常数如下表所示:
H2S与碳酸钠溶液反应的化学方程式是________ ,是否能用碳酸钠溶液替代A中的试剂?___________ (填“是”或“否”)。原因是________ 。
(5)工业上也可使用醇胺吸收H2S, 反应原理为(HOCH2CH2)2NH+H2S=(HOCH2CH2)2NH2HS,上述反应说明(HOCH2CH2)2NH中,___________ (填基团结构简式)具有碱性。

已知: FeS 难溶于水可溶于稀硫酸,CuS 既不溶于水又不溶于稀硫酸。
可供选择的试剂有: FeSO4溶液、CuSO4溶液、NaOH溶液、NaCl溶液。
回答下列问题:
(1)A中的试剂是
(2)为测量H2S的含量,停止通气后,对洗气瓶中混合物应进行的操作是
(3)若通入22.4L标准状况下的气体,测得生成3.84g沉淀, 则此天然气中H2S的体积分数为
(4)室温下,氢硫酸(H2S)和碳酸的电离平衡常数如下表所示:
| Kal | Ka2 | |
| H2S | 1.1×10-7 | 1.3×10-13 |
| H2CO3 | 4.5×107 | 4.7×10-11 |
(5)工业上也可使用醇胺吸收H2S, 反应原理为(HOCH2CH2)2NH+H2S=(HOCH2CH2)2NH2HS,上述反应说明(HOCH2CH2)2NH中,
您最近一年使用:0次
6 . “以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为Na2CO3)吸收烟气中的SO2,得到亚硫酸钠(Na2SO3)粗品。其流程如下:
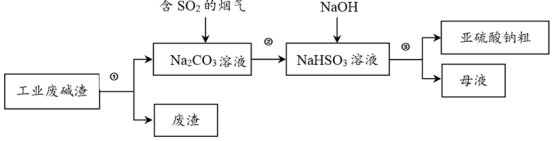
(1)为加快工业废碱渣中Na2CO3的溶解,可采取的措施是_______ (写出一种即可)。
(2)过程①进行的操作是_______ 。
(3)上述流程中,加入NaOH后,发生反应的化学方程式为_______ 。
(4)亚硫酸钠粗品中含有少量Na2SO4,原因是_______ 。
(5)设计实验证明亚硫酸钠粗品含有少量Na2SO4的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解,_______ ,出现白色沉淀,则证明含有Na2SO4。

(1)为加快工业废碱渣中Na2CO3的溶解,可采取的措施是
(2)过程①进行的操作是
(3)上述流程中,加入NaOH后,发生反应的化学方程式为
(4)亚硫酸钠粗品中含有少量Na2SO4,原因是
(5)设计实验证明亚硫酸钠粗品含有少量Na2SO4的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解,
您最近一年使用:0次
2021-05-20更新
|
795次组卷
|
3卷引用:2022年新高考化学时事热点情境化考题---钠及其化合物
解题方法
7 . 次磷酸钠(NaH2PO2)在食品工业中用作防腐剂、抗氧化剂,也是一种很好的化学镀剂。
(1)NaH2PO2中P的化合价为_____ 。
(2)将待镀零件浸泡在NiSO4和NaH2PO2的混合溶液中,可达到化学镀镍的目的,该过程中H2PO 被氧化为二元弱酸H3PO3,写出该反应的离子方程式
被氧化为二元弱酸H3PO3,写出该反应的离子方程式_____ 。
(3)次磷酸钠的制备将黄磷(P4)和过量烧碱溶液混合加热,生成NaH2PO2和PH3(气体),PH3与NaClO溶液反应可生成次磷酸(H3PO2),实验装置如图:
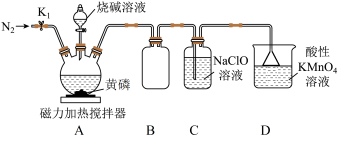
①装置A中盛放烧碱溶液的仪器名称为_____ 。
②装置B的作用为_____ 。
③装置C中发生反应的化学方程式为_____ 。
④已知相关物质的溶解度如表:
充分反应后,将A、C中溶液混合,再将混合液(含极少量NaOH)加热浓缩,有大量杂质晶体析出,然后_____ (填操作名称),得到含NaH2PO2的溶液,进一步处理得到粗产品。
(4)产品纯度的计算
取1.00g粗产品配成100mL溶液,取25.00mL于锥形瓶中,酸化后加入30.00mL0.100mol•L-1碘水,充分反应。然后以淀粉溶液作指示剂,用0.100mol•L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液24.00mL,有关反应的方程式为:H2PO +H2O+I2=H2PO
+H2O+I2=H2PO +2H++2I—,2S2O
+2H++2I—,2S2O +I2=S4O
+I2=S4O +2I-,则产品纯度为
+2I-,则产品纯度为_____ (NaH2PO2式量88)。
(1)NaH2PO2中P的化合价为
(2)将待镀零件浸泡在NiSO4和NaH2PO2的混合溶液中,可达到化学镀镍的目的,该过程中H2PO
 被氧化为二元弱酸H3PO3,写出该反应的离子方程式
被氧化为二元弱酸H3PO3,写出该反应的离子方程式(3)次磷酸钠的制备将黄磷(P4)和过量烧碱溶液混合加热,生成NaH2PO2和PH3(气体),PH3与NaClO溶液反应可生成次磷酸(H3PO2),实验装置如图:

①装置A中盛放烧碱溶液的仪器名称为
②装置B的作用为
③装置C中发生反应的化学方程式为
④已知相关物质的溶解度如表:
| 溶解度/g 物质 | 25℃ | 100℃ |
| NaCl | 37 | 39 |
| NaH2PO2 | 100 | 667 |
(4)产品纯度的计算
取1.00g粗产品配成100mL溶液,取25.00mL于锥形瓶中,酸化后加入30.00mL0.100mol•L-1碘水,充分反应。然后以淀粉溶液作指示剂,用0.100mol•L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液24.00mL,有关反应的方程式为:H2PO
 +H2O+I2=H2PO
+H2O+I2=H2PO +2H++2I—,2S2O
+2H++2I—,2S2O +I2=S4O
+I2=S4O +2I-,则产品纯度为
+2I-,则产品纯度为
您最近一年使用:0次
名校
解题方法
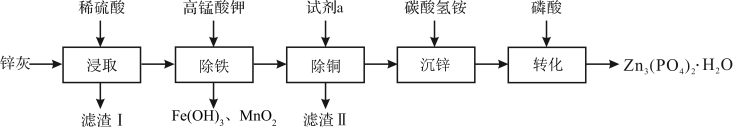
8 . 四水合磷酸锌 [Zn3(PO4)2·4H2O,摩尔质量为457 g·mol-1,难溶于水] 是一种性能优良的绿色环保防锈颜料。实验室以锌灰(含ZnO、PbO、CuO、FeO、Fe2O3、SiO2等)为原料制备Zn3(PO4)2·4H2O的流程如图,回答下列问题:
已知:①6NH4HCO3 + 3ZnSO4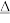 ZnCO3·2Zn(OH)2·H2O↓ + 3(NH4)2SO4 + 5CO2↑
ZnCO3·2Zn(OH)2·H2O↓ + 3(NH4)2SO4 + 5CO2↑
②ZnCO3·2Zn(OH)2·H2O + 2H3PO4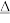 Zn3(PO4)2·4H2O + 2H2O + CO2↑
Zn3(PO4)2·4H2O + 2H2O + CO2↑
③常温下,Fe3+、Fe2+、Cu2+、Zn2+生成氢氧化物沉淀时的pH:
(1)滤渣Ⅰ的主要成分为_______ ;试剂a为_______ ;
(2)“除铁”操作时,需先将溶液调至接近中性,然后再滴加KMnO4溶液,使溶液中的铁元素转化为Fe(OH)3,该反应的离子方程式为_______ ;
(3)“转化”结束后,从混合液中分离得到Zn3(PO4)2·4H2O的操作包括_______ 和干燥。
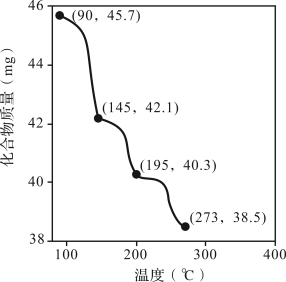
(4)称取45.7 mg Zn3(PO4)2·4H2O进行热重分析,化合物质量随温度的变化关系如图所示,为获得Zn3(PO4)2·2H2O和Zn3(PO4)2·H2O的混合产品,烘干时的温度范围为_______。
(5)为测定产品中Zn3(PO4)2·4H2O的含量,进行如下实验:(已知:Zn2+与H2Y2−按1:1反应;杂质不反应。)
步骤Ⅰ:准确称取0.4570g产品于烧杯中,加入适量盐酸使其溶解,将溶液转移至100 mL容量瓶,定容。
步骤Ⅱ:移取20.00 mL上述溶液于锥形瓶中,加入指示剂,在pH = 5~6的缓冲溶液中用0.02000mol·L-1 Na2H2Y标准溶液滴定至终点,测得Na2H2Y标准溶液的用量为27.60 mL。
步骤Ⅱ中移取溶液时所使用的玻璃仪器为_______ ;产品中Zn3(PO4)2·4H2O的质量分数为_______ 。下列操作中,导致产品中Zn3(PO4)2·4H2O含量测定值偏低的是_______ 。
a.步骤I中定容时俯视刻度线
b.步骤I中转移溶液时未洗涤烧杯
c.步骤II中滴定管未用Na2H2Y标准溶液润洗
d.步骤II中滴定前滴定管内无气泡,滴定结束后有气泡

已知:①6NH4HCO3 + 3ZnSO4
 ZnCO3·2Zn(OH)2·H2O↓ + 3(NH4)2SO4 + 5CO2↑
ZnCO3·2Zn(OH)2·H2O↓ + 3(NH4)2SO4 + 5CO2↑②ZnCO3·2Zn(OH)2·H2O + 2H3PO4
 Zn3(PO4)2·4H2O + 2H2O + CO2↑
Zn3(PO4)2·4H2O + 2H2O + CO2↑③常温下,Fe3+、Fe2+、Cu2+、Zn2+生成氢氧化物沉淀时的pH:
| Fe3+ | Fe2+ | Cu2+ | Zn2+ | |
| 开始沉淀时的pH | 1.9 | 7.0 | 4.7 | 5.7 |
| 完全沉淀时的pH | 3.7 | 9.0 | 6.7 | 8.1 |
(2)“除铁”操作时,需先将溶液调至接近中性,然后再滴加KMnO4溶液,使溶液中的铁元素转化为Fe(OH)3,该反应的离子方程式为
(3)“转化”结束后,从混合液中分离得到Zn3(PO4)2·4H2O的操作包括
(4)称取45.7 mg Zn3(PO4)2·4H2O进行热重分析,化合物质量随温度的变化关系如图所示,为获得Zn3(PO4)2·2H2O和Zn3(PO4)2·H2O的混合产品,烘干时的温度范围为_______。

| A.90~145℃ | B.145~195℃ | C.195~273℃ | D.>273℃ |
步骤Ⅰ:准确称取0.4570g产品于烧杯中,加入适量盐酸使其溶解,将溶液转移至100 mL容量瓶,定容。
步骤Ⅱ:移取20.00 mL上述溶液于锥形瓶中,加入指示剂,在pH = 5~6的缓冲溶液中用0.02000mol·L-1 Na2H2Y标准溶液滴定至终点,测得Na2H2Y标准溶液的用量为27.60 mL。
步骤Ⅱ中移取溶液时所使用的玻璃仪器为
a.步骤I中定容时俯视刻度线
b.步骤I中转移溶液时未洗涤烧杯
c.步骤II中滴定管未用Na2H2Y标准溶液润洗
d.步骤II中滴定前滴定管内无气泡,滴定结束后有气泡
您最近一年使用:0次
2021-09-16更新
|
665次组卷
|
3卷引用:2021年湖北高考化学试题变式题11-19
解题方法
9 . 二氯异氰尿酸钠的化学式为C3N3O3Cl2Na(简写为DCCNa,摩尔质量为220g/mol)。常温下DCCNa易溶于水难溶于乙醇。实验室可用氰尿酸(C3H3N3O3)与足量Cl2制备DCCNa:2Cl2+C3H3N3O3+3NaOH=C3N3O3Cl2Na+3H2O+2NaCl,实验装置如图所示(夹持装置和加热装置省略):
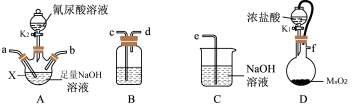
回答下列问题:
(1)仪器X的名称为___________ ;装置D发生的离子反应方程式为___________ 。
(2)B中试剂为___________ (填字母标号);
A.饱和NaCl溶液 B.CCl4 C.浓硫酸 D.NaOH溶液
完成上述产品的制备,装置连接的顺序为___________ 。
f→___________→___________→___________→___________→___________(填小写字母)。
(3)实验员认为可将插入NaOH溶液的导管下端加装多孔的球泡(如图),其目的是______ 。
(4)反应结束后,关闭K1、K2,向X中加入乙醇,静置、减压过滤得粗品;
①乙醇的作用是___________ ;
②减压过滤的优点是___________ ;
③进一步提纯DCCNa的方法是___________ 。
(5)已知实验过程中消耗cmol/L氰尿酸V1mL,最终得到DCCNa的质量为xg,则本次实验的产率为___________ %(用含c、V1、x的代数式表示)。

回答下列问题:
(1)仪器X的名称为
(2)B中试剂为
A.饱和NaCl溶液 B.CCl4 C.浓硫酸 D.NaOH溶液
完成上述产品的制备,装置连接的顺序为
f→___________→___________→___________→___________→___________(填小写字母)。
(3)实验员认为可将插入NaOH溶液的导管下端加装多孔的球泡(如图),其目的是

(4)反应结束后,关闭K1、K2,向X中加入乙醇,静置、减压过滤得粗品;
①乙醇的作用是
②减压过滤的优点是
③进一步提纯DCCNa的方法是
(5)已知实验过程中消耗cmol/L氰尿酸V1mL,最终得到DCCNa的质量为xg,则本次实验的产率为
您最近一年使用:0次
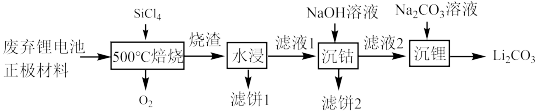
10 . 近几年新能源汽车呈现爆发式增长,对于锂电池的需求量越来越大,而碳酸锂是锂电池的重要原料之一,对废旧锂离子电池进行资源化和无害化处理具有重要的经济和环境效益,利用SiCl4对废弃的锂电池正极材料LiCoO2)进行氧化处理以回收Li等金属的工艺流程如下:
(1)Co在元素周期表的位置是___________ ,Co2+与Co3+的未成对电子数之比为___________ 。
(2)“烧渣”是LiCl、CoCl2和SiO2的混合物。“ 焙烧”反应生成的氧化产物与还原产物的物质的量之比为
焙烧”反应生成的氧化产物与还原产物的物质的量之比为___________ 。
(3)“滤饼2”的主要成分为___________ (填化学式)。利用Li2CO3与CoCO3按n(Li):n(Co)=1:1的比例配合,然后在空气中于 烧结可合成锂电池正极材料LiCoO2,反应的化学方程式为
烧结可合成锂电池正极材料LiCoO2,反应的化学方程式为___________ 。
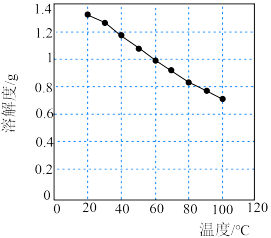
(4)碳酸锂的溶解度随温度变化如图所示。向滤液2中加入Na2CO3溶液,将温度升至90℃是为了提高沉淀反应速率和___________ 。得到碳酸锂沉淀的操作为___________ (填标号)。
(5)常温下,取 “滤液2”,其中
“滤液2”,其中 ,为使锂元素的回收率不低于
,为使锂元素的回收率不低于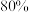 ,则至少应加入
,则至少应加入 固体的质量为
固体的质量为___________ g[已知常温下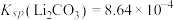 。计算结果保留3位小数。
。计算结果保留3位小数。
(6)由 进一步制得的
进一步制得的 具有反萤石结构,晶胞如图所示。
具有反萤石结构,晶胞如图所示。 在晶胞中的位置为
在晶胞中的位置为___________ 。
② 晶体的密度为
晶体的密度为 ,则晶胞参数(棱长)为
,则晶胞参数(棱长)为___________ nm(列出计算式,阿伏加德罗常数的值为 )。
)。
(1)Co在元素周期表的位置是
(2)“烧渣”是LiCl、CoCl2和SiO2的混合物。“
 焙烧”反应生成的氧化产物与还原产物的物质的量之比为
焙烧”反应生成的氧化产物与还原产物的物质的量之比为(3)“滤饼2”的主要成分为
 烧结可合成锂电池正极材料LiCoO2,反应的化学方程式为
烧结可合成锂电池正极材料LiCoO2,反应的化学方程式为(4)碳酸锂的溶解度随温度变化如图所示。向滤液2中加入Na2CO3溶液,将温度升至90℃是为了提高沉淀反应速率和
(5)常温下,取
 “滤液2”,其中
“滤液2”,其中 ,为使锂元素的回收率不低于
,为使锂元素的回收率不低于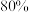 ,则至少应加入
,则至少应加入 固体的质量为
固体的质量为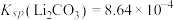 。计算结果保留3位小数。
。计算结果保留3位小数。(6)由
 进一步制得的
进一步制得的 具有反萤石结构,晶胞如图所示。
具有反萤石结构,晶胞如图所示。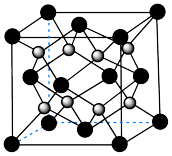
 在晶胞中的位置为
在晶胞中的位置为②
 晶体的密度为
晶体的密度为 ,则晶胞参数(棱长)为
,则晶胞参数(棱长)为 )。
)。
您最近一年使用:0次



