名校
解题方法
1 . ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂.已知ClO2是一种易溶于水而难溶于有机溶剂的气体,实验室制备ClO2的原理是用亚氯酸钠固体与纯净的氯气反应:2NaClO2+Cl2=2ClO2+2NaCl。如图是实验室中利用MnO2和浓盐酸加热反应(MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O)制取干燥纯净的氯气并进一步最终制取和收集一定量纯净的ClO2的装置(某些夹持装置和垫持用品省略).其中E中盛有CCl4液体,(用于除去ClO2中的未反应的Cl2)。

(1)NaClO2中氯元素的化合价是___ ;
(2)写出尾气吸收装置中发生反应的化学方程式___ ;
(3)B中所盛试剂是___ ;C装置中所盛试剂的作用是___ ;
(4)F为ClO2收集装置,应选用的装置是___ (填序号),其中与E装置导管相连的导管口是___ (填接口字母)。


(1)NaClO2中氯元素的化合价是
(2)写出尾气吸收装置中发生反应的化学方程式
(3)B中所盛试剂是
(4)F为ClO2收集装置,应选用的装置是

您最近一年使用:0次
名校
2 . 实验室用二氧化锰和浓盐酸反应制备纯净、干燥的氯气,装置如图所示。

(1)写出仪器的名称:A______ 、B_______ ;
(2)C中装有的试剂是_______ ,它的作用除降低氯气在水中的溶解量外还包括_______ 。D中所盛试剂是浓硫酸,作用是_____ ;
(3)E采用的是______ 排空气法收集气体(填“向上”或“向下”);F中发生的化学反应为_______ ;
(4)某同学建议将F中的导管改为一个倒扣的漏斗,并使得漏斗下边缘与液面相切,这样改进的理由是______ ;
(5) 与浓盐酸反应时,每消耗
与浓盐酸反应时,每消耗 ,生成的
,生成的 在标况下的体积为
在标况下的体积为______ L;
(6)实验发现: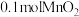 和
和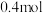 浓盐酸制得的氯气的产量往往远低于
浓盐酸制得的氯气的产量往往远低于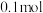 ,原因可能是
,原因可能是________ 。
(7)查资料得知:氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量 生成;
生成; 沸点为10℃,熔点为
沸点为10℃,熔点为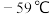 ,液体为红色;
,液体为红色; 沸点为
沸点为 ,液态为黄绿色。设计最简单的实验验证
,液态为黄绿色。设计最简单的实验验证 中是否含有
中是否含有 :
:______ 。

(1)写出仪器的名称:A
(2)C中装有的试剂是
(3)E采用的是
(4)某同学建议将F中的导管改为一个倒扣的漏斗,并使得漏斗下边缘与液面相切,这样改进的理由是
(5)
 与浓盐酸反应时,每消耗
与浓盐酸反应时,每消耗 ,生成的
,生成的 在标况下的体积为
在标况下的体积为(6)实验发现:
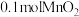 和
和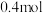 浓盐酸制得的氯气的产量往往远低于
浓盐酸制得的氯气的产量往往远低于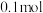 ,原因可能是
,原因可能是(7)查资料得知:氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量
 生成;
生成; 沸点为10℃,熔点为
沸点为10℃,熔点为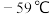 ,液体为红色;
,液体为红色; 沸点为
沸点为 ,液态为黄绿色。设计最简单的实验验证
,液态为黄绿色。设计最简单的实验验证 中是否含有
中是否含有 :
:
您最近一年使用:0次
2020-08-17更新
|
88次组卷
|
2卷引用:福建省厦门市湖滨中学2021-2022学年高一下学期5月月考化学试题
解题方法
3 . 磷化氢(PH3)常用于有机合成、粮仓杀虫等。实验室用白磷(P4)与浓 NaOH加热制备 PH3,同时得到次磷酸钠(NaH2PO2),装置如图。
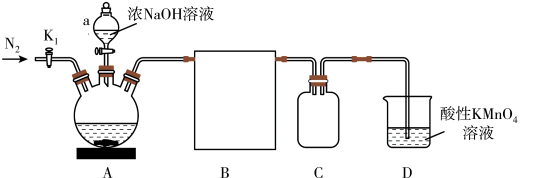
(已知:PH3是无色有毒气体,有强还原性,易自燃;丁醇沸点 117.7℃)
(1)实验室少量白磷保存于______ 。
(2)仪器 a 的名称为______ ,B 应选用图中装置______ 。

(3)实验操作步骤如下:
① 打开 K1,通入 N2一段时间;
② 检查装置气密性;
③ 关闭 K1,打开磁力加热搅拌器加热至 50℃~60℃,滴加烧碱溶液;
④ 在 A 中加入丁醇和白磷。
则正确的操作顺序是______ 。
(4)装置A中发生反应的化学方程式为______ ,使用丁醇作为反应物的分散剂,目的是______ 。
(5)装置C、D的作用分别是______ 、______ 。
(6)测定NaH2PO2纯度。分离提纯A中反应后的混合物,得到NaH2PO2(M=88g·mol-1)粗品,并取1.00g配成100mL溶液。取20.00mL于锥形瓶中,酸化后加入30.00mL0.100mol·L-1碘水,充分反应,以淀粉溶液作指示剂,用0.100mol·L-1Na2S2O3溶液滴定至终点,平均消耗20.00mL。则产品纯度为______ 。(相关反应为:H2PO +H2O+I2=H2PO
+H2O+I2=H2PO +2H++2I-,2S2O
+2H++2I-,2S2O +I2=S4O
+I2=S4O +2I-)
+2I-)

(已知:PH3是无色有毒气体,有强还原性,易自燃;丁醇沸点 117.7℃)
(1)实验室少量白磷保存于
(2)仪器 a 的名称为

(3)实验操作步骤如下:
① 打开 K1,通入 N2一段时间;
② 检查装置气密性;
③ 关闭 K1,打开磁力加热搅拌器加热至 50℃~60℃,滴加烧碱溶液;
④ 在 A 中加入丁醇和白磷。
则正确的操作顺序是
(4)装置A中发生反应的化学方程式为
(5)装置C、D的作用分别是
(6)测定NaH2PO2纯度。分离提纯A中反应后的混合物,得到NaH2PO2(M=88g·mol-1)粗品,并取1.00g配成100mL溶液。取20.00mL于锥形瓶中,酸化后加入30.00mL0.100mol·L-1碘水,充分反应,以淀粉溶液作指示剂,用0.100mol·L-1Na2S2O3溶液滴定至终点,平均消耗20.00mL。则产品纯度为
 +H2O+I2=H2PO
+H2O+I2=H2PO +2H++2I-,2S2O
+2H++2I-,2S2O +I2=S4O
+I2=S4O +2I-)
+2I-)
您最近一年使用:0次
2020-09-28更新
|
150次组卷
|
2卷引用:福建省泉州市2021届高三质量监测(一) 化学试题
名校
解题方法
4 . 硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
I.[查阅资料]
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水。其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3,所得产品中常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
Ⅱ.[制备产品]实验装置如图所示(省略夹持装置)
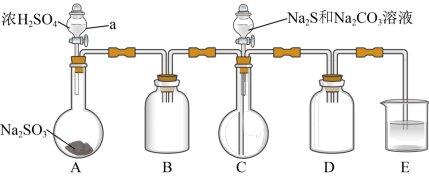
实验步骤:
(1)仪器B和D的作用是___ ,按图示加入试剂,E中的试剂是___ (选填下列字母编号)。
A.浓H2SO4 B.饱和NaHSO3溶液 C.NaOH溶液 D.饱和食盐水
(2)先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加浓H2SO4,C中反应生成Na2S2O3和CO2,写出C中反应的离子方程式为___ 。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合液,滤液经___ (填写操作名称)、过滤、洗涤、干燥、得到产品。
Ⅲ.[探究与反思]
(4)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤,洗涤,___ ,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(5)为减少装置C中生成的Na2SO4的量,在不改变原有装置的基础上对原有实验Ⅱ步骤(2)进行了改进,改进后的操作是___ ,然后再向C中烧瓶加入硫化钠和碳酸钠的混合溶液。
(6)探究Na2S2O3是否具有还原性:向新制氯水中滴加Na2S2O3溶液,若看到氯水颜色变浅(或褪色),说明有还原性(已知:Na2S2O3被氧化成Na2SO4),反应的离子方程式为___ 。
I.[查阅资料]
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水。其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3,所得产品中常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
Ⅱ.[制备产品]实验装置如图所示(省略夹持装置)

实验步骤:
(1)仪器B和D的作用是
A.浓H2SO4 B.饱和NaHSO3溶液 C.NaOH溶液 D.饱和食盐水
(2)先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加浓H2SO4,C中反应生成Na2S2O3和CO2,写出C中反应的离子方程式为
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合液,滤液经
Ⅲ.[探究与反思]
(4)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤,洗涤,
(5)为减少装置C中生成的Na2SO4的量,在不改变原有装置的基础上对原有实验Ⅱ步骤(2)进行了改进,改进后的操作是
(6)探究Na2S2O3是否具有还原性:向新制氯水中滴加Na2S2O3溶液,若看到氯水颜色变浅(或褪色),说明有还原性(已知:Na2S2O3被氧化成Na2SO4),反应的离子方程式为
您最近一年使用:0次
名校
解题方法
5 . 以下关于化学实验中“先与后”的说法中正确的是
①蒸馏时,先点燃酒精灯,再通冷凝水
②加热氯酸钾和二氧化锰的混合物制备氧气,用排水法收集气体后,先移出导管后撤酒精灯
③实验室制取某气体时,先检查装置气密性后装药品
④分液时,先打开分液漏斗上口的塞子,后打开分液漏斗的旋塞
⑤H2还原CuO实验时,先检验气体纯度后点燃酒精灯
⑥使用托盘天平称盘物体质量时,先放质量较小的砝码,后放质量较大的砝码
⑦蒸馏时加热一段时间,发现忘记加沸石,应迅速补加沸石后继续加热
①蒸馏时,先点燃酒精灯,再通冷凝水
②加热氯酸钾和二氧化锰的混合物制备氧气,用排水法收集气体后,先移出导管后撤酒精灯
③实验室制取某气体时,先检查装置气密性后装药品
④分液时,先打开分液漏斗上口的塞子,后打开分液漏斗的旋塞
⑤H2还原CuO实验时,先检验气体纯度后点燃酒精灯
⑥使用托盘天平称盘物体质量时,先放质量较小的砝码,后放质量较大的砝码
⑦蒸馏时加热一段时间,发现忘记加沸石,应迅速补加沸石后继续加热
| A.②③④⑤⑦ | B.①②③④⑦ | C.②③④⑤ | D.全部 |
您最近一年使用:0次
2020-11-01更新
|
223次组卷
|
17卷引用:福建省仙游县郊尾中学2020届高三上学期期中考试化学试题
福建省仙游县郊尾中学2020届高三上学期期中考试化学试题河北省冀州市中学2017-2018学年高一上学期第一次月考化学试题河北省定州中学2017-2018学年高一上学期第一次月考化学试题【全国百强校】山西省怀仁县第一中学2018-2019学年高一上学期第一次月考化学试题2【全国百强校】山西省怀仁县第一中学2018-2019学年高一上学期第一次月考化学试题1【全国百强校】江西省南昌市第二中学2018-2019学年高二下学期期末考试化学试题河北省保定市曲阳一中2020届高三上学期第一次月考化学试题2020届高考化学小题狂练(全国通用版)专练19 化学实验基础黑龙江省大庆市东风中学2019-2020学年高一上学期期末考试化学试题宁夏回族自治区银川一中2020届高三第二次模拟考试理综化学试题吉林省白城市洮南市第一中学2021届高三上学期第一次月考化学试题内蒙古通辽市开鲁县第一中学2020-2021学年高一上学期第一次月考化学试题河北省石家庄市辛集市第一中学2020届高三下学期5月月考化学试题吉林省辽源市第五中学校2019-2020学年高一上学期第一次月考化学试题(已下线)【南昌新东方】16. 九江同文中学 袁裕虎甘肃省武威第一中学2020-2021学年高一上学期期中考试化学试题内蒙古包头市第四中学2021-2022学年高三上学期期中考试理科综合化学试题
名校
解题方法
6 . ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂。已知ClO2是一种易溶于水而难溶于有机溶剂的气体,实验室制备ClO2的原理是用亚氯酸钠固体与氯气反应: 2NaClO2 + Cl2 = 2ClO2 + 2NaCl.下图是实验室中制取干燥纯净氯气并进一步最终制取和收集一定量较纯净的ClO2的装置(某些夹持装置和垫持用品省略).其中E中盛有CCl4液体(用于除去ClO2中未反应的Cl2)

(1)仪器P的名称是______
(2)写出装置A中烧瓶内发生反应的化学方程式:_________________
(3)B装置中所盛试剂是________ ; C装置所盛试剂的作用是__________________
(4)F为ClO2收集装置,应选用的装置是___________ (填序号),其中与E装置导管相连的导管口是___________ (填接口字母)。

(5) NaClO2中氯元素的化合价是_________ 。

(1)仪器P的名称是
(2)写出装置A中烧瓶内发生反应的化学方程式:
(3)B装置中所盛试剂是
(4)F为ClO2收集装置,应选用的装置是

(5) NaClO2中氯元素的化合价是
您最近一年使用:0次
解题方法
7 . 二氧化氯(C1O2)是一种黄绿色气体,沸点为11℃,不稳定,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。C1O2易溶于水但不与水反应,其水溶液在温度过高时有可能爆炸。某小组按照以下实验装置制备C1O2并验证其某些性质。
请回答下列问题:
(1)实验时A装置需要控制温度为60~80℃,则A装置加热的方式是___ ,该加热方式的优点是_____ 。
(2)通入氨气的主要作用有两个,一是可以起到搅拌作用,二是____ 。
(3)B装置的作用是___ 。C装置用来吸收C1O2,则C中液体易选用下列___ (填序号)。
①热水 ②冰水 ③饱和食盐水
(4)装置D中C1O2与NaOH溶液反应可生成等物质的量的两种钠盐,其中一种为NaClO2,装置C中生成这两种钠盐的化学方程式为____ 。饱和NaClO2溶液在温度低于38℃时析出晶体NaClO2•3H2O,在温度高于38℃时析出晶体NaClO2.请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:a.___ ;b.___ ;c.洗涤;d.干燥。
(5)设计一个简易实验证明二氧化氯具有永久的漂白性:___ 。

请回答下列问题:
(1)实验时A装置需要控制温度为60~80℃,则A装置加热的方式是
(2)通入氨气的主要作用有两个,一是可以起到搅拌作用,二是
(3)B装置的作用是
①热水 ②冰水 ③饱和食盐水
(4)装置D中C1O2与NaOH溶液反应可生成等物质的量的两种钠盐,其中一种为NaClO2,装置C中生成这两种钠盐的化学方程式为
(5)设计一个简易实验证明二氧化氯具有永久的漂白性:

您最近一年使用:0次
2020-02-14更新
|
200次组卷
|
3卷引用:福建省福清市2020届高三下学期线上教学质量检测理综化学试题
名校
8 . 下列实验合理的是



A.用图1所示装置证明非金属性强弱: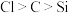 |
| B.用图2所示装置吸收氨气,并防止倒吸 |
C.用图3所示装置制备并收集少量 气体 气体 |
| D.用图4所示装置制备少量氧气 |
您最近一年使用:0次
2020-01-04更新
|
721次组卷
|
7卷引用:福建省厦门第一中学2023-2024学年高三暑期复习检测化学试题
名校
解题方法
9 . 下列药品和装置合理且能完成相应实验的是


| A.喷泉实验 | B.实验室制取并收集氨气 | C.制备氢氧化亚铁 | D.制取并收集二氧化硫 |
您最近一年使用:0次
2019-12-18更新
|
171次组卷
|
2卷引用:福建省南安第一中学2020届高三上学期第二次月考化学试题
2012·江苏·二模
名校
10 . 下列有关实验装置的说法,正确的是
A.用图1装置制取干燥纯净的NH3 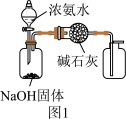 |
B.用图2装置实验室制备Fe(OH)2 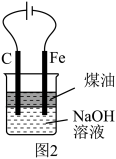 |
C.用图3装置可以完成“喷泉”实验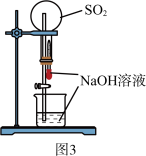 |
D.用图4装置测量Cu与浓硝酸反应产生气体的体积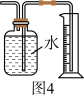 |
您最近一年使用:0次
2019-10-23更新
|
332次组卷
|
11卷引用:福建省福州市第三中学2019-2020学年上学期高三9月月考化学试题
福建省福州市第三中学2019-2020学年上学期高三9月月考化学试题福建省龙岩市武平县第一中学2021届高三上学期10月月考化学试题(已下线)2012届江苏省苏中三市高三5月第二次调研测试化学试卷(已下线)2014届安徽省六校研究会高三联考(1月)理综化学试卷(已下线) 2012届江苏省苏中三市高三5月第二次调研测试化学试卷 2015届山东省城阳一中高三期中统考化学试卷【全国百强校】山西省山西大学附属中学2019届高三上学期9月模块诊断化学试题吉林省靖宇县一中2020届高三上学期9月月考化学试题江西省南昌市新建县第一中学2020届高三上学期第一次月考化学试题2020届高三化学二轮冲刺新题专练——仪器的连接和实验的操作正误判断2020届高三化学无机化学二轮专题复习——铁的氢氧化物的性质与应用【精编24题】



