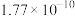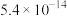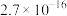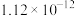解题方法
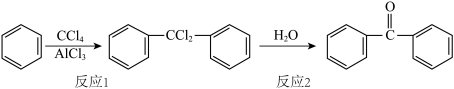
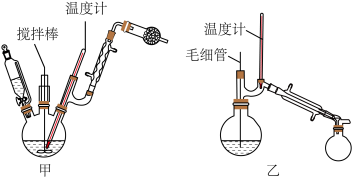
1 . 二苯酮是紫外线吸收剂、有机颜料等的中间体,某小组设计实验并合成二苯酮反应原理及实验装置如下:
实验步骤
步骤一:按图示安装仪器,并检验装置的气密性
步骤二:称取m g无水氯化铝,置于三颈烧瓶中,再加入4.7mL(0.05mol)四氯化碳。
将三颈烧瓶在冷水浴中冷却到10~15℃,缓慢滴加2.7mL(0.03mol)无水苯及2.3mL四氯化碳混合液,维持反应温度在5~10℃之间。
步骤三:在10℃左右继续搅拌1小时。然后将三颈烧瓶没入冰水浴,在搅拌下慢慢滴加30mL水。改为蒸馏装置,蒸去四氯化碳及少量未反应的苯,在加热套上蒸馏0.5h,并促使二苯二氯甲烷水解完全。
步骤四:分出下层粗产品,水层用蒸出的四氯化碳萃取一次,合并后用无水硫酸镁干燥。先在常压下蒸出四氯化碳,温度升至90℃左右时停止加热,再减压蒸馏出二苯酮。
(1)球形干燥管的作用______ 。
(2)一般要称取高于催化剂量的氯化铝,原因______ 。
(3)图乙中毛细管的作用______ 。
(4)需减压蒸出二苯酮的原因______ 。
(5)①若步骤三、四操作忽略水体积的变化,则萃取完成后,为了测定二苯酮水解后溶液中 浓度,取10mL水层溶液,选用
浓度,取10mL水层溶液,选用______ (填序号)做指示剂,用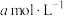 的硝酸银溶液进行滴定,滴定终点消耗V mL,达到滴定终点的现象为
的硝酸银溶液进行滴定,滴定终点消耗V mL,达到滴定终点的现象为______ 。
A.NaCl溶液 B.NaBr溶液 C.NaCN溶液 D. 溶液
溶液
②若步骤四蒸馏出的产品不纯,需用______ (填标号)进行重结晶进一步提纯得到n克二苯酮;
A.NaOH溶液 B.乙醇 C.盐酸 D.水 E.石油醚
通过计算可知,步骤三、四操作过程中产品的损耗率为______ (列出计算式,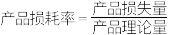
 )。
)。
名称 | 分子量 | 性状 | 熔/沸点 | 溶解性 |
苯 | 78 | 无色透明液体 | 5.5/80.1℃ | 不溶于水,易溶于醇和醚 |
| 154 | 无色液体 | -22.6/76.8℃ | 微溶于水,易溶于醇和醚 |
无水 | 133.5 | 白色粉末 | 197/180(升华)℃ | 溶于水并强烈水解,溶于醇、醚并放热 |
二苯酮 | 182 | 白色晶体 | 48.5/305.4℃ | 不溶于水,易溶于醇和醚 |
步骤一:按图示安装仪器,并检验装置的气密性
步骤二:称取m g无水氯化铝,置于三颈烧瓶中,再加入4.7mL(0.05mol)四氯化碳。
将三颈烧瓶在冷水浴中冷却到10~15℃,缓慢滴加2.7mL(0.03mol)无水苯及2.3mL四氯化碳混合液,维持反应温度在5~10℃之间。
步骤三:在10℃左右继续搅拌1小时。然后将三颈烧瓶没入冰水浴,在搅拌下慢慢滴加30mL水。改为蒸馏装置,蒸去四氯化碳及少量未反应的苯,在加热套上蒸馏0.5h,并促使二苯二氯甲烷水解完全。
步骤四:分出下层粗产品,水层用蒸出的四氯化碳萃取一次,合并后用无水硫酸镁干燥。先在常压下蒸出四氯化碳,温度升至90℃左右时停止加热,再减压蒸馏出二苯酮。
(1)球形干燥管的作用
(2)一般要称取高于催化剂量的氯化铝,原因
(3)图乙中毛细管的作用
(4)需减压蒸出二苯酮的原因
(5)①若步骤三、四操作忽略水体积的变化,则萃取完成后,为了测定二苯酮水解后溶液中
 浓度,取10mL水层溶液,选用
浓度,取10mL水层溶液,选用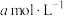 的硝酸银溶液进行滴定,滴定终点消耗V mL,达到滴定终点的现象为
的硝酸银溶液进行滴定,滴定终点消耗V mL,达到滴定终点的现象为A.NaCl溶液 B.NaBr溶液 C.NaCN溶液 D.
 溶液
溶液难溶物 | AgCl | AgBr | AgCN |
|
颜色 | 白色 | 浅黄色 | 白色 | 砖红色 |
|
|
|
|
|
A.NaOH溶液 B.乙醇 C.盐酸 D.水 E.石油醚
通过计算可知,步骤三、四操作过程中产品的损耗率为
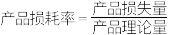
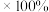 )。
)。
您最近一年使用:0次
2 . 亚硫酸钠可用作人造纤维稳定剂、造纸木质素脱除剂等。某课题小组利用二氧化硫制备亚硫酸钠并测定其含量,装置如下所示。
(1)装置A中所装试剂为________ ,作用是________ 。
(2)实验时,关闭活塞 ,通入过量
,通入过量 ,再打开活塞
,再打开活塞 ,充分反应后即可制得亚硫酸钠。反应的离子方程式为
,充分反应后即可制得亚硫酸钠。反应的离子方程式为________ 。
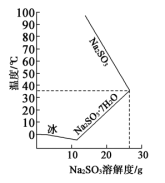
(3)上述装置中存在的一处缺陷是________ 。
(4)亚硫酸钠的溶解度随温度的变化如上图所示,从 装置溶液中获得
装置溶液中获得 的方法是
的方法是________ 。
(5)测定上述产品中亚硫酸钠样品含量。其装置如图所示: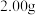 样品并加入水将其溶解,锥形瓶中加入
样品并加入水将其溶解,锥形瓶中加入 水、
水、 淀粉溶液,并预加
淀粉溶液,并预加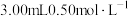 的碘标准溶液,搅拌。
的碘标准溶液,搅拌。
②持续通入氮气,再加入过量磷酸,加入并保持微沸。同时用碘标准液滴定,至终点时滴定消耗了 碘标准溶液。
碘标准溶液。
③做空白实验,消耗了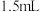 碘标准溶液。
碘标准溶液。
该样品中亚硫酸钠的含量为_______ (保留两位有效数字);
若先加入磷酸再通入氮气,会使测定结果_______ 。(填“偏高”“偏低”或“无影响”)

(1)装置A中所装试剂为
(2)实验时,关闭活塞
 ,通入过量
,通入过量 ,再打开活塞
,再打开活塞 ,充分反应后即可制得亚硫酸钠。反应的离子方程式为
,充分反应后即可制得亚硫酸钠。反应的离子方程式为(3)上述装置中存在的一处缺陷是
(4)亚硫酸钠的溶解度随温度的变化如上图所示,从
 装置溶液中获得
装置溶液中获得 的方法是
的方法是(5)测定上述产品中亚硫酸钠样品含量。其装置如图所示:
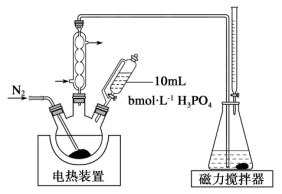
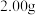 样品并加入水将其溶解,锥形瓶中加入
样品并加入水将其溶解,锥形瓶中加入 水、
水、 淀粉溶液,并预加
淀粉溶液,并预加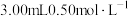 的碘标准溶液,搅拌。
的碘标准溶液,搅拌。②持续通入氮气,再加入过量磷酸,加入并保持微沸。同时用碘标准液滴定,至终点时滴定消耗了
 碘标准溶液。
碘标准溶液。③做空白实验,消耗了
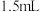 碘标准溶液。
碘标准溶液。该样品中亚硫酸钠的含量为
若先加入磷酸再通入氮气,会使测定结果
您最近一年使用:0次
名校
3 .  是重要的硫-氮二元化合物室温下为橙黄色固体,178~187℃熔化并分解。实验室利用
是重要的硫-氮二元化合物室温下为橙黄色固体,178~187℃熔化并分解。实验室利用 和
和 制备
制备 的装置如图所示(加热及夹持装置略)。已知
的装置如图所示(加热及夹持装置略)。已知 易水解,熔点为-78℃,沸点为60℃。
易水解,熔点为-78℃,沸点为60℃。
Ⅰ.制备
(1)操作步骤的先后顺序为___________ 。
①组装仪器并检验装置气密性,加入药品
②加热装置C使其中的硫磺熔化
③通入 ,通冷凝水,一段时间后,关闭
,通冷凝水,一段时间后,关闭
④打开 、
、 ,关闭
,关闭
⑤充分反应后停止滴加浓盐酸
⑥向装置A中滴加浓盐酸,加热装置C至135℃左右
(2)仪器b的名称为___________ ,装置B中盛放的试剂为___________ (填试剂名称)。
(3)为使装置C受热均匀,可采取的加热方式为___________ ,装置D的作用为___________ 。
Ⅱ.制备
打开止水夹 ,向装置F中滴入浓氨水,待装置C中充分反应后停止滴加浓氨水,冷却后停止通冷凝水。
,向装置F中滴入浓氨水,待装置C中充分反应后停止滴加浓氨水,冷却后停止通冷凝水。
(4)生成 的同时还生成一种常见固体单质和一种盐,反应的化学方程式为
的同时还生成一种常见固体单质和一种盐,反应的化学方程式为___________ 。
Ⅲ.测定的纯度
称取5.00g 样品,加入NaOH溶液加热,使氮元素完全转化为 ,用足量硼酸溶液吸收。将吸收液配成100mL溶液,用移液管移取20.00mL,以甲基红-亚甲蓝为指示剂用1.00
,用足量硼酸溶液吸收。将吸收液配成100mL溶液,用移液管移取20.00mL,以甲基红-亚甲蓝为指示剂用1.00 盐酸进行滴定,重复3次实验,平均消耗20.00mL盐酸。已知滴定反应为
盐酸进行滴定,重复3次实验,平均消耗20.00mL盐酸。已知滴定反应为 。
。
(5)制得 的纯度为
的纯度为___________ 。下列实验操作导致 测定结果偏低的是
测定结果偏低的是___________ 。
A.盛放待测液的锥形瓶洗涤后未干燥直接使用
B.移液管用蒸馏水洗涤后未用吸收液润洗
C.滴定前滴定管尖嘴处有气泡,滴定后无气泡
D.滴定前仰视滴定管读数,滴定后俯视读数
 是重要的硫-氮二元化合物室温下为橙黄色固体,178~187℃熔化并分解。实验室利用
是重要的硫-氮二元化合物室温下为橙黄色固体,178~187℃熔化并分解。实验室利用 和
和 制备
制备 的装置如图所示(加热及夹持装置略)。已知
的装置如图所示(加热及夹持装置略)。已知 易水解,熔点为-78℃,沸点为60℃。
易水解,熔点为-78℃,沸点为60℃。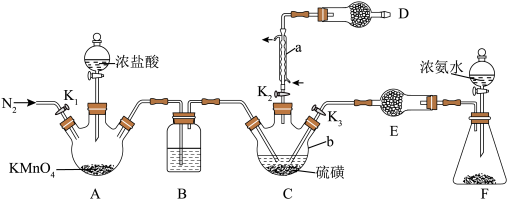
Ⅰ.制备

(1)操作步骤的先后顺序为
①组装仪器并检验装置气密性,加入药品
②加热装置C使其中的硫磺熔化
③通入
 ,通冷凝水,一段时间后,关闭
,通冷凝水,一段时间后,关闭
④打开
 、
、 ,关闭
,关闭
⑤充分反应后停止滴加浓盐酸
⑥向装置A中滴加浓盐酸,加热装置C至135℃左右
(2)仪器b的名称为
(3)为使装置C受热均匀,可采取的加热方式为
Ⅱ.制备

打开止水夹
 ,向装置F中滴入浓氨水,待装置C中充分反应后停止滴加浓氨水,冷却后停止通冷凝水。
,向装置F中滴入浓氨水,待装置C中充分反应后停止滴加浓氨水,冷却后停止通冷凝水。(4)生成
 的同时还生成一种常见固体单质和一种盐,反应的化学方程式为
的同时还生成一种常见固体单质和一种盐,反应的化学方程式为Ⅲ.测定的纯度
称取5.00g 样品,加入NaOH溶液加热,使氮元素完全转化为
 ,用足量硼酸溶液吸收。将吸收液配成100mL溶液,用移液管移取20.00mL,以甲基红-亚甲蓝为指示剂用1.00
,用足量硼酸溶液吸收。将吸收液配成100mL溶液,用移液管移取20.00mL,以甲基红-亚甲蓝为指示剂用1.00 盐酸进行滴定,重复3次实验,平均消耗20.00mL盐酸。已知滴定反应为
盐酸进行滴定,重复3次实验,平均消耗20.00mL盐酸。已知滴定反应为 。
。(5)制得
 的纯度为
的纯度为 测定结果偏低的是
测定结果偏低的是A.盛放待测液的锥形瓶洗涤后未干燥直接使用
B.移液管用蒸馏水洗涤后未用吸收液润洗
C.滴定前滴定管尖嘴处有气泡,滴定后无气泡
D.滴定前仰视滴定管读数,滴定后俯视读数
您最近一年使用:0次
2024-03-14更新
|
926次组卷
|
4卷引用:山东省德州市2023-2024学年高三下学期一模考试化学试题
名校
4 . 实验室使用标准 溶液测定补铁剂硫酸亚铁片中
溶液测定补铁剂硫酸亚铁片中 的含量,发生反应为
的含量,发生反应为 。加入无色、被氧化后变为紫红色的二苯胺磺酸钠做指示剂。下列说法错误的是
。加入无色、被氧化后变为紫红色的二苯胺磺酸钠做指示剂。下列说法错误的是
 溶液测定补铁剂硫酸亚铁片中
溶液测定补铁剂硫酸亚铁片中 的含量,发生反应为
的含量,发生反应为 。加入无色、被氧化后变为紫红色的二苯胺磺酸钠做指示剂。下列说法错误的是
。加入无色、被氧化后变为紫红色的二苯胺磺酸钠做指示剂。下列说法错误的是| A.将硫酸亚铁片研碎,置于稀硫酸中溶解后过滤 |
| B.标准重铬酸钾液应用酸式滴定管取用 |
C.由实验可知酸性溶液中还原性: 二苯胺磺酸钠 二苯胺磺酸钠 |
D.酸性 溶液与乙醇生成乙酸的离子方程式为: 溶液与乙醇生成乙酸的离子方程式为: |
您最近一年使用:0次
名校
5 . 实验室用 通入
通入 和
和 的混合溶液中来制备
的混合溶液中来制备 并测定所得产品纯度。
并测定所得产品纯度。

已知:① 易溶于水,难溶于乙醇,温度高于
易溶于水,难溶于乙醇,温度高于 易失去结晶水。
易失去结晶水。
②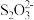 酸性条件下易发生反应:
酸性条件下易发生反应: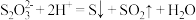 。
。
实验步骤:
Ⅰ. 的制备:装置B产生的
的制备:装置B产生的 缓慢的通入装置
缓慢的通入装置 中
中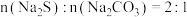 的混合溶液,加热并搅拌至溶液
的混合溶液,加热并搅拌至溶液 约为7时,停止通入
约为7时,停止通入 ,停止搅拌和加热得混合溶液。
,停止搅拌和加热得混合溶液。
Ⅱ.产品分离提纯:将 中混合溶液,经操作(a)、过滤、洗涤、干燥,得到
中混合溶液,经操作(a)、过滤、洗涤、干燥,得到 粗产品。
粗产品。
Ⅲ.产品纯度测定:取 产品配制成
产品配制成 溶液,取出
溶液,取出 置于锥形瓶中,加入淀粉溶液作指示剂,用
置于锥形瓶中,加入淀粉溶液作指示剂,用 的碘标准溶液滴定至终点,发生反应:
的碘标准溶液滴定至终点,发生反应: ,滴定三次平均消耗碘溶液
,滴定三次平均消耗碘溶液 ,计算样品中
,计算样品中 纯度。
纯度。
请回答:
(1)装置 的名称为
的名称为_________ .
(2)制取 的反应的化学方程式为
的反应的化学方程式为__________________ ;C中反应结束时混合溶液 过高或过低将导致
过高或过低将导致 产率降低,原因是
产率降低,原因是_________ .
(3)Ⅱ为产品的分离提纯
①操作(a)为_________ ,为减少产品损失,粗产品可以用_________ 洗涤。
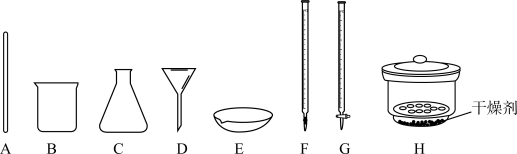
②从下图选出Ⅱ中可能使用到的仪器_________ .
(4)Ⅲ为氧化还原滴定法测定样品中 的纯度
的纯度
①滴定终点的现象是__________________ .
②样品中 的纯度为
的纯度为_________ .
 通入
通入 和
和 的混合溶液中来制备
的混合溶液中来制备 并测定所得产品纯度。
并测定所得产品纯度。
已知:①
 易溶于水,难溶于乙醇,温度高于
易溶于水,难溶于乙醇,温度高于 易失去结晶水。
易失去结晶水。②
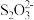 酸性条件下易发生反应:
酸性条件下易发生反应: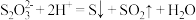 。
。实验步骤:
Ⅰ.
 的制备:装置B产生的
的制备:装置B产生的 缓慢的通入装置
缓慢的通入装置 中
中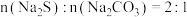 的混合溶液,加热并搅拌至溶液
的混合溶液,加热并搅拌至溶液 约为7时,停止通入
约为7时,停止通入 ,停止搅拌和加热得混合溶液。
,停止搅拌和加热得混合溶液。Ⅱ.产品分离提纯:将
 中混合溶液,经操作(a)、过滤、洗涤、干燥,得到
中混合溶液,经操作(a)、过滤、洗涤、干燥,得到 粗产品。
粗产品。Ⅲ.产品纯度测定:取
 产品配制成
产品配制成 溶液,取出
溶液,取出 置于锥形瓶中,加入淀粉溶液作指示剂,用
置于锥形瓶中,加入淀粉溶液作指示剂,用 的碘标准溶液滴定至终点,发生反应:
的碘标准溶液滴定至终点,发生反应: ,滴定三次平均消耗碘溶液
,滴定三次平均消耗碘溶液 ,计算样品中
,计算样品中 纯度。
纯度。请回答:
(1)装置
 的名称为
的名称为(2)制取
 的反应的化学方程式为
的反应的化学方程式为 过高或过低将导致
过高或过低将导致 产率降低,原因是
产率降低,原因是(3)Ⅱ为产品的分离提纯
①操作(a)为
②从下图选出Ⅱ中可能使用到的仪器

(4)Ⅲ为氧化还原滴定法测定样品中
 的纯度
的纯度①滴定终点的现象是
②样品中
 的纯度为
的纯度为
您最近一年使用:0次
2023-12-03更新
|
676次组卷
|
3卷引用:山东省德州市第一中学、第二中学2024届高三上学期适应性联考模拟预测化学试题
山东省德州市第一中学、第二中学2024届高三上学期适应性联考模拟预测化学试题(已下线)题型四 以无机物制备为载体的综合实验-备战2024年高考化学答题技巧与模板构建四川省成都市石室中学2024届高三下学期二诊模拟考试理科综合化学试题
解题方法
6 .  是实验室定量分析中的重要还原剂,制备装置如图所示。(已知:
是实验室定量分析中的重要还原剂,制备装置如图所示。(已知: 易溶于水,难溶于乙醇,在中性或碱性溶液中稳定存在。)
易溶于水,难溶于乙醇,在中性或碱性溶液中稳定存在。)

(1)装置C中反应的化学方程式为___________ 。
(2)实验步骤如下:
①组装好仪器,然后检验装置的气密性,将所需药品加入各仪器装置;
②打开 ,关闭
,关闭 ,调节
,调节 使硫酸缓缓滴下,C中导管口有气泡冒出,pH计读数逐渐减小,当pH计读数接近7时,此时的操作为
使硫酸缓缓滴下,C中导管口有气泡冒出,pH计读数逐渐减小,当pH计读数接近7时,此时的操作为___________ ,原因是___________ 。
③将装置C中所得溶液经一系列操作,最后洗涤、干燥,得到 样品。洗涤时为尽可能避免产品损失应选用的试剂是
样品。洗涤时为尽可能避免产品损失应选用的试剂是___________ 。
(3) 溶液可用于测定NaClO样品中有效氯含量,其原理为:
溶液可用于测定NaClO样品中有效氯含量,其原理为: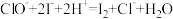 ;
; 。取2.5gNaClO样品配制成250mL溶液,取25.00mL待测液于碘量瓶中,加入10mL
。取2.5gNaClO样品配制成250mL溶液,取25.00mL待测液于碘量瓶中,加入10mL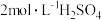 溶液和过量KI溶液,密封在暗处静置5min后加入指示剂,用
溶液和过量KI溶液,密封在暗处静置5min后加入指示剂,用 溶液进行滴定,平行滴定三次,平均消耗
溶液进行滴定,平行滴定三次,平均消耗 溶液的体积20.00mL。
溶液的体积20.00mL。
①滴定终点的判断方法是___________ 。
②该NaClO样品中有效氯含量为___________ 。(该样品的有效氯 )
)
(4)下列操作引起测量结果偏低的是___________。(填字母)。
 是实验室定量分析中的重要还原剂,制备装置如图所示。(已知:
是实验室定量分析中的重要还原剂,制备装置如图所示。(已知: 易溶于水,难溶于乙醇,在中性或碱性溶液中稳定存在。)
易溶于水,难溶于乙醇,在中性或碱性溶液中稳定存在。)
(1)装置C中反应的化学方程式为
(2)实验步骤如下:
①组装好仪器,然后检验装置的气密性,将所需药品加入各仪器装置;
②打开
 ,关闭
,关闭 ,调节
,调节 使硫酸缓缓滴下,C中导管口有气泡冒出,pH计读数逐渐减小,当pH计读数接近7时,此时的操作为
使硫酸缓缓滴下,C中导管口有气泡冒出,pH计读数逐渐减小,当pH计读数接近7时,此时的操作为③将装置C中所得溶液经一系列操作,最后洗涤、干燥,得到
 样品。洗涤时为尽可能避免产品损失应选用的试剂是
样品。洗涤时为尽可能避免产品损失应选用的试剂是(3)
 溶液可用于测定NaClO样品中有效氯含量,其原理为:
溶液可用于测定NaClO样品中有效氯含量,其原理为: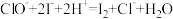 ;
; 。取2.5gNaClO样品配制成250mL溶液,取25.00mL待测液于碘量瓶中,加入10mL
。取2.5gNaClO样品配制成250mL溶液,取25.00mL待测液于碘量瓶中,加入10mL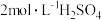 溶液和过量KI溶液,密封在暗处静置5min后加入指示剂,用
溶液和过量KI溶液,密封在暗处静置5min后加入指示剂,用 溶液进行滴定,平行滴定三次,平均消耗
溶液进行滴定,平行滴定三次,平均消耗 溶液的体积20.00mL。
溶液的体积20.00mL。①滴定终点的判断方法是
②该NaClO样品中有效氯含量为
 )
)(4)下列操作引起测量结果偏低的是___________。(填字母)。
A.配制 溶液时俯视容量瓶刻线 溶液时俯视容量瓶刻线 |
| B.称取NaClO样品时药品和砝码位置放反(1g以下用游码) |
| C.滴定终点时俯视读数 |
| D.碱式滴定管未润洗 |
您最近一年使用:0次
名校
7 . 钠长石(主要成分 )是地表岩石最重要的造岩矿物,也是工业生产的重要原料。钠长石中铁元素的价态既有+2价,也有+3价。以该矿石为原料制备金属钠的工艺流程如下:
)是地表岩石最重要的造岩矿物,也是工业生产的重要原料。钠长石中铁元素的价态既有+2价,也有+3价。以该矿石为原料制备金属钠的工艺流程如下:

已知:该工艺条件下,金属离子完全沉淀为氢氧化物时的pH数据如下表:
回答下列问题:
(1)写出少量NaClO与溶液A反应的离子方程式___________ 。NaClO不可加入过量的原因是___________ 。
(2)下面物质中适合替换NaClO的是___________(填字母)。
(3)溶质质量分数为14%的NaOH溶液,加热蒸发掉100g水后,得到溶质质量分数为28%的NaOH溶液87.5mL,则所得溶液的物质的量浓度为___________ mol/L。利用该NaOH溶液调节pH=4.0,所得“难溶物1”的主要成分是___________ (写化学式)。
(4)写出制备金属钠的化学反应方程式___________ 。
(5)钠长石中铁元素的价态有+2,也有+3,钠长石中Fe(Ⅱ)和Fe(Ⅲ)的个数比为3∶1,则钠长石化学式中
___________ 。
 )是地表岩石最重要的造岩矿物,也是工业生产的重要原料。钠长石中铁元素的价态既有+2价,也有+3价。以该矿石为原料制备金属钠的工艺流程如下:
)是地表岩石最重要的造岩矿物,也是工业生产的重要原料。钠长石中铁元素的价态既有+2价,也有+3价。以该矿石为原料制备金属钠的工艺流程如下:
已知:该工艺条件下,金属离子完全沉淀为氢氧化物时的pH数据如下表:
| 离子 |  |  |  |
完全沉淀 | 12.0 | 5.8 | 4.0 |
(1)写出少量NaClO与溶液A反应的离子方程式
(2)下面物质中适合替换NaClO的是___________(填字母)。
A. | B.NaCl | C. | D. |
(3)溶质质量分数为14%的NaOH溶液,加热蒸发掉100g水后,得到溶质质量分数为28%的NaOH溶液87.5mL,则所得溶液的物质的量浓度为
(4)写出制备金属钠的化学反应方程式
(5)钠长石中铁元素的价态有+2,也有+3,钠长石中Fe(Ⅱ)和Fe(Ⅲ)的个数比为3∶1,则钠长石化学式中

您最近一年使用:0次
2023-11-29更新
|
246次组卷
|
2卷引用:山东省德州市夏津育中万隆中英文高级中学2023-2024学年高一上学期12月月考化学试题
解题方法
8 . 氧化铋( )俗称铋黄,广泛应用于医药合成、能源材料等领域。以铋精矿(主要成分
)俗称铋黄,广泛应用于医药合成、能源材料等领域。以铋精矿(主要成分 ,还含有
,还含有 、
、 、
、 、
、 等杂质)为原料制备
等杂质)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示:

已知:① 不溶于稀盐酸,酸浸后溶液中金属阳离子主要有
不溶于稀盐酸,酸浸后溶液中金属阳离子主要有 、
、 、
、 、
、 等;②
等;② 在
在 时开始水解,
时开始水解,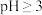 时
时 几乎完全水解为白色的BiOCl沉淀;
几乎完全水解为白色的BiOCl沉淀;
③常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
请根据以上信息,回答下列问题:
(1)“酸浸”步骤浸出渣的主要成分除S外还有___________ ,该步骤中发生的最主要的氧化还原反应的离子方程为___________ 。
(2)“转化”步骤中加入盐酸羟胺( )的目的是
)的目的是___________ 。
(3)“调pH”步骤中加入 调节溶液的pH,其合理范围为
调节溶液的pH,其合理范围为___________ ;滤液1中主要的金属阳离子有___________ (填离子符号)。
(4)流程中生成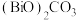 的化学方程式为
的化学方程式为___________ 。
(5)铋精矿中铋含量为79.42%,取铋精矿10kg,铋元素在整个流程中损失率为5%,经过上述流程可制得氧化铋的质量为___________ g(保留到小数点后一位)。
 )俗称铋黄,广泛应用于医药合成、能源材料等领域。以铋精矿(主要成分
)俗称铋黄,广泛应用于医药合成、能源材料等领域。以铋精矿(主要成分 ,还含有
,还含有 、
、 、
、 、
、 等杂质)为原料制备
等杂质)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示:
已知:①
 不溶于稀盐酸,酸浸后溶液中金属阳离子主要有
不溶于稀盐酸,酸浸后溶液中金属阳离子主要有 、
、 、
、 、
、 等;②
等;② 在
在 时开始水解,
时开始水解,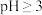 时
时 几乎完全水解为白色的BiOCl沉淀;
几乎完全水解为白色的BiOCl沉淀;③常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 金属离子 |  |  |  |
| 开始沉淀 | 2.7 | 7.6 | 4.7 |
| 完全沉淀 | 3.7 | 9.6 | 6.7 |
(1)“酸浸”步骤浸出渣的主要成分除S外还有
(2)“转化”步骤中加入盐酸羟胺(
 )的目的是
)的目的是(3)“调pH”步骤中加入
 调节溶液的pH,其合理范围为
调节溶液的pH,其合理范围为(4)流程中生成
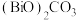 的化学方程式为
的化学方程式为(5)铋精矿中铋含量为79.42%,取铋精矿10kg,铋元素在整个流程中损失率为5%,经过上述流程可制得氧化铋的质量为
您最近一年使用:0次
名校
9 . 二氧化铈( ,相对分子质量为172)是一种重要的稀土化合物。提纯二氧化铈
,相对分子质量为172)是一种重要的稀土化合物。提纯二氧化铈 一种工艺流程如图所示:
一种工艺流程如图所示:

(1)稀土化合物 中
中 的化合价为
的化合价为___________ 。
(2)在反应①中 体现
体现___________ (填“氧化性”或“还原性”),写出稀硫酸、 与
与 反应的化学方程式
反应的化学方程式___________ 。
(3)由反应②可知氧化性:
___________  (填“>”或“<”或“=”),反应②中的氧化剂与还原剂的物质的量之比为
(填“>”或“<”或“=”),反应②中的氧化剂与还原剂的物质的量之比为___________ ,当消耗 转移电子的物质的量为
转移电子的物质的量为___________ mol。
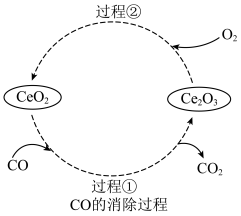
(4) 是汽车尾气净化催化剂中最重要的助剂,工作原理如图所示。写出过程①发生反应的化学方程式
是汽车尾气净化催化剂中最重要的助剂,工作原理如图所示。写出过程①发生反应的化学方程式___________ 。
(5)取上述流程中得到的精 产品
产品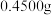 ,加硫酸溶解,经
,加硫酸溶解,经 标准溶液测定以后,产品中含
标准溶液测定以后,产品中含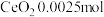 。该产品中
。该产品中 的质量分数为
的质量分数为___________ (保留一位小数)。
 ,相对分子质量为172)是一种重要的稀土化合物。提纯二氧化铈
,相对分子质量为172)是一种重要的稀土化合物。提纯二氧化铈 一种工艺流程如图所示:
一种工艺流程如图所示:
(1)稀土化合物
 中
中 的化合价为
的化合价为(2)在反应①中
 体现
体现 与
与 反应的化学方程式
反应的化学方程式(3)由反应②可知氧化性:

 (填“>”或“<”或“=”),反应②中的氧化剂与还原剂的物质的量之比为
(填“>”或“<”或“=”),反应②中的氧化剂与还原剂的物质的量之比为 转移电子的物质的量为
转移电子的物质的量为(4)
 是汽车尾气净化催化剂中最重要的助剂,工作原理如图所示。写出过程①发生反应的化学方程式
是汽车尾气净化催化剂中最重要的助剂,工作原理如图所示。写出过程①发生反应的化学方程式
(5)取上述流程中得到的精
 产品
产品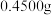 ,加硫酸溶解,经
,加硫酸溶解,经 标准溶液测定以后,产品中含
标准溶液测定以后,产品中含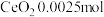 。该产品中
。该产品中 的质量分数为
的质量分数为
您最近一年使用:0次
2023-11-08更新
|
127次组卷
|
4卷引用:山东省德州市夏津育中万隆中英文高级中学2023-2024学年高一上学期12月月考化学试题
10 . 二苯甲烷(C6H5CH2C6H5)有定香能力,用于配制香水。在一定温度下,二苯甲烷可通过苯和氯化苄(C6H5CH2Cl)在 催化下合成。某化学兴趣小组对二苯甲烷的合成进行实验探究。已知:
催化下合成。某化学兴趣小组对二苯甲烷的合成进行实验探究。已知: 易水解和升华。
易水解和升华。
I.制备
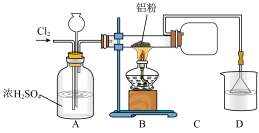
(1)利用上图装置制备 时进行操作:
时进行操作:
①……;
②向硬质玻璃管中加入Al粉;
③通入 ;
;
④加热。
操作①为___________ ,该装置存在一处明显的缺陷是___________ 。
(2)装置中A的作用为___________ 。
Ⅱ.合成二苯甲烷
步骤①:如图向三颈烧瓶中加入39.0mL苯(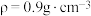 )、46.0mL氯化苄(
)、46.0mL氯化苄(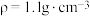 )和适量
)和适量 ,控制温度为80℃左右,回流2h;
,控制温度为80℃左右,回流2h;
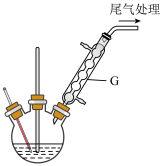
步骤②:待三颈烧瓶冷却后依次用水、稀碱液、水洗涤分液,再经操作a、操作b分离出二苯甲烷。
(3)仪器G的名称___________ 。操作a为___________ ,操作b为___________ 。
(4)选择合适的试剂设计实验,证明该反应的反应类型___________ 。
(5)若分离所得二苯甲烷的质量为50.4g,则其产率为___________ (保留两位有效数字)。
 催化下合成。某化学兴趣小组对二苯甲烷的合成进行实验探究。已知:
催化下合成。某化学兴趣小组对二苯甲烷的合成进行实验探究。已知: 易水解和升华。
易水解和升华。I.制备


(1)利用上图装置制备
 时进行操作:
时进行操作:①……;
②向硬质玻璃管中加入Al粉;
③通入
 ;
;④加热。
操作①为
(2)装置中A的作用为
Ⅱ.合成二苯甲烷
步骤①:如图向三颈烧瓶中加入39.0mL苯(
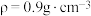 )、46.0mL氯化苄(
)、46.0mL氯化苄(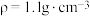 )和适量
)和适量 ,控制温度为80℃左右,回流2h;
,控制温度为80℃左右,回流2h;
步骤②:待三颈烧瓶冷却后依次用水、稀碱液、水洗涤分液,再经操作a、操作b分离出二苯甲烷。
(3)仪器G的名称
(4)选择合适的试剂设计实验,证明该反应的反应类型
(5)若分离所得二苯甲烷的质量为50.4g,则其产率为
您最近一年使用:0次