1 . 碘化亚铜(CuI)是一种难溶于水的白色固体,能被O2氧化。
(1)一种碘化亚铜薄膜透光性高、电阻率低,常用于LED等光电子器件中。其简要制备方法:真空中,在硅衬底镀一层铜膜,然后碘蒸汽与铜膜反应得碘化亚铜薄膜。
①在真空中镀铜膜目的是___________ 。
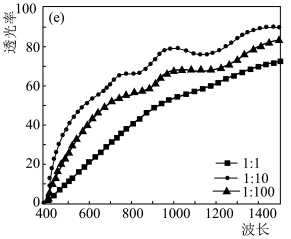
②实验测得不同铜碘比发生反应得到的CuI薄膜在不同波长下的透光率如图所示。合适的铜碘比为___________ 。___________ 。其他条件不变,溶液中铜元素的质量随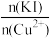 变化情况如图所示,当
变化情况如图所示,当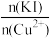 >2.2时,随着n(KI)/n(Cu2+)增大,铜元素的质量增大,其可能原因是
>2.2时,随着n(KI)/n(Cu2+)增大,铜元素的质量增大,其可能原因是___________ 。 溶液洗涤沉淀的目的是
溶液洗涤沉淀的目的是___________ 。
(3)硫酸铜为原料制备碘化亚铜。
补充完整制取碘化亚铜的实验方案:取25 mL 0.4mol·L−1 CuSO4溶液于三颈烧瓶中,___________ 。(实验中须使用的试剂和仪器有:SO2、I2、0.1 mol·L−1 NaOH、乙醇、真空干燥箱)。
(4)已知荧光强度比值与Cu2+浓度关系如图所示。取0.0001 g CuI粗产品,经预处理,将Cu元素全部转化为Cu2+并定容至1000.00 mL。取1.00 mL所配溶液,测得荧光强度比值为10.2,则产品中CuI的纯度为___________ (保留一位小数)。
(1)一种碘化亚铜薄膜透光性高、电阻率低,常用于LED等光电子器件中。其简要制备方法:真空中,在硅衬底镀一层铜膜,然后碘蒸汽与铜膜反应得碘化亚铜薄膜。
①在真空中镀铜膜目的是
②实验测得不同铜碘比发生反应得到的CuI薄膜在不同波长下的透光率如图所示。合适的铜碘比为

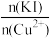 变化情况如图所示,当
变化情况如图所示,当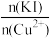 >2.2时,随着n(KI)/n(Cu2+)增大,铜元素的质量增大,其可能原因是
>2.2时,随着n(KI)/n(Cu2+)增大,铜元素的质量增大,其可能原因是
 溶液洗涤沉淀的目的是
溶液洗涤沉淀的目的是(3)硫酸铜为原料制备碘化亚铜。
补充完整制取碘化亚铜的实验方案:取25 mL 0.4mol·L−1 CuSO4溶液于三颈烧瓶中,
(4)已知荧光强度比值与Cu2+浓度关系如图所示。取0.0001 g CuI粗产品,经预处理,将Cu元素全部转化为Cu2+并定容至1000.00 mL。取1.00 mL所配溶液,测得荧光强度比值为10.2,则产品中CuI的纯度为

您最近一年使用:0次
名校
2 . 硫代硫酸钠被广泛用于纺织、造纸、化学合成等工业领域。制备硫代硫酸钠的装置如下图所示。
1.将浓硫酸缓缓注入仪器2中,适当调节螺旋夹6,使反应产生的气体均匀地进入锥形瓶中(硫化钠—碳酸钠溶液),并采用电磁搅拌器进行搅拌和加热。
2.持续通入气体,直至溶液的pH=7(注意不要小于7),停止通入气体。
3.将锥形瓶中的液体转移至烧杯中,________,过滤,得到 晶体样品。
晶体样品。
4.精确称取0.5000g步骤3的样品,用少量水溶解,再注入10mL醋酸-醋酸钠的缓冲溶液。以淀粉为指示剂,用0.1000mol/L的碘标准溶液滴定至终点,消耗标准溶液的体积为VmL。
已知:
请回答下列问题:
(1)仪器2的名称是________ 。
(2)写出生成硫代硫酸钠总反应的化学方程式________ 。
(3)补齐步骤3的实验操作________ 。
(4)用必要的文字说明为什么溶液的pH不能小于7________ 。
(5)①滴定时,应使用________ (填“酸式”或“碱式”)滴定管。
②滴定达到终点的标志是________ 。
③ 晶体的质量分数为
晶体的质量分数为________ (用含有V的代数式表示)。
④下列说法错误的是________ 。
a.滴定读数时,应单手持滴定管上端并保持其自然垂直
b.滴定实验中用到的玻璃仪器是烧杯、锥形瓶、滴定管
c.滴定前滴定管尖嘴处有气泡,导致实验结果偏低
d.用标准液润洗滴定管后,应将润洗液从滴定管上口倒出
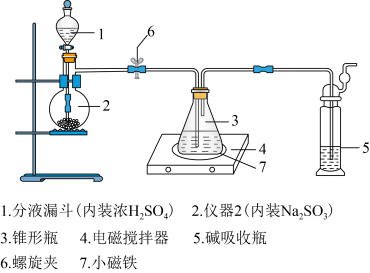
1.将浓硫酸缓缓注入仪器2中,适当调节螺旋夹6,使反应产生的气体均匀地进入锥形瓶中(硫化钠—碳酸钠溶液),并采用电磁搅拌器进行搅拌和加热。
2.持续通入气体,直至溶液的pH=7(注意不要小于7),停止通入气体。
3.将锥形瓶中的液体转移至烧杯中,________,过滤,得到
 晶体样品。
晶体样品。4.精确称取0.5000g步骤3的样品,用少量水溶解,再注入10mL醋酸-醋酸钠的缓冲溶液。以淀粉为指示剂,用0.1000mol/L的碘标准溶液滴定至终点,消耗标准溶液的体积为VmL。
已知:

请回答下列问题:
(1)仪器2的名称是
(2)写出生成硫代硫酸钠总反应的化学方程式
(3)补齐步骤3的实验操作
(4)用必要的文字说明为什么溶液的pH不能小于7
(5)①滴定时,应使用
②滴定达到终点的标志是
③
 晶体的质量分数为
晶体的质量分数为④下列说法错误的是
a.滴定读数时,应单手持滴定管上端并保持其自然垂直
b.滴定实验中用到的玻璃仪器是烧杯、锥形瓶、滴定管
c.滴定前滴定管尖嘴处有气泡,导致实验结果偏低
d.用标准液润洗滴定管后,应将润洗液从滴定管上口倒出
您最近一年使用:0次
昨日更新
|
121次组卷
|
2卷引用:辽宁省大连市2023-2024学年高三下学期第二次模拟考试化学试卷
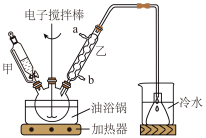
3 . 清凉茶酸乙酯(CH2CH=CHCH=CHCOOCH2CH3)是一种消毒杀菌剂,对细菌霉菌等有灭活作用。通过酯化反应制备清凉茶酸乙酯的方法如图,实验装置(部分夹持装置省略)如图所示。
Ⅱ.油浴加热,控制温度为110℃,并不断搅拌,一段时间之后停止加热和搅拌。
Ⅲ.反应混合物冷却至室温,进行操作X。
Ⅳ.在滤液中加入5%的小苏打溶液,洗涤,至混合液pH=7左右,再用蒸馏水洗涤。
V.将洗涤后混合液加入分液漏斗,进行分液。
Ⅵ.在分液后的有机层加入干燥剂,振荡,静置,过滤。
Ⅶ.对滤液进行蒸馏,收集一定温度的馏分,得到5.4mL纯净的清凉茶酸乙酯。
已知部分物质的性质如表:
(1)仪器甲的名称为______ 。
(2)写出实验中三颈烧瓶中发生的主要反应______ ,其中环己烷的作用是______ 。
(3)加热搅拌过程中忘加沸石,正确的操作是______ 。
(4)下列有关该实验过程,正确的是______ 。
(5)计算该制备实验的产率:______ (保留三位有效数字)。
Ⅱ.油浴加热,控制温度为110℃,并不断搅拌,一段时间之后停止加热和搅拌。
Ⅲ.反应混合物冷却至室温,进行操作X。
Ⅳ.在滤液中加入5%的小苏打溶液,洗涤,至混合液pH=7左右,再用蒸馏水洗涤。
V.将洗涤后混合液加入分液漏斗,进行分液。
Ⅵ.在分液后的有机层加入干燥剂,振荡,静置,过滤。
Ⅶ.对滤液进行蒸馏,收集一定温度的馏分,得到5.4mL纯净的清凉茶酸乙酯。
已知部分物质的性质如表:
| 沸点/℃ | 密度/(g•cm-3) | 水溶性 | 备注 | |
| 乙醇 | 78 | 0.789 | 混溶 | |
| 清凉茶酸 | 228 | 1.204 | 易溶 | |
| 清凉茶酸乙酯 | 195 | 0.926 | 难溶 | |
| 环己烷 | 80.7 | 0.780 | 难溶 | 挥发过程中可带出较多的水 |
(1)仪器甲的名称为
(2)写出实验中三颈烧瓶中发生的主要反应
(3)加热搅拌过程中忘加沸石,正确的操作是
(4)下列有关该实验过程,正确的是
| A.乙中的进水口为a |
| B.操作X使用的玻璃仪器有玻璃棒,漏斗,烧杯 |
| C.加入小苏打是为了中和混合物中的酸性物质 |
| D.分液后的有机层加入碱石灰干燥 |
(5)计算该制备实验的产率:
您最近一年使用:0次
解题方法
4 . 二氯化二硫(S2Cl2)常温下为黄色液体,能与苯、醚和四氯化碳等有机溶剂混溶,超过100°C 时分解为相应单质,300℃时完全分解,工业上常用作橡胶的低温硫化剂和黏接剂。实验室利用下列装置(部分加热、夹持仪器已略去)将干燥 Cl2通入 CS2 中于 98 ℃条件下制备S2Cl2:3Cl2+CS2=S2Cl2+CCl4
请回答下列问题:
Ⅰ.制备并提纯 S2Cl2
(1)仪器A 的名称是___________ ,装置甲中发生反应的离子方程式为___________ ,选择必需装置,按气流从左往右的方向,合理的连接顺序是___________ (填仪器接口字母)。
(2)该实验操作步骤如下,操作步骤先后顺序是③___________ (用序号表示)。
①打开仪器A 的活塞 ②关闭仪器A 的活塞 ③通入冷水 ④关闭冷水 ⑤用酒精灯加热装置丙 ⑥熄灭装置丙中酒精灯
(3)装置丙中,选择最适宜的加热方式是___________ (填“水浴”或“油浴”),实验结束后,将锥形瓶中液体转入到仪器①中,选择合适仪器并组装装置提纯S2Cl2 (加热及夹持装置略),安装顺序为①⑨⑧___________ (填序号)。
实验步骤如下:
①取mg市售 S2Cl2 (杂质不参与反应)溶于过量的V₁mL0.1mol⋅L-1NaOH溶液中,充分反应后过滤,将滤液配制成250 mL溶液;
②取出25.00 mL 于锥形瓶中,滴入几滴酚酞,用0.010 0 mol·L-1盐酸标准液滴定剩余的 NaOH,滴定至终点时记录数据,重复以上实验三次,平均使用盐酸V2mL。
(4)市售S2Cl2,纯度为___________ (用含 m、V1、V2的代数式表示)。
(5)下列操作导致测得市售 S2Cl2纯度偏大的是___________ (填字母)。
A.步骤①中,配制250 mL 溶液时,定容时俯视
B.锥形瓶用待测液润洗
C.滴定前,尖嘴无气泡,滴定结束后,尖嘴有气泡

| 物质 | 熔点/℃ | 沸点/℃ | 密度(g·cm-3) | 性质 |
| CS2 | -109 | 47 | 1.26 | 不溶于水 |
| S2Cl2 | -76 | 137 | 1.68 | 遇水生成HCl、SO2、S,和 HCl不反应 |
| S | 113 | 444 | 1.96 | 不溶于水 |
| CCl4 | -23 | 77 | 1.59 | 不溶于水 |
Ⅰ.制备并提纯 S2Cl2
(1)仪器A 的名称是
(2)该实验操作步骤如下,操作步骤先后顺序是③
①打开仪器A 的活塞 ②关闭仪器A 的活塞 ③通入冷水 ④关闭冷水 ⑤用酒精灯加热装置丙 ⑥熄灭装置丙中酒精灯
(3)装置丙中,选择最适宜的加热方式是

实验步骤如下:
①取mg市售 S2Cl2 (杂质不参与反应)溶于过量的V₁mL0.1mol⋅L-1NaOH溶液中,充分反应后过滤,将滤液配制成250 mL溶液;
②取出25.00 mL 于锥形瓶中,滴入几滴酚酞,用0.010 0 mol·L-1盐酸标准液滴定剩余的 NaOH,滴定至终点时记录数据,重复以上实验三次,平均使用盐酸V2mL。
(4)市售S2Cl2,纯度为
(5)下列操作导致测得市售 S2Cl2纯度偏大的是
A.步骤①中,配制250 mL 溶液时,定容时俯视
B.锥形瓶用待测液润洗
C.滴定前,尖嘴无气泡,滴定结束后,尖嘴有气泡
您最近一年使用:0次
5 . 稀土元素Sc被称为“工业调料”,可使掺杂它的材料性能成倍提升。从赤泥中提取高纯度 和其它工业产品的流程如图。
和其它工业产品的流程如图。
①赤泥为氧化铝生产中的暗红色固体废物,主要含 、
、 、
、 、
、 、
、 等,其中Sc元素含量测定为45
等,其中Sc元素含量测定为45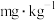 。
。
②Sc单质及其化合物的性质与铝相似。 易形成八面体的配离子。
易形成八面体的配离子。
③Ti元素在整个流程中化合价不变。
④“埃林汉姆图”可表示反应自由能变(△G)与温度的关系,其运算规则与反应焓变相似。_______ 。
(2)“还原焙烧”(温度为1100℃)的反应方程式为_______ 。
(3)温度较高时,Sc浸出率下降的原因是_______ 。
(4)“萃取”前加入维生素C的目的是_______ ,可以使用NaOH溶液进行反萃取的原因为钪离子生成了_______ 。“沉淀2”发生反应的离子方程式为_______ 。
(5)钪的络盐 (
( )在110℃会损失约38.2%的质量,此时其化学式为
)在110℃会损失约38.2%的质量,此时其化学式为_______ ,在238℃~625℃充分煅烧后生成固体质量为原质量的28.8%,该固体化学式为_______ 。
 和其它工业产品的流程如图。
和其它工业产品的流程如图。
①赤泥为氧化铝生产中的暗红色固体废物,主要含
 、
、 、
、 、
、 、
、 等,其中Sc元素含量测定为45
等,其中Sc元素含量测定为45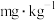 。
。②Sc单质及其化合物的性质与铝相似。
 易形成八面体的配离子。
易形成八面体的配离子。③Ti元素在整个流程中化合价不变。
④“埃林汉姆图”可表示反应自由能变(△G)与温度的关系,其运算规则与反应焓变相似。

(2)“还原焙烧”(温度为1100℃)的反应方程式为
(3)温度较高时,Sc浸出率下降的原因是
(4)“萃取”前加入维生素C的目的是
(5)钪的络盐
 (
( )在110℃会损失约38.2%的质量,此时其化学式为
)在110℃会损失约38.2%的质量,此时其化学式为
您最近一年使用:0次
6 . 硫酸铜是中学常见的化学物质,其结晶水合物胆矾受热失水的热重曲线如图,下列说法不正确的是

| A.浓硫酸使胆矾变白体现了浓硫酸的脱水性 | B.胆矾中含有3种不同化学环境的水分子 |
| C.硫酸铜可用于检验乙醇中是否含有水 | D.胆矾显蓝色是因为含有 |
您最近一年使用:0次
7 . 锂和铍是重要的稀有金属,被国内外视为战略性资源。一种从尾矿(主要含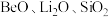 及
及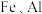 元素)中回收锂、铍、铝的工艺流程如图:
元素)中回收锂、铍、铝的工艺流程如图:
(1)“浸渣”中主要成分的晶体类型为_____ 。
(2)“沉铁”中生成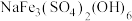 沉淀,其中
沉淀,其中 元素的化合价为
元素的化合价为_____ ,该反应的离子方程式为_____ 。
(3)“萃取”时,以 为萃取剂、
为萃取剂、 为协萃剂,溶液中的
为协萃剂,溶液中的 可与
可与 结合成
结合成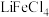 而被
而被 萃取。“反萃取”时,加入浓盐酸,发生
萃取。“反萃取”时,加入浓盐酸,发生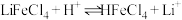 。
。
①“萃取”时还需要加入 ,其作用是
,其作用是_____ 。
②取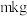 尾矿(其中
尾矿(其中 的质量分数为
的质量分数为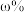 ),“反萃取”后所得
),“反萃取”后所得 水相中
水相中 ,则该过程
,则该过程 的回收率为
的回收率为_____ (用含相关物理量字母的代数式表示)。
(4)实验室提纯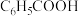 的方法是
的方法是_____ 。
(5)为了得到较高的空间利用率,离子晶体中的阴离子(通常半径较大)会尽可能紧密堆积,阳离子(通常半径较小)填入阴离子形成的空隙中,这种模型称为离子晶体的“堆积-填隙模型”。
已知常见的 型离子晶体的离子半径比和配位数的关系如下表:
型离子晶体的离子半径比和配位数的关系如下表:
表中离子半径比的临界值是由“堆积—填隙模型”中阴阳离子的几何关系确定的,例如配位数为8时,阳离子进入阴离子形成的正方体空隙,正方体8个顶点处的阴离了相切,空隙处(正方体体心)的阳离子与8个阴离子也相切,此时可由相关几何关系求得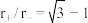 。
。
①
_____ 。
② 晶胞为立方
晶胞为立方 型,而
型,而 等的晶胞为
等的晶胞为 型。请结合上表,解释出现此结果的原因:
型。请结合上表,解释出现此结果的原因:_____ 。
 及
及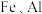 元素)中回收锂、铍、铝的工艺流程如图:
元素)中回收锂、铍、铝的工艺流程如图: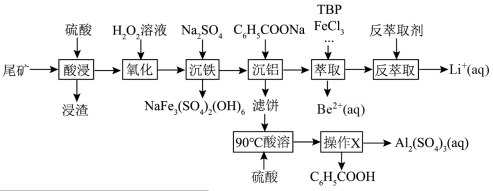
(1)“浸渣”中主要成分的晶体类型为
(2)“沉铁”中生成
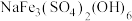 沉淀,其中
沉淀,其中 元素的化合价为
元素的化合价为(3)“萃取”时,以
 为萃取剂、
为萃取剂、 为协萃剂,溶液中的
为协萃剂,溶液中的 可与
可与 结合成
结合成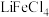 而被
而被 萃取。“反萃取”时,加入浓盐酸,发生
萃取。“反萃取”时,加入浓盐酸,发生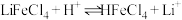 。
。①“萃取”时还需要加入
 ,其作用是
,其作用是②取
 尾矿(其中
尾矿(其中 的质量分数为
的质量分数为 ),“反萃取”后所得
),“反萃取”后所得 水相中
水相中 ,则该过程
,则该过程 的回收率为
的回收率为(4)实验室提纯
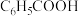 的方法是
的方法是(5)为了得到较高的空间利用率,离子晶体中的阴离子(通常半径较大)会尽可能紧密堆积,阳离子(通常半径较小)填入阴离子形成的空隙中,这种模型称为离子晶体的“堆积-填隙模型”。
已知常见的
 型离子晶体的离子半径比和配位数的关系如下表:
型离子晶体的离子半径比和配位数的关系如下表: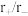 | 配位数 | 晶胞类型 |
 | 4 | 立方 |
 | 6 |  |
 | 8 |  |
 。
。①

②
 晶胞为立方
晶胞为立方 型,而
型,而 等的晶胞为
等的晶胞为 型。请结合上表,解释出现此结果的原因:
型。请结合上表,解释出现此结果的原因:
您最近一年使用:0次
7日内更新
|
97次组卷
|
2卷引用:重庆市第八中学校2024届高三下学期高考适应性月考(七)化学试题
8 . 实验室以柠檬酸亚铁、柠檬酸铵等为原料可制得柠檬酸铁铵。已知:柠檬酸结构简式为 ,是易溶于水的晶体,可用
,是易溶于水的晶体,可用 表示;柠檬酸可与
表示;柠檬酸可与 反应制柠檬酸亚铁。
反应制柠檬酸亚铁。
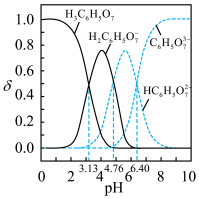
 ,测定其组成的实验方案如下:取适量样品溶于蒸馏水配成100mL溶液。取20.00mL溶液加入足量NaOH溶液充分反应,过滤、洗涤,灼烧至恒重,测得固体质量为0.32g。取20.00mL溶液于锥形瓶中,依次加入足量EDTA(能与部分金属离子结合)、HCHO溶液充分反应,滴入2滴酚酞试液,用1.00
,测定其组成的实验方案如下:取适量样品溶于蒸馏水配成100mL溶液。取20.00mL溶液加入足量NaOH溶液充分反应,过滤、洗涤,灼烧至恒重,测得固体质量为0.32g。取20.00mL溶液于锥形瓶中,依次加入足量EDTA(能与部分金属离子结合)、HCHO溶液充分反应,滴入2滴酚酞试液,用1.00 NaOH标准液滴定至终点,消耗标准液12.00mL。[
NaOH标准液滴定至终点,消耗标准液12.00mL。[ ;
;
 ]。加入EDTA的作用为
]。加入EDTA的作用为(3)避光条件下,柠檬酸铁铵与铁氰化钾[
 ]反应得到普鲁士黄(PY),其立方晶胞结构如图所示。
]反应得到普鲁士黄(PY),其立方晶胞结构如图所示。
 均与
均与 形成配位键。结合电子式解释
形成配位键。结合电子式解释 作配体的原因:
作配体的原因:②普鲁士蓝(PB)晶胞结构如图所示, 周围最近且等距的
周围最近且等距的 有12个,“○”位置被
有12个,“○”位置被 或
或 占据,用“
占据,用“ ”在图上补全PB结构图中Ⅰ和Ⅱ两个小立方体中的
”在图上补全PB结构图中Ⅰ和Ⅱ两个小立方体中的 。
。
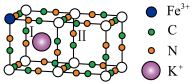
 能容易地嵌入和脱嵌,因此PB可作为钾离子电池的正极材料。充电过程中,推测
能容易地嵌入和脱嵌,因此PB可作为钾离子电池的正极材料。充电过程中,推测 会从PB中脱嵌出来,理由是
会从PB中脱嵌出来,理由是(4)补充完整由铁泥(主要含有单质铁、少量
 和铁的氧化物)制备
和铁的氧化物)制备 的实验方案,部分装置如图所示:取一定量的铁泥,
的实验方案,部分装置如图所示:取一定量的铁泥, 。(须使用试剂:
。(须使用试剂: 、
、 溶液、稀硫酸)
溶液、稀硫酸)
您最近一年使用:0次
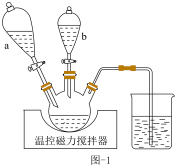
9 . 氯化亚铜(CuCl)是一种白色固体,难溶于乙醇,微溶于水,易水解,在空气中易被氧化。实验室利用NaCl粉末、CuSO4溶液、Na2SO3溶液反应制取CuCl晶体,相关装置如图-1所示。___________ 。
②转化过程中还可能发生反应Cu(OH)2(s)+2HSO +Cu2+=2CuSO3(s)+2H2O,其平衡常数K与Ksp[Cu(OH)2]、Ksp(CuSO3)、Ka2(H2SO3)的代数关系式K=
+Cu2+=2CuSO3(s)+2H2O,其平衡常数K与Ksp[Cu(OH)2]、Ksp(CuSO3)、Ka2(H2SO3)的代数关系式K=___________ 。
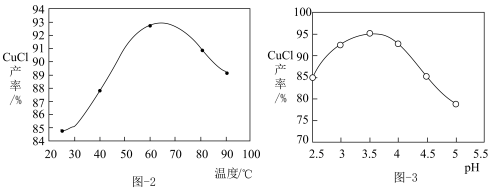
(2)反应温度、还原完成时溶液pH对CuCl产率的影响如图-2、图-3所示。___________ 。
②补充完整以图-1装置制备CuCl晶体实验方案:将2.34gNaCl粉末加入三颈烧瓶中,___________ ,真空抽滤,用2% HCl溶液洗涤后,再用无水乙醇洗涤,真空干燥。
实验中须使用的试剂:25mL 1.0mol·L–1CuSO4溶液、Na2SO3溶液、20% NaOH溶液
(3)测定CuCl样品的纯度。准确称取0.2500g CuCl样品,溶解于H2O2和H2SO4的混合溶液,加热溶液,待没有气体逸出、冷却后转移至碘量瓶中,加过量KI溶液,用0.1000 mol∙L−1 Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液25.00mL。测定过程中发生下列反应:2Cu2++4I-=2CuI↓+I2、2S2O +I2=S4O
+I2=S4O +2I-。计算CuCl样品的纯度为
+2I-。计算CuCl样品的纯度为___________ (写出计算过程)。
②转化过程中还可能发生反应Cu(OH)2(s)+2HSO
 +Cu2+=2CuSO3(s)+2H2O,其平衡常数K与Ksp[Cu(OH)2]、Ksp(CuSO3)、Ka2(H2SO3)的代数关系式K=
+Cu2+=2CuSO3(s)+2H2O,其平衡常数K与Ksp[Cu(OH)2]、Ksp(CuSO3)、Ka2(H2SO3)的代数关系式K=(2)反应温度、还原完成时溶液pH对CuCl产率的影响如图-2、图-3所示。
②补充完整以图-1装置制备CuCl晶体实验方案:将2.34gNaCl粉末加入三颈烧瓶中,
实验中须使用的试剂:25mL 1.0mol·L–1CuSO4溶液、Na2SO3溶液、20% NaOH溶液
(3)测定CuCl样品的纯度。准确称取0.2500g CuCl样品,溶解于H2O2和H2SO4的混合溶液,加热溶液,待没有气体逸出、冷却后转移至碘量瓶中,加过量KI溶液,用0.1000 mol∙L−1 Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液25.00mL。测定过程中发生下列反应:2Cu2++4I-=2CuI↓+I2、2S2O
 +I2=S4O
+I2=S4O +2I-。计算CuCl样品的纯度为
+2I-。计算CuCl样品的纯度为
您最近一年使用:0次
10 . 黄铜(Cu-Zn合金),外观酷似黄金,中国古代称为“俞石”或“俞铜”,我国陕西出土距今6700年的黄铜碎片和断管,被誉为“中国献给世界的化学礼物”。
1.下列方法都能区分黄铜和黄金,其中利用了化学变化的是___________。
2.试从金属活动性角度分析,青铜(Cu-Sn合金)的大规模使用早于黄铜(Cu-Zn合金)的原因可能是___________ 。
实验室“碘量法测定黄铜中铜含量”的实验原理如下:
将一定质量的黄铜样品溶解后,配成一定体积的待测液,加入过量的KI溶液,发生反应①:2Cu2++4I- =2CuI↓+I2,用Na2S2O3标准溶液滴定单质I2,发生反应②:I2+2S2O =2I-+S4O
=2I-+S4O ,最终求出黄铜中铜的含量。(已知:Zn2+不干扰测定)
,最终求出黄铜中铜的含量。(已知:Zn2+不干扰测定)
3.该实验所需的定量仪器有___________ (任写1种)。根据反应计量关系,确定合金中每含1 g Cu 最终消耗c mol·L-1的Na2S2O3标准溶液___________ mL。(用含c的代数式表示)
4.实验中使用HCl-H2O2溶解黄铜样品,H2O2被称为“绿色氧化剂”的原因是___________ ;溶解结束后需加热煮沸,使过量H2O2尽快分解,否则可能使实验结果偏大,因为___________ 。
1.下列方法都能区分黄铜和黄金,其中利用了化学变化的是___________。
| A.焰色反应 | B.硬度测定 | C.稀酸溶解 | D.高温灼烧 |
实验室“碘量法测定黄铜中铜含量”的实验原理如下:
将一定质量的黄铜样品溶解后,配成一定体积的待测液,加入过量的KI溶液,发生反应①:2Cu2++4I- =2CuI↓+I2,用Na2S2O3标准溶液滴定单质I2,发生反应②:I2+2S2O
 =2I-+S4O
=2I-+S4O ,最终求出黄铜中铜的含量。(已知:Zn2+不干扰测定)
,最终求出黄铜中铜的含量。(已知:Zn2+不干扰测定)3.该实验所需的定量仪器有
4.实验中使用HCl-H2O2溶解黄铜样品,H2O2被称为“绿色氧化剂”的原因是
您最近一年使用:0次



