1 . 高温超导材料的研究是21世纪材料领域的热点问题,YBaCuO体系一直是此领域的研究重点之一。将钇(Y)、钡、铜的氧化物按一定的物质的量之比混合(Y为ⅢB族元素),再经高温煅烧可得到复合氧化物YBa2Cu3O6.5+δ,实验证明:该物质具有超导性能,其零电阻温度可达90K,化学式中的δ大小与超导性能密切相关。有一种观点认为δ的产生源于体系中产生了Cu3+。
(1)经测定δ一般不大于0.50,按此推算,Cu3+ 占物质中总铜量的质量分数最大为_______ 。
(2)已知可用间接碘量法测出体系中Cu3+ 的质量分数,该法涉及的化学反应有:4Cu3++2H2O=4Cu2++O2+4H+,2Cu2++4I-=Cu2I2+I2,2S2O +I2=S4O
+I2=S4O +2I-等。现有两份质量都为m的该氧化物,其中一份加过量的KI固体,溶解后用浓度为0.1568mol/L的Na2S2O3 滴定至终点,消耗Na2S2O3 的体积为30.26mL,另一份先完全溶解,再加和第一份等量的KI固体,用同样浓度的Na2S2O3 滴定至终点,消耗的体积为23.89mL,该氧化物中Cu3+ 的质量分数为
+2I-等。现有两份质量都为m的该氧化物,其中一份加过量的KI固体,溶解后用浓度为0.1568mol/L的Na2S2O3 滴定至终点,消耗Na2S2O3 的体积为30.26mL,另一份先完全溶解,再加和第一份等量的KI固体,用同样浓度的Na2S2O3 滴定至终点,消耗的体积为23.89mL,该氧化物中Cu3+ 的质量分数为_______ ,m值为_______ 。
(1)经测定δ一般不大于0.50,按此推算,Cu3+ 占物质中总铜量的质量分数最大为
(2)已知可用间接碘量法测出体系中Cu3+ 的质量分数,该法涉及的化学反应有:4Cu3++2H2O=4Cu2++O2+4H+,2Cu2++4I-=Cu2I2+I2,2S2O
 +I2=S4O
+I2=S4O +2I-等。现有两份质量都为m的该氧化物,其中一份加过量的KI固体,溶解后用浓度为0.1568mol/L的Na2S2O3 滴定至终点,消耗Na2S2O3 的体积为30.26mL,另一份先完全溶解,再加和第一份等量的KI固体,用同样浓度的Na2S2O3 滴定至终点,消耗的体积为23.89mL,该氧化物中Cu3+ 的质量分数为
+2I-等。现有两份质量都为m的该氧化物,其中一份加过量的KI固体,溶解后用浓度为0.1568mol/L的Na2S2O3 滴定至终点,消耗Na2S2O3 的体积为30.26mL,另一份先完全溶解,再加和第一份等量的KI固体,用同样浓度的Na2S2O3 滴定至终点,消耗的体积为23.89mL,该氧化物中Cu3+ 的质量分数为
您最近一年使用:0次
解题方法
2 . 已知: 今有一白色固体,可能是由Al2(SO4)3、AgNO3、BaCl2、NH4Cl、KOH、Na2S中的2种或3种组成,为确定该白色固体组成,进行以下实验:取白色固体少许,加入适量蒸馏水充分振荡,得到无色溶液;取无色溶液少许,滴加稀硝酸,有白色沉淀生成。
今有一白色固体,可能是由Al2(SO4)3、AgNO3、BaCl2、NH4Cl、KOH、Na2S中的2种或3种组成,为确定该白色固体组成,进行以下实验:取白色固体少许,加入适量蒸馏水充分振荡,得到无色溶液;取无色溶液少许,滴加稀硝酸,有白色沉淀生成。
(1)此白色固体必须含有的物质是①第一组_______ ;②第二组_______ 。
(2)若要确定白色固体的组成,还需做的实验_______
 今有一白色固体,可能是由Al2(SO4)3、AgNO3、BaCl2、NH4Cl、KOH、Na2S中的2种或3种组成,为确定该白色固体组成,进行以下实验:取白色固体少许,加入适量蒸馏水充分振荡,得到无色溶液;取无色溶液少许,滴加稀硝酸,有白色沉淀生成。
今有一白色固体,可能是由Al2(SO4)3、AgNO3、BaCl2、NH4Cl、KOH、Na2S中的2种或3种组成,为确定该白色固体组成,进行以下实验:取白色固体少许,加入适量蒸馏水充分振荡,得到无色溶液;取无色溶液少许,滴加稀硝酸,有白色沉淀生成。(1)此白色固体必须含有的物质是①第一组
(2)若要确定白色固体的组成,还需做的实验
您最近一年使用:0次
3 . 今有碱金属的两种碳酸盐和碱土金属(镁、钙等二价金属)的一种不溶性碳酸盐(碱式盐)组成的混合物。取7.560g该混合物与过量盐酸完全反应,放出CO2体积为1.344L(标准状况)。另取等质量的原混合物加水搅拌,可虑出不溶性盐1.420g
(1)过滤后1/10体积的滤液,向其中缓慢滴加浓度为0.2500mol/L的盐酸,并同时记录放出的CO2的体积(标准状况)和消耗盐酸的体积,得到如图所示的曲线。

写出向滤液中缓慢滴加盐酸的有关化学方程式(写离子方程式不给分):_______ 、_______ 。
(2)将滤出的不溶性盐(420g)投入到浓度为2.500mol/L盐酸中,当反应完全时,耗去16.00mL盐酸。写出原不溶性碳酸盐与盐酸反应的离子方程式:_______ 。
(1)过滤后1/10体积的滤液,向其中缓慢滴加浓度为0.2500mol/L的盐酸,并同时记录放出的CO2的体积(标准状况)和消耗盐酸的体积,得到如图所示的曲线。

写出向滤液中缓慢滴加盐酸的有关化学方程式(写离子方程式不给分):
(2)将滤出的不溶性盐(420g)投入到浓度为2.500mol/L盐酸中,当反应完全时,耗去16.00mL盐酸。写出原不溶性碳酸盐与盐酸反应的离子方程式:
您最近一年使用:0次
解题方法
4 . 某厂以工业粗盐(含Ca2+、 Mg2+、SO 等杂质)为主要原料采用“侯氏制碱法”生产纯碱和化肥NH4Cl,其工艺流程如下图所示:
等杂质)为主要原料采用“侯氏制碱法”生产纯碱和化肥NH4Cl,其工艺流程如下图所示:
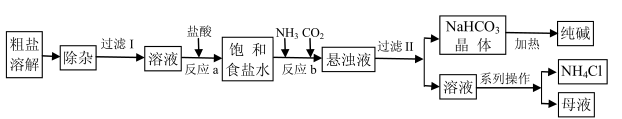
请回答下列问题:
(1)“除杂”步骤中需加入两种试剂,按加入顺序写出其名称____________ 。
(2)写出“反应a”的离子方程式___________ ;写出“反应b”的化学方程式___________ 。
(3)“过滤II”所得“溶液”中除NH 和Cl-外,还存在的阳离子有
和Cl-外,还存在的阳离子有___________ ,阴离子有___________ ;对该溶液进行的“系列操作”包括___________ 。
(4)上述工艺流程中可循环利用的物质有___________ 。
(5)工业纯碱的等级标准如下表所示:
称取某纯碱样品10.00g, 加入适量水溶解,再加入过量CaCl2溶液,充分反应后过滤、洗涤沉淀、干燥,称得沉淀质量为9.33g。请通过计算判断该纯碱样品的等级___________ 。
 等杂质)为主要原料采用“侯氏制碱法”生产纯碱和化肥NH4Cl,其工艺流程如下图所示:
等杂质)为主要原料采用“侯氏制碱法”生产纯碱和化肥NH4Cl,其工艺流程如下图所示:
请回答下列问题:
(1)“除杂”步骤中需加入两种试剂,按加入顺序写出其名称
(2)写出“反应a”的离子方程式
(3)“过滤II”所得“溶液”中除NH
 和Cl-外,还存在的阳离子有
和Cl-外,还存在的阳离子有(4)上述工艺流程中可循环利用的物质有
(5)工业纯碱的等级标准如下表所示:
| 等级 | 优等品 | 一等品 | 合格品 |
| Na2CO3含量1% | ≥99.2 | ≥98.8 | ≥98.0 |
称取某纯碱样品10.00g, 加入适量水溶解,再加入过量CaCl2溶液,充分反应后过滤、洗涤沉淀、干燥,称得沉淀质量为9.33g。请通过计算判断该纯碱样品的等级
您最近一年使用:0次
解题方法
5 . 某工厂混合物浆液中含Na2CrO4和少量Al(OH)3、MnO2,考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用电解分离装置(如下图)使浆液分离成固体混合物和含铬元素的溶液,并在工业生产中对它们进行广泛应用。

I.固体混合物的分离和利用(部分操作和反应条件未标明)。

(1)向溶液A中通过量的CO2生成B的离子方程式为_______ 。
(2)工业中可以利用碳酸钠溶液吸收反应②中产生的氯气,写出含1molNa2CO3的溶液恰好吸收1molCl2的离子方程式_______ 。(已知常温下H2CO3Ka1=4.30×10-7,Ka2=5.61×10-11;HClOKa=2.98×10-8)
II.含铬元素溶液的分离和利用。
(3)用惰性电极电解时,电解池阳极区的溶液中含铬的粒子有 、
、 ,其中含有
,其中含有 的原因是:
的原因是:_______ 。(结合离子方程式及文字叙述说明原因)
(4)利用电解后的溶液制备重铬酸钠晶体(Na2Cr2O7·2H2O)的流程如下。

已知:重铬酸钠晶体(Na2Cr2O7·2H2O)俗称红矾钠,桔红色晶体,略有吸湿性,易溶于水,不溶于乙醇;Na2Cr2O7·2H2O的式量为298。
①流程中分离操作包括_______ 、洗涤、干燥,其中洗涤时最好选用_______ (填试剂名称)。
②准确称取上述流程中的产品3.1700g配成250mL溶液,取出25.00mL放于锥形瓶中,加入10mL2mol·L-1H2SO4溶液和足量碘化钾溶液,放于暗处5min;然后加入100mL水和2—3滴淀粉指示剂;最后根据I2+2 =2I-+
=2I-+ 用0.1000mol·L-1Na2S2O3标准溶液滴定,判断达到滴定终点的依据是:
用0.1000mol·L-1Na2S2O3标准溶液滴定,判断达到滴定终点的依据是:_______ 。若实验中平均用去Na2S2O3标准溶液60.00mL,则所得产品中的重铬酸钠晶体的纯度为_______ 。

I.固体混合物的分离和利用(部分操作和反应条件未标明)。

(1)向溶液A中通过量的CO2生成B的离子方程式为
(2)工业中可以利用碳酸钠溶液吸收反应②中产生的氯气,写出含1molNa2CO3的溶液恰好吸收1molCl2的离子方程式
II.含铬元素溶液的分离和利用。
(3)用惰性电极电解时,电解池阳极区的溶液中含铬的粒子有
 、
、 ,其中含有
,其中含有 的原因是:
的原因是:(4)利用电解后的溶液制备重铬酸钠晶体(Na2Cr2O7·2H2O)的流程如下。

已知:重铬酸钠晶体(Na2Cr2O7·2H2O)俗称红矾钠,桔红色晶体,略有吸湿性,易溶于水,不溶于乙醇;Na2Cr2O7·2H2O的式量为298。
①流程中分离操作包括
②准确称取上述流程中的产品3.1700g配成250mL溶液,取出25.00mL放于锥形瓶中,加入10mL2mol·L-1H2SO4溶液和足量碘化钾溶液,放于暗处5min;然后加入100mL水和2—3滴淀粉指示剂;最后根据I2+2
 =2I-+
=2I-+ 用0.1000mol·L-1Na2S2O3标准溶液滴定,判断达到滴定终点的依据是:
用0.1000mol·L-1Na2S2O3标准溶液滴定,判断达到滴定终点的依据是:
您最近一年使用:0次
2021-08-04更新
|
254次组卷
|
2卷引用:黑龙江省大庆市2020届高三第一次质量检测化学试题
6 . 一氯乙酸易溶于水,可溶于苯、氯仿和乙醇,可作为水果汁的防腐剂。在测定某品牌水果汁中一氯乙酸添加量时,取V0mL水果汁试样,加酸酸化,加入乙醚将ClCH2COOH萃取到有机层中,弃去水相并在有机相中加入试剂X进行反萃取,分液后,在含ClCH2COOH的相中加入试剂Y,再加入V1mLc1mol·L-1的AgNO3溶液、硫酸铁铵指示液,用c2mol·L-1的NH4SCN标准溶液滴定至终点,消耗V2mL。请回答下列问题:
(1)选择萃取剂的主要原则是_______ 。本实验萃取操作过程中,若静置时发现形成了乳浊液,除耐心等待外,还应如何处理_______ 。
(2)X和Y分别是_______ 、_______ 。
(3)本实验测定一氯乙酸时采用了_______ 滴定法。写出整个过程中发生反应的离子方程式_______ 。
(4)仅根据以上实验能计算该水果汁样品中一氯乙酸的添加量(以mg·mL-1表示)吗?若认为可以,请列出计算表达式:若认为不可以,请补充实验,然后列出计算表达式_______ 。(相对原子质量:H1.01 C12.01 O16.00 Cl35.45)
(1)选择萃取剂的主要原则是
(2)X和Y分别是
(3)本实验测定一氯乙酸时采用了
(4)仅根据以上实验能计算该水果汁样品中一氯乙酸的添加量(以mg·mL-1表示)吗?若认为可以,请列出计算表达式:若认为不可以,请补充实验,然后列出计算表达式
您最近一年使用:0次
7 . 为确定Fex(C2O4)y·zH2O的化学式,可用KMnO4标准溶液进行滴定及热重分析。实验步骤如下:
(I)KMnO4标准溶液的配制与标定。称取稍多于所需量的KMnO4固体并溶于水,将溶液加热并保持微沸约1h,用微孔玻.璃漏斗过滤,将滤液贮存于棕色试剂瓶中,置于暗处。用基准物质Na2C2O4在70-80°C下进行标定。
(II)Fex(C2O4)y·zH2O的化学式确定
(i)滴定分析:准确称取m0=0.1500g Fex(C2O4)y·zH2O样品,溶于15mL3mol·L-1H2SO4,70~80°C水浴加热,用c1=0.02000mol·L-1KMnO4标准溶液滴定至终点,消耗体积V1=25.02.mL。在该滴定液中加入2g锌粉和3mL3mol·L-1H2SO4(若锌粉与硫酸不足,可补加,亦可加热)。几分钟后,取1滴溶液在试管中,用KSCN溶液检验。若不显浅红色,则用砂芯漏斗过滤除去过量锌粉。用10mL稀硫酸洗涤,合并洗涤液和滤液,用c2=0.01000mol·L-1KMnO4标准溶液滴定至终点,消耗体积V2=16.68mL。
(ii)热重分析:称取20.00mgFex(C2O4)y·zH2O样品,用热重法对其进行热分解,得到剩余固体的质量m随温度T变化的曲线如图所示:

请回答下列问题:
(1)配制KMnO4标准溶液时,称取KMnO4固体时为什么要稍多于所需量_______ ?为什么要保持微沸约1h_______ 。
(2)标定KMnO4溶液时,为什么不能用普通漏斗过滤_______ ?所得滤渣是_______ 。
(3)滴定时,若c2=c1=0.02000mol·L-1,是否可以_______ ,原因是_______ 。
(4)计算Fex(C2O4)y·zH2O样品中Fe、C2O 及H2O的质量分数,并确定其化学式
及H2O的质量分数,并确定其化学式_______ 。
(5)确定热重曲线中最后剩余固体的化学式,写出图中b段发生反应的化学方程式_______ 。
(I)KMnO4标准溶液的配制与标定。称取稍多于所需量的KMnO4固体并溶于水,将溶液加热并保持微沸约1h,用微孔玻.璃漏斗过滤,将滤液贮存于棕色试剂瓶中,置于暗处。用基准物质Na2C2O4在70-80°C下进行标定。
(II)Fex(C2O4)y·zH2O的化学式确定
(i)滴定分析:准确称取m0=0.1500g Fex(C2O4)y·zH2O样品,溶于15mL3mol·L-1H2SO4,70~80°C水浴加热,用c1=0.02000mol·L-1KMnO4标准溶液滴定至终点,消耗体积V1=25.02.mL。在该滴定液中加入2g锌粉和3mL3mol·L-1H2SO4(若锌粉与硫酸不足,可补加,亦可加热)。几分钟后,取1滴溶液在试管中,用KSCN溶液检验。若不显浅红色,则用砂芯漏斗过滤除去过量锌粉。用10mL稀硫酸洗涤,合并洗涤液和滤液,用c2=0.01000mol·L-1KMnO4标准溶液滴定至终点,消耗体积V2=16.68mL。
(ii)热重分析:称取20.00mgFex(C2O4)y·zH2O样品,用热重法对其进行热分解,得到剩余固体的质量m随温度T变化的曲线如图所示:

请回答下列问题:
(1)配制KMnO4标准溶液时,称取KMnO4固体时为什么要稍多于所需量
(2)标定KMnO4溶液时,为什么不能用普通漏斗过滤
(3)滴定时,若c2=c1=0.02000mol·L-1,是否可以
(4)计算Fex(C2O4)y·zH2O样品中Fe、C2O
 及H2O的质量分数,并确定其化学式
及H2O的质量分数,并确定其化学式(5)确定热重曲线中最后剩余固体的化学式,写出图中b段发生反应的化学方程式
您最近一年使用:0次
8 . 有一固体混合物,可能含FeCl3、NaNO2、Ca(OH)2、AgNO3、CuCl2、NaF、NH4Cl等七种物质中的若干种。将此混合物加水后,得到白色沉淀和无色溶液,白色沉淀可溶于氨水;将无色溶液分成三份,第1份中加入KSCN溶液,无明显现象;第2份酸化后,可使KMnO4溶液褪色;第3份加热,有气体放出。已知AgNO2与AgCl的Ksp分别为6.0×10-4、1.56×10-10。根据上述现象可得到的结论是
| A.固体混合物中一定存在四种物质 |
| B.固体混合物中一定存在AgNO3和NaNO2 |
| C.固体混合物中可能存在NH4Cl和NaF |
| D.固体混合物中-定不存在Ca(OH)2和FeCl3 |
您最近一年使用:0次
名校
解题方法
9 . 用A g混有氧化钠的过氧化钠固体混合物制氧气并测定其中过氧化钠的纯度(可供选择的反应物还有:蒸馏水)。试回答下列问题:
(1)分别写出氧化钠、过氧化钠与水反应的化学方程式:;___________ 。
(2)制取氧气时,混合物中的氧化钠固体有无必要除去?___________ (填“有”或“没有”),理由是___________ 。
(3)利用如图装置测定混合物中过氧化钠的纯度时,首先要进行的操作是___________ 。

(4)以下是测量收集到的气体体积所必须包括的三个实验步骤;①调整量筒高度使内外液面相平;②使广口瓶和量筒内的气体都冷却至室温;③读取量筒内气体的体积。 这三步操作的先后顺序是:___________ (请填写步骤代号)。
(5)如果实验中得到的氧气体积是B L(标准状况),水蒸气的影响忽略不计,则混合物中过氧化钠的质量分数为(用含A、B的表达式表达,不必化简):___________ 。
(1)分别写出氧化钠、过氧化钠与水反应的化学方程式:;
(2)制取氧气时,混合物中的氧化钠固体有无必要除去?
(3)利用如图装置测定混合物中过氧化钠的纯度时,首先要进行的操作是

(4)以下是测量收集到的气体体积所必须包括的三个实验步骤;①调整量筒高度使内外液面相平;②使广口瓶和量筒内的气体都冷却至室温;③读取量筒内气体的体积。 这三步操作的先后顺序是:
(5)如果实验中得到的氧气体积是B L(标准状况),水蒸气的影响忽略不计,则混合物中过氧化钠的质量分数为(用含A、B的表达式表达,不必化简):
您最近一年使用:0次
10 . 最近,我国某高校一研究小组将0.383gAgCl,0.160gSe和0.21gNaOH装入充满蒸馏水的反应釜中加热到115°C,10小时后冷至室温,用水洗净可溶物后,得到难溶于水的金属色晶体A.在显微镜下观察,发现A的单晶竟是六角微型管(如下图所示),有望开发为特殊材料。现代物理方法证实A由银和硒两种元素组成,Se的质量几近原料的2/3;A的理论产量约0.39g。
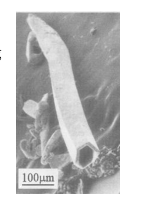
(1)写出合成A的化学方程式_______ ,标明A是什么_________ 。
(2)溶于水的物质有:_______ 。

(1)写出合成A的化学方程式
(2)溶于水的物质有:
您最近一年使用:0次



