名校
1 . 孔雀石的主要成分为xCuCO3•yCu(OH)2•zH2O,为测定其中CuCO3的质量分数,称取a g样品进行实验。下列实验方案可行的是
| A.充分加热样品,用碱石灰吸收逸出气体,增重b g |
| B.加热至样品质量不再发生变化,称得其质量为b g |
| C.向样品中加入足量的稀盐酸,用排水法收集逸出气体,得b mL气体 |
| D.向样品中加入足量的稀盐酸,充分反应,将生成的气体全部通入到足量Ba(OH)2溶液中,过滤、洗涤、烘干,得b g固体 |
您最近一年使用:0次
2023-04-26更新
|
299次组卷
|
3卷引用:北京市中国人民大学附属中学2019-2020学年高三上学期9月质检化学试题
2 . 我国法律规定,禁止酒后驾车。
(1)手持式酒精检测仪,检测呼出气体中乙醇浓度(BrAC)的主要原理为: 2K2Cr2O7+3C2H5OH+8H2SO4=2Cr2(SO4)3+2K2SO4+3___________+11H2O
①在横线上填相应的产物___________ 。
②判断司机酒驾所依据的现象是___________ 。
(2)BrAC一般作为酒驾检测的初筛手段,进一步是检测血液的乙醇浓度(BAC)。法律规定,20mg/10mL<BAC<80mg/100mL为酒后驾驶;BAC≥80mg/100mL为醉酒驾驶,BrAC与BAC的关系是:BAC(mg/L)=BrAC(mg/L)×2200,裁定醉酒驾驶BrAC的大小范围是___________ mg/L。
(3)近年又发展检测唾液中乙醇含量的方法,原理如下:
Ⅰ.将试纸浸入唾液10秒后取出,试纸中的乙醇在酶的作用下被空气氧化为CH3CHO和H2O2,写出化学方程式___________ 。
Ⅱ.H2O2与3,3′,5,5′—四甲基联苯胺(图1)反应反应一种有色化合物,颜色变化程度与乙醇含量成正比。

①被定义为“1”和“1”的碳原子是哪两个,在图1所示结构简式上将之涂黑。___________
②图2所示有机物的名称是___________ 。
(1)手持式酒精检测仪,检测呼出气体中乙醇浓度(BrAC)的主要原理为: 2K2Cr2O7+3C2H5OH+8H2SO4=2Cr2(SO4)3+2K2SO4+3___________+11H2O
①在横线上填相应的产物
②判断司机酒驾所依据的现象是
(2)BrAC一般作为酒驾检测的初筛手段,进一步是检测血液的乙醇浓度(BAC)。法律规定,20mg/10mL<BAC<80mg/100mL为酒后驾驶;BAC≥80mg/100mL为醉酒驾驶,BrAC与BAC的关系是:BAC(mg/L)=BrAC(mg/L)×2200,裁定醉酒驾驶BrAC的大小范围是
(3)近年又发展检测唾液中乙醇含量的方法,原理如下:
Ⅰ.将试纸浸入唾液10秒后取出,试纸中的乙醇在酶的作用下被空气氧化为CH3CHO和H2O2,写出化学方程式
Ⅱ.H2O2与3,3′,5,5′—四甲基联苯胺(图1)反应反应一种有色化合物,颜色变化程度与乙醇含量成正比。

①被定义为“1”和“1”的碳原子是哪两个,在图1所示结构简式上将之涂黑。
②图2所示有机物的名称是
您最近一年使用:0次
解题方法
3 . NaHCO3干法脱硫具有无腐蚀、无废水等特点,常用于除去工业烟气中少量的SO2。为探究不同温度下烟气的脱硫效果,设计如图装置(省略夹持装置)进行模拟实验。回答下列问题。

(1)实验开始前,先检查装置的____ 。II中添加的SiO2使NaHCO3分散,从而____ (填“增大”或“减小”)反应物接触面,提高脱硫效果。
(2)通入由SO2、N2组成的模拟烟气,待气流稳定后,点燃II处酒精灯,缓慢升温。当II中脱硫温度低于270℃时,反应为2NaHCO3+SO2=Na2SO3+2CO2+H2O;高于270℃时,NaHCO3完全分解为Na2CO3。由于Na2CO3的碱性比NaHCO3的____ (填“强”或“弱”),因而其脱硫效果更好,Na2CO3脱硫反应的方程式为____ 。
(3)装置IV的作用是吸收体系中的残余SO2,可选用的试剂有____ 。
(4)保持II中反应温度为300℃不变,待气流完全稳定时,从SO2检测器读数并进行换算,得出I和III中SO2的浓度依次为C1、C2,用C1、C2表示的脱硫率计算式为____ 。
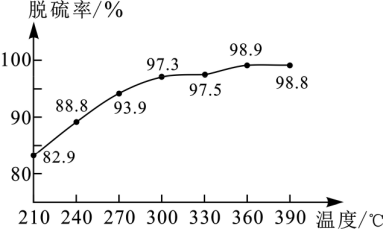
(5)持续测定并处理数据,得出不同温度下的脱硫率(如图)。根据图中实验数据判断,该方法最适宜的脱硫温度范围是____ ,选择该温度范围的理由有____ 。

(1)实验开始前,先检查装置的
(2)通入由SO2、N2组成的模拟烟气,待气流稳定后,点燃II处酒精灯,缓慢升温。当II中脱硫温度低于270℃时,反应为2NaHCO3+SO2=Na2SO3+2CO2+H2O;高于270℃时,NaHCO3完全分解为Na2CO3。由于Na2CO3的碱性比NaHCO3的
(3)装置IV的作用是吸收体系中的残余SO2,可选用的试剂有
| A.NaOH溶液 | B.酸性KMnO4溶液 | C.浓硫酸 | D.盐酸 |
(5)持续测定并处理数据,得出不同温度下的脱硫率(如图)。根据图中实验数据判断,该方法最适宜的脱硫温度范围是

您最近一年使用:0次
2022-08-15更新
|
97次组卷
|
2卷引用:广西壮族自治区普通高中2020—2021学年高三上学期12月学业水平考试化学试题
名校
4 . 根据实验室测定硫酸铜结晶(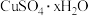 )水含量的实验,填写下列空白:
)水含量的实验,填写下列空白:
实验步骤为:①研磨;②准确称取10.990g已经研碎的硫酸铜晶体;③加热;④冷却;⑤称量;⑥重复③至⑤的操作,直至……;⑦根据实验数据计算硫酸铜晶体里结晶水的含量。回答相关问题:
(1)步骤②需要的实验仪器是___________ ,④需要使用干燥器,使用此仪器的目的是___________ ,步骤⑥操作为重复③至⑤的操作的目的是___________
(2)步骤③所用的大部分仪器如下,在空格中填入仪器的名称:
灼烧时将瓷坩埚置于___________ 上(用所给仪器的编号填入,下同),取用坩埚应使用___________ ,灼烧后的坩埚应放在___________ 上,不能直接放在桌面上
实验所用仪器:a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚钳 f.试管夹
某学生实验后得到以下数据:
(3)若无需再进行第三次称量,则a的数值范围应为___________ (区间表示)
(4)若加热后坩埚与固体总质量为18.620g,计算x的实测值___________ (保留二位小数),相对误差为___________
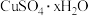 )水含量的实验,填写下列空白:
)水含量的实验,填写下列空白:实验步骤为:①研磨;②准确称取10.990g已经研碎的硫酸铜晶体;③加热;④冷却;⑤称量;⑥重复③至⑤的操作,直至……;⑦根据实验数据计算硫酸铜晶体里结晶水的含量。回答相关问题:
(1)步骤②需要的实验仪器是
(2)步骤③所用的大部分仪器如下,在空格中填入仪器的名称:
灼烧时将瓷坩埚置于
实验所用仪器:a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚钳 f.试管夹
某学生实验后得到以下数据:
| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 | |
| 第一次称量 | 第二次称量 | ||
| 11.710g | 22.700g | 18.621g | a |
(4)若加热后坩埚与固体总质量为18.620g,计算x的实测值
您最近一年使用:0次
名校
5 . 回答下列问题:
(1)在密闭容器中加入NaHCO3和NaOH的混合物共18.4g,加热至300℃,经充分反应后排出气体,冷却得到剩余固体质量为16.6g。试确定混合物的组成:m(NaHCO3)=__ g。
(2)为测定镁铝合金的成分,取13.5g合金全部溶于500mL3mol/L的H2SO4中,充分反应后,再加入400mL8mol/L的NaOH溶液,结果得到了白色沉淀和滤液B。
①滤液B中n(NaAlO2)=__ mol。
②若白色沉淀只有一种成分,则合金中镁的质量分数范围为__ 。
(1)在密闭容器中加入NaHCO3和NaOH的混合物共18.4g,加热至300℃,经充分反应后排出气体,冷却得到剩余固体质量为16.6g。试确定混合物的组成:m(NaHCO3)=
(2)为测定镁铝合金的成分,取13.5g合金全部溶于500mL3mol/L的H2SO4中,充分反应后,再加入400mL8mol/L的NaOH溶液,结果得到了白色沉淀和滤液B。
①滤液B中n(NaAlO2)=
②若白色沉淀只有一种成分,则合金中镁的质量分数范围为
您最近一年使用:0次
名校
6 . 污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。利用软锰矿(主要成分为MnO2,含少量铁、铝、铜、镍等金属化合物)作脱硫剂,脱除燃煤尾气中的SO2并制得MnO2的流程如下:

回答下列问题:
(1)I.过滤操作时需要用到的玻璃仪器有___________ 。
(2)下列各组试剂中,能检验“尾气”中SO2是否除尽的是___________(填序号)。
(3)步骤IV中发生反应的离子方程式为___________ 。
II.可利用滴定法来测定尾气中SO2的含量,实验室按以下步骤进行:
①取标况下1000 mL尾气样品,通入适量NaOH溶液中;
②配制成250 mL溶液;
③准确量取25.00 mL;
④将25.00 mL溶液置于锥形瓶中;
⑤用0.0100 mol/L的酸性KMnO4溶液进行滴定,达到滴定终点时,消耗10.00 mL溶液。
(4)滴定达到终点的现象是______
(5)该尾气中SO2的含量为___________ g/L
(6)以下操作会造成测定结果偏低的是______

回答下列问题:
(1)I.过滤操作时需要用到的玻璃仪器有
(2)下列各组试剂中,能检验“尾气”中SO2是否除尽的是___________(填序号)。
| A.氯化钡溶液 | B.稀硫酸酸化的KMnO4溶液 |
| C.碘水和淀粉的混合溶液 | D.NaOH溶液 |
II.可利用滴定法来测定尾气中SO2的含量,实验室按以下步骤进行:
①取标况下1000 mL尾气样品,通入适量NaOH溶液中;
②配制成250 mL溶液;
③准确量取25.00 mL;
④将25.00 mL溶液置于锥形瓶中;
⑤用0.0100 mol/L的酸性KMnO4溶液进行滴定,达到滴定终点时,消耗10.00 mL溶液。
(4)滴定达到终点的现象是
(5)该尾气中SO2的含量为
(6)以下操作会造成测定结果偏低的是______
| A.达到滴定终点读取数据时,俯视视滴定管液面 |
| B.锥形瓶未用待测液润洗 |
| C.盛装标准溶液的滴定管,滴定前尖嘴处有气泡,滴定后气泡消失 |
| D.溶液颜色变化后,立即读数 |
您最近一年使用:0次
2021-11-20更新
|
176次组卷
|
2卷引用:浙江省桐庐中学2021-2022学年高二12月阶段性测试化学试题
名校
7 . 重铬酸钾法测定水样COD(水样的化学耗氧量,主要是测定有机物的化学耗氧量,以O2计,单位为mg·L-1),部分实验装置如下图所示:

测定步骤如下:
①取20.00mL水样置于250mL仪器M中,并向其中加入适量硫酸汞用于除去水样中的氯离子。
②准确加入10.00mL 0.1mol·L-1重铬酸钾标准溶液及沸石,连接磨口回流冷凝管,从冷凝管上口慢慢地加入30mL硫酸-硫酸银溶液,只需加热回流2h即可充分反应。
③冷却后,将溶液倒入烧杯中,加3滴试亚铁灵指示剂,用0.10mol·L-1硫酸亚铁铵标准溶液滴定,达到滴定终点时,记录硫酸亚铁铵标准溶液的体积为a mL。
已知: I.本实验条件下,Cr2O 的氧化性强于MnO
的氧化性强于MnO ;
;
II.水样被氧化时,K2Cr2O7发生反应Cr2O (橙色)+14H++6e- =2Cr3+ +7H2O;
(橙色)+14H++6e- =2Cr3+ +7H2O;
III.Fe2++试亚铁灵(指示剂)→红褐色(终点)。
回答下列问题:
(1)仪器M的名称为___________ 。
(2)溶液中的氯离子未除去或除不尽会发生副反应,若存在1 mol氯离子,则会消耗重铬酸钾_______ mol(结果保留2位有效数字),COD测定结果_______ (填“偏大”或“偏小”)。
(3)硫酸银在实验中的作用是___________ ;油浴加热的优点是___________ 。
(4)重铬酸钾氧化有机物的产物为CO2,CO2的电子式为_____ ;硫酸亚铁铵标准溶液滴定时发生反应的离子方程式为___________ 。
(5)达到滴定终点时的现象是___________ ;水样COD=______ mg·L-1(用含a的代数式表示)。

测定步骤如下:
①取20.00mL水样置于250mL仪器M中,并向其中加入适量硫酸汞用于除去水样中的氯离子。
②准确加入10.00mL 0.1mol·L-1重铬酸钾标准溶液及沸石,连接磨口回流冷凝管,从冷凝管上口慢慢地加入30mL硫酸-硫酸银溶液,只需加热回流2h即可充分反应。
③冷却后,将溶液倒入烧杯中,加3滴试亚铁灵指示剂,用0.10mol·L-1硫酸亚铁铵标准溶液滴定,达到滴定终点时,记录硫酸亚铁铵标准溶液的体积为a mL。
已知: I.本实验条件下,Cr2O
 的氧化性强于MnO
的氧化性强于MnO ;
;II.水样被氧化时,K2Cr2O7发生反应Cr2O
 (橙色)+14H++6e- =2Cr3+ +7H2O;
(橙色)+14H++6e- =2Cr3+ +7H2O;III.Fe2++试亚铁灵(指示剂)→红褐色(终点)。
回答下列问题:
(1)仪器M的名称为
(2)溶液中的氯离子未除去或除不尽会发生副反应,若存在1 mol氯离子,则会消耗重铬酸钾
(3)硫酸银在实验中的作用是
(4)重铬酸钾氧化有机物的产物为CO2,CO2的电子式为
(5)达到滴定终点时的现象是
您最近一年使用:0次
8 . 2019年诺贝尔化学奖授予约翰·古德伊纳夫、斯坦利·惠廷厄姆和吉野彰三位科学家,以表彰他们在锂电池领域所做出的巨大贡献。 是极具发展潜力的新型锂离子电池电极材料,一种制备
是极具发展潜力的新型锂离子电池电极材料,一种制备 的方法为:
的方法为: 。图是以废铁屑和
。图是以废铁屑和 为原料制备
为原料制备 的流程。
的流程。

请回答下列问题:
(1)制备过程中,废铁屑要先用热的纯碱溶液洗涤,其目的是_______ 。
(2)操作Ⅰ为趁热过滤,操作Ⅱ的步骤是_______ 、过滤。
(3)制备 时必须在惰性气体氛围中进行,其原因是
时必须在惰性气体氛围中进行,其原因是_______ 。
(4)取 产品经灼烧、稀硫酸溶解、
产品经灼烧、稀硫酸溶解、 还原、后续处理后配成100mL溶液,再取出20.00mL溶液至锥形瓶中,用
还原、后续处理后配成100mL溶液,再取出20.00mL溶液至锥形瓶中,用 的酸性
的酸性 标准溶液滴定,经3次滴定,每次消耗
标准溶液滴定,经3次滴定,每次消耗 溶液的体积如表:
溶液的体积如表:
①写出用 还原的离子方程式
还原的离子方程式_______ 。
②造成第一次测定结果的原因可能是_______ (写一条)。
③到达滴定终点时现象为_______ ;根据滴定结果,可计算产品中 的质量分数为
的质量分数为_______ 。
 是极具发展潜力的新型锂离子电池电极材料,一种制备
是极具发展潜力的新型锂离子电池电极材料,一种制备 的方法为:
的方法为: 。图是以废铁屑和
。图是以废铁屑和 为原料制备
为原料制备 的流程。
的流程。
请回答下列问题:
(1)制备过程中,废铁屑要先用热的纯碱溶液洗涤,其目的是
(2)操作Ⅰ为趁热过滤,操作Ⅱ的步骤是
(3)制备
 时必须在惰性气体氛围中进行,其原因是
时必须在惰性气体氛围中进行,其原因是(4)取
 产品经灼烧、稀硫酸溶解、
产品经灼烧、稀硫酸溶解、 还原、后续处理后配成100mL溶液,再取出20.00mL溶液至锥形瓶中,用
还原、后续处理后配成100mL溶液,再取出20.00mL溶液至锥形瓶中,用 的酸性
的酸性 标准溶液滴定,经3次滴定,每次消耗
标准溶液滴定,经3次滴定,每次消耗 溶液的体积如表:
溶液的体积如表:| 实验序号 | 1 | 2 | 3 |
消耗 溶液体积 溶液体积 | 21.38mL | 19.98mL | 20.02mL |
①写出用
 还原的离子方程式
还原的离子方程式②造成第一次测定结果的原因可能是
③到达滴定终点时现象为
 的质量分数为
的质量分数为
您最近一年使用:0次
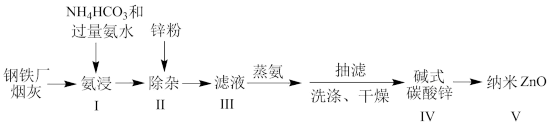
9 . 某研究小组根据文献模拟利用氨浸法从某钢铁厂烟灰(主要成分为ZnO,并含有少量的CuO、Fe2O3等)中制备碱式碳酸锌,并测定其组成的流程如下:
已知:a、碱式碳酸锌白色粉末,难溶于水和乙醇,微溶于氨;
纳米氧化锌具有极强的吸附性,空气中久置容易变质。
b、ZnO+2NH3+2 →Zn(NH3)
→Zn(NH3) +H2O
+H2O
Zn(NH3) →Zn2++4NH3
→Zn2++4NH3
Zn2++2OH-→Zn(OH)2↓
Zn2++ →ZnCO3↓
→ZnCO3↓
(1)“氨浸”时加入过量氨水的目的:
①使HCO 转化为
转化为 :
:
②_______ 。
(2)下列说法不正确的是_______。
(3)I、该研究小组利用步骤V对碱式碳酸锌[Zn3(OH)m(CO3)n(其中m。n为整数)]组成进行测定,从下列选项中选出合理的操作并排序:坩埚预处理后将样品放入坩埚中称量,再置于高温炉中加热→_______→_______→_______→_______→_______。_______
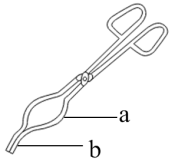
①放在石棉网上
②放在干燥器中
③冷却至室温
④用如图坩埚钳a处夹取坩埚
⑤用如图坩埚钳b处夹取坩埚⑥放入电子天平中称量
⑦重复以上操作,确认最后两次称量值差≦0.001g
II、电子天平记录的部分数据如下表所示
①根据数据计算该碱式碳酸锌的化学式_______ 。
②写出蒸氨步骤制得该碱式碳酸锌的离子方程式_______ 。

已知:a、碱式碳酸锌白色粉末,难溶于水和乙醇,微溶于氨;
纳米氧化锌具有极强的吸附性,空气中久置容易变质。
b、ZnO+2NH3+2
 →Zn(NH3)
→Zn(NH3) +H2O
+H2OZn(NH3)
 →Zn2++4NH3
→Zn2++4NH3Zn2++2OH-→Zn(OH)2↓
Zn2++
 →ZnCO3↓
→ZnCO3↓(1)“氨浸”时加入过量氨水的目的:
①使HCO
 转化为
转化为 :
:②
(2)下列说法不正确的是_______。
| A.步骤I可以采用加热方式来加快浸出速率,提高浸出量 |
| B.步骤II过滤得到的滤渣中含有Cu、Fe、Zn |
| C.步骤III蒸氨过程产生气体除了氨气还有CO2,冷凝后得到的碳化氨水循环用于氨浸 |
| D.步骤IV洗涤时可先用浓氨水洗涤,减少固体溶解,再用无水乙醇洗涤 |

①放在石棉网上
②放在干燥器中
③冷却至室温
④用如图坩埚钳a处夹取坩埚
⑤用如图坩埚钳b处夹取坩埚⑥放入电子天平中称量
⑦重复以上操作,确认最后两次称量值差≦0.001g
II、电子天平记录的部分数据如下表所示
| 电子天平视数/g | |
| 空坩埚 | 19.2500 |
| 空坩埚+样品 | 25.7100 |
| 第一次灼烧后称量 | 24.3251 |
| 第二次灼烧后称量 | 24.1414 |
| 第三次灼烧后称量 | 24.1101 |
| 第四次灼烧后称量 | 24.1100 |
| 第五次灼烧后称量 | 24.1099 |
②写出蒸氨步骤制得该碱式碳酸锌的离子方程式
您最近一年使用:0次
2021-09-17更新
|
709次组卷
|
4卷引用:浙江省名校新高考研究联盟(Z20联盟)2022届高三上学期第一次联考化学试题
浙江省名校新高考研究联盟(Z20联盟)2022届高三上学期第一次联考化学试题2020年全国卷Ⅰ理综化学高考真题变式题2021年湖北高考化学试题变式题11-19(已下线)解密13 实验化学(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)
名校
解题方法
10 . 氮化铝(AlN)是一种新型无机非金属材料,某AlN样品仅含有Al2O3杂质,为测定AlN的含量,将样品溶解于足量的NaOH浓溶液中,具体实验方案如图,下列说法正确的是
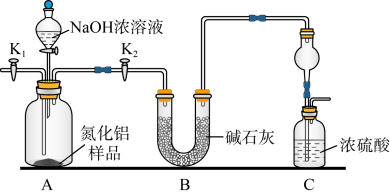

| A.装置A中发生反应的离子方程为AlN+3OH-+3H2O=Al(OH)3↓+NH3↑ |
| B.若缺少装置B,会使所测结果偏低 |
| C.为减小实验误差,样品完全溶解后应通过K1向装置中通入氮气 |
| D.根据装置B反应前后的质量差和样品质量可计算出AlN的含量 |
您最近一年使用:0次



