名校
解题方法
1 . 某无色溶液中可能含有下列几种离子中的某几种:Ca2+、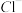 、
、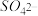 、
、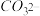 、
、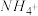 、
、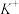 、Cu2+。为确认溶液组成进行如下实验:(1)200mL上述溶液,加入足量
、Cu2+。为确认溶液组成进行如下实验:(1)200mL上述溶液,加入足量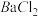 溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。(2)向(1)的滤液中加入足量的
溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。(2)向(1)的滤液中加入足量的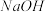 溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。由此可以得出关于原溶液组成的正确结论是
溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。由此可以得出关于原溶液组成的正确结论是
(1)溶液中一定不存在的离子是__ ,不能确定是否存在的离子是__ .为确定该离子,应当补充的实验名称是______________
(2)溶液中肯定存在的阴离子有哪些?通过计算求出它们的物质的量浓度(或范围)。______________
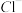 、
、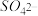 、
、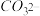 、
、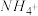 、
、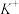 、Cu2+。为确认溶液组成进行如下实验:(1)200mL上述溶液,加入足量
、Cu2+。为确认溶液组成进行如下实验:(1)200mL上述溶液,加入足量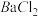 溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。(2)向(1)的滤液中加入足量的
溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。(2)向(1)的滤液中加入足量的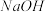 溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。由此可以得出关于原溶液组成的正确结论是
溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。由此可以得出关于原溶液组成的正确结论是(1)溶液中一定不存在的离子是
(2)溶液中肯定存在的阴离子有哪些?通过计算求出它们的物质的量浓度(或范围)。

您最近一年使用:0次
2 . 某小组为探究AgNO3溶液和不同类型盐溶液反应的多样性,设计如下实验:
已知:AgSCN为白色难溶物;(SCN)2与卤素单质性质相似,(SCN)2为有色物质。
(1)①中的白色沉淀是___________________ 。
(2)分离并洗涤①的沉淀,滴加0.5mol/L KI溶液,白色沉淀转变为黄色沉淀,用离子方程式解释上述变化____________________________ 。
(3)②中可能发生的离子反应有_________________ 。
(4)实验①的设计目的_______________________ 。
(5)对于③中红色褪去的原因及Ag+与SCN-反应的情况,小组进行以下分析和设计:
Ⅰ.甲同学认为,红色褪去的原因与平衡移动原理有关,解释为_________________ 。
Ⅱ.乙同学为了探究③中是否发生Ag+氧化SCN-的反应,又设计以下对比实验:
现象:生成白色沉淀,长时间观察,溶液和沉淀均未发生颜色改变。
Ⅲ.丙同学认为,理论上Ag+能够氧化SCN-,为证明其猜想,设计如下实验:
现象:电流计指针发生偏转,a电极上产生具有金属光泽的物质,b电极附近的溶液发生颜色变化。
丙同学的设计在证明氧化还原反应的优点是___________________________ 。
(6)通过以上探究,得出AgNO3溶液和不同类型盐溶液反应多样性的结论是______ 。

已知:AgSCN为白色难溶物;(SCN)2与卤素单质性质相似,(SCN)2为有色物质。
(1)①中的白色沉淀是
(2)分离并洗涤①的沉淀,滴加0.5mol/L KI溶液,白色沉淀转变为黄色沉淀,用离子方程式解释上述变化
(3)②中可能发生的离子反应有
(4)实验①的设计目的
(5)对于③中红色褪去的原因及Ag+与SCN-反应的情况,小组进行以下分析和设计:
Ⅰ.甲同学认为,红色褪去的原因与平衡移动原理有关,解释为
Ⅱ.乙同学为了探究③中是否发生Ag+氧化SCN-的反应,又设计以下对比实验:
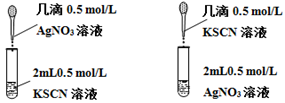
现象:生成白色沉淀,长时间观察,溶液和沉淀均未发生颜色改变。
Ⅲ.丙同学认为,理论上Ag+能够氧化SCN-,为证明其猜想,设计如下实验:

现象:电流计指针发生偏转,a电极上产生具有金属光泽的物质,b电极附近的溶液发生颜色变化。
丙同学的设计在证明氧化还原反应的优点是
(6)通过以上探究,得出AgNO3溶液和不同类型盐溶液反应多样性的结论是
您最近一年使用:0次
名校
3 . 某实验小组探究少量Cl2和FeBr2反应的过程。
(1)配制FeBr2溶液:
ⅰ.配制50mL1.0mol/LFeBr2溶液;
ⅱ.上述溶液呈淡黄色。取少量此溶液,向其中滴入KSCN溶液,变为浅红色。
①配制50mL1.0mol/LFeBr2溶液需要的玻璃容器是________________ 。
②由ⅱ可知,此FeBr2溶液呈黄色的原因是其中含有________ ,用离子方程式解释产生其原因:_______ 。
(2)氯气和FeBr2反应实验操作及现象如下:
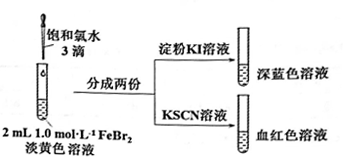
据此甲同学得出结论:少量Cl2既能和Fe2+又能和Br-发生氧化还原反应。
①Cl2和Fe2+发生反应的离子方程式是________________ 。
②乙同学认为上述实验不能证明Cl2和Br-发生反应,理由是_____________ 。
③乙同学改进实验如下:在上述FeBr2溶液中加入过量铁粉,取上清液2 mL,向其中滴加3滴饱和氯水后,再加入CCl4,振荡后静置,观察现象。乙得出结论:少量Cl2只与Fe2+反应,不与Br-反应。乙得出该结论依据的实验现象是____________________ 。
(3)丙同学继续设计实验,探究反应过程:
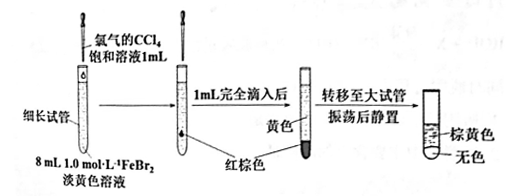
①转移到大试管前CCl4液体中呈红棕色的物质是___________ 。
②丙通过此实验可得出结论:________ 。
(1)配制FeBr2溶液:
ⅰ.配制50mL1.0mol/LFeBr2溶液;
ⅱ.上述溶液呈淡黄色。取少量此溶液,向其中滴入KSCN溶液,变为浅红色。
①配制50mL1.0mol/LFeBr2溶液需要的玻璃容器是
②由ⅱ可知,此FeBr2溶液呈黄色的原因是其中含有
(2)氯气和FeBr2反应实验操作及现象如下:

据此甲同学得出结论:少量Cl2既能和Fe2+又能和Br-发生氧化还原反应。
①Cl2和Fe2+发生反应的离子方程式是
②乙同学认为上述实验不能证明Cl2和Br-发生反应,理由是
③乙同学改进实验如下:在上述FeBr2溶液中加入过量铁粉,取上清液2 mL,向其中滴加3滴饱和氯水后,再加入CCl4,振荡后静置,观察现象。乙得出结论:少量Cl2只与Fe2+反应,不与Br-反应。乙得出该结论依据的实验现象是
(3)丙同学继续设计实验,探究反应过程:

①转移到大试管前CCl4液体中呈红棕色的物质是
②丙通过此实验可得出结论:
您最近一年使用:0次
2017-03-15更新
|
785次组卷
|
4卷引用:2017届北京市海淀区高三3月适应性考试(零模)理综化学试卷
2017届北京市海淀区高三3月适应性考试(零模)理综化学试卷2020届高考化学二轮复习大题精准训练——反应原理(历程)的探究式实验(已下线)专题6.2 实验综合题(必考)(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升北京市中央民族大学附属中学2022届高三9月月考化学试题
名校
解题方法
4 . 硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]是透明、浅蓝绿色晶体,易溶于水而不溶于酒精等有机溶剂,在空气中一般比较稳定,不易被氧化。制备步骤如下:
步骤1.称取还原铁粉0.4g,炭粉0.3g,放入50mL 锥形瓶中,加入3.5 mL2mol·L-1硫酸置于60℃ 热水浴中加热(如下左图),待反应完全,取出冷却,再加入6 mol·L-1的硫酸2 mL。
步骤2.在上述反应液中加入浓氨水0.8 mL,振荡混匀,抽滤(如上右图)。向滤液中加入10mL无水乙醇,静置,大量晶体析出,倾析,再次抽滤。
步骤3.取出晶体,用干净的滤纸吸干,称量并分析样品。
请回答下列问题:
(1)步骤1中炭粉的作用是_______ ,加入6 mol·L-1硫酸的作用是____________ 。
(2)向滤液中加入无水乙醇目的是_________________ 。
(3)产品中金属阳离子的检验方法及现象________________ 。
(4)称取获得的硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](摩尔质量为392g·mol-1)1.9600 g 配成100mL溶液,取出20.00mL滴加稀H2SO4酸化后用0 . 0100 mol·L-1KMnO4标准溶液进行滴定,消耗KMnO4溶液为18.00mL 。
下列有关滴定的操作正确的是_(填字母编号)。
a.滴定过程中眼睛注视滴定管中液面变化
b.滴定完成后取下滴定管握住中部防止掉落
c.读数过程中保持滴定管自然悬垂
d.读数时视线与刻度线、凹液面最低处切线相平齐
滴定过程中反应离子方程式为____________ ,制得硫酸亚铁铵样品的纯度为__________ 。
步骤1.称取还原铁粉0.4g,炭粉0.3g,放入50mL 锥形瓶中,加入3.5 mL2mol·L-1硫酸置于60℃ 热水浴中加热(如下左图),待反应完全,取出冷却,再加入6 mol·L-1的硫酸2 mL。

步骤2.在上述反应液中加入浓氨水0.8 mL,振荡混匀,抽滤(如上右图)。向滤液中加入10mL无水乙醇,静置,大量晶体析出,倾析,再次抽滤。
步骤3.取出晶体,用干净的滤纸吸干,称量并分析样品。
请回答下列问题:
(1)步骤1中炭粉的作用是
(2)向滤液中加入无水乙醇目的是
(3)产品中金属阳离子的检验方法及现象
(4)称取获得的硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](摩尔质量为392g·mol-1)1.9600 g 配成100mL溶液,取出20.00mL滴加稀H2SO4酸化后用0 . 0100 mol·L-1KMnO4标准溶液进行滴定,消耗KMnO4溶液为18.00mL 。
下列有关滴定的操作正确的是_(填字母编号)。
a.滴定过程中眼睛注视滴定管中液面变化
b.滴定完成后取下滴定管握住中部防止掉落
c.读数过程中保持滴定管自然悬垂
d.读数时视线与刻度线、凹液面最低处切线相平齐
滴定过程中反应离子方程式为
您最近一年使用:0次
2017-03-15更新
|
369次组卷
|
2卷引用:2017届安徽省“江南十校”高三3月联考理综化学试卷
名校
解题方法
5 . A、B、C、D为四种可溶性盐,它们的阳离子分别是Ba2+、Ag+、Na+、Cu2+中的一种,阴离子分别是NO 、SO
、SO 、Cl-、CO
、Cl-、CO 中的一种(离子在物质中不能重复出现)。现做如下实验:
中的一种(离子在物质中不能重复出现)。现做如下实验:
①把四种盐分别溶于盛有蒸馏水的四支试管中,只有C的溶液呈蓝色;
②向①的四支试管中分别加入盐酸,B的溶液中有沉淀生成,D的溶液中有无色无味的气体逸出。
根据①②实验现象回答下列问题。
(1)写出A、C的化学式:A_______ ,C_______ 。
(2)写出盐酸与D反应的离子方程式:_______ 。
(3)写出C与Ba(OH)2溶液反应的离子方程式:_______ 。
 、SO
、SO 、Cl-、CO
、Cl-、CO 中的一种(离子在物质中不能重复出现)。现做如下实验:
中的一种(离子在物质中不能重复出现)。现做如下实验:①把四种盐分别溶于盛有蒸馏水的四支试管中,只有C的溶液呈蓝色;
②向①的四支试管中分别加入盐酸,B的溶液中有沉淀生成,D的溶液中有无色无味的气体逸出。
根据①②实验现象回答下列问题。
(1)写出A、C的化学式:A
(2)写出盐酸与D反应的离子方程式:
(3)写出C与Ba(OH)2溶液反应的离子方程式:
您最近一年使用:0次
2017-02-17更新
|
545次组卷
|
10卷引用:2016-2017学年广西钦州港区高一上11月月考化学卷
2016-2017学年广西钦州港区高一上11月月考化学卷吉林省长春市榆树市第一高级中学2019-2020学年高一上学期尖子生考试化学试题云南省镇沅县第一中学2021-2022学年高二下学期开学考试化学试题黑龙江省哈尔滨市第一中学2021-2022学年高一上学期期中考试化学试题 山东省“学情空间”区域教研共同体2022-2023学年高一上学期10月联考(人教版)化学试题湖南省长沙市南雅中学2022-2023学年高一上学期第一次月考化学试题黑龙江省齐齐哈尔市恒昌中学校2022-2023学年高一上学期11月期中检测化学试题湖南省长沙市南雅中学2023-2024学年高一上学期第一次月考化学试题云南省曲靖市罗平县第一中学2023-2024学年高一上学期9月月考化学试题河南省郑州市第四高级中学2023-2024学年高一上学期西藏班第二次调研考试 化学试题
解题方法
6 . 某学习小组进行“铁与水反应所得固体物质的成分、性质及再利用”的实验探究。
【探究一】设计下图所示装置进行“铁与水反应”的实验。

(1)反应前A中投放碎瓷片的目的是__________________ 。
(2)硬质玻璃管B中发生反应的化学方程式为_______________ 。
(3)装置E中的现象是__________________ 。
【探究二】设计如下实验方案确定反应后硬质玻璃管中黑色固体的成分。
待硬质玻璃管B冷却后,取少许其中的固体物质溶于硫酸后,将所得溶液分成两份。
(4)一份滴加几滴KSCN溶液。若溶液变红色,推断硬质玻璃管B中固体物质的成分(选填序号,下同)为_______ ;若溶液未变红色,推断硬质玻璃管B中固体物质的成分为_______ 。
①只有有Fe ②只有Fe3O4 ③Fe3O4和Fe ④一定有Fe3O4,可能有Fe
(5)若要检测溶液中是否存在Fe 2+,则另一份溶液中需要加入______ (填试剂)来检验。
【探究三】设计如下流程测定反应后硬质玻璃管B中固体含铁元素的质量分数。

(6)计算反应后B装置中铁元素的质量分数为_______ 。
【探究一】设计下图所示装置进行“铁与水反应”的实验。

(1)反应前A中投放碎瓷片的目的是
(2)硬质玻璃管B中发生反应的化学方程式为
(3)装置E中的现象是
【探究二】设计如下实验方案确定反应后硬质玻璃管中黑色固体的成分。
待硬质玻璃管B冷却后,取少许其中的固体物质溶于硫酸后,将所得溶液分成两份。
(4)一份滴加几滴KSCN溶液。若溶液变红色,推断硬质玻璃管B中固体物质的成分(选填序号,下同)为
①只有有Fe ②只有Fe3O4 ③Fe3O4和Fe ④一定有Fe3O4,可能有Fe
(5)若要检测溶液中是否存在Fe 2+,则另一份溶液中需要加入
【探究三】设计如下流程测定反应后硬质玻璃管B中固体含铁元素的质量分数。

(6)计算反应后B装置中铁元素的质量分数为
您最近一年使用:0次
7 . 无水FeCl3呈棕红色,极易潮解,100℃左右时升华,工业上常用作有机合成催化剂。实验室可用下列装置(夹持仪器略去)制备并收集无水FeCl3。
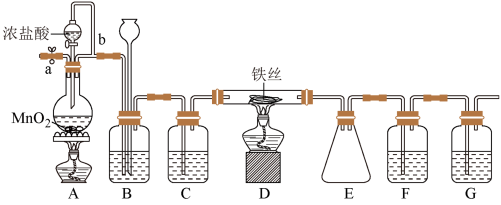
请回答:
(1)装置A中反应的化学方程式为_______________________________ 。
(2)装置F中所加的试剂为______________ 。
(3)导管b的作用为_________________ ;装置B的作用为____________________________ 。
(4)实验时应先点燃A处的酒精灯,反应一会儿后,再点燃D处的酒精灯,原因为___________ 。
(5)反应结束后,拆卸装置前,必须进行的操作是_____________________________ 。
(6)为检验所得产品中是否含有FeCl2,可进行如下实验:取E中收集的产物少许,加水溶解,向所得溶液中加入一种试剂,该试剂为________ (填序号)。
①Fe粉 ②KSCN溶液 ③酸性KMnO4溶液 ④NaOH溶液

请回答:
(1)装置A中反应的化学方程式为
(2)装置F中所加的试剂为
(3)导管b的作用为
(4)实验时应先点燃A处的酒精灯,反应一会儿后,再点燃D处的酒精灯,原因为
(5)反应结束后,拆卸装置前,必须进行的操作是
(6)为检验所得产品中是否含有FeCl2,可进行如下实验:取E中收集的产物少许,加水溶解,向所得溶液中加入一种试剂,该试剂为
①Fe粉 ②KSCN溶液 ③酸性KMnO4溶液 ④NaOH溶液
您最近一年使用:0次
12-13高一上·安徽六安·期中
解题方法
8 . 有一包白色固体粉末,由Na2SO4、CaCO3、KCl、BaCl2、CuSO4中的三种物质组成,取样进行如下实验:
I.取少量白色粉末,加入足量水,充分搅拌后过滤,得到白色沉淀和无色滤液;
II.向I中滤出的沉淀中加入足量稀盐酸,沉淀全溶解,并生产无色气体。
(1)则原混合物中一定不存在_______ ,一定存在______ 。
(2)实验中发生反应的化学方程式:_______ 。
(3)设计实验进一步确定混合物的组成,简述实验步骤、现象和结论。____ 。
I.取少量白色粉末,加入足量水,充分搅拌后过滤,得到白色沉淀和无色滤液;
II.向I中滤出的沉淀中加入足量稀盐酸,沉淀全溶解,并生产无色气体。
(1)则原混合物中一定不存在
(2)实验中发生反应的化学方程式:
(3)设计实验进一步确定混合物的组成,简述实验步骤、现象和结论。
您最近一年使用:0次
2016-12-09更新
|
214次组卷
|
4卷引用:2012-2013学年安徽六安新安中学高一上学期期中考试化学试卷
(已下线)2012-2013学年安徽六安新安中学高一上学期期中考试化学试卷2016届江西省赣中南五校高三下学期第二次段考化学试卷(已下线)同步君 必修1 第3章 第2节 铁的化合物高中化学人教版 必修1 第三章 金属及其化合物 2.几种重要的金属化合物 铁的重要化合物
14-15高三上·山西忻州·期中
名校
解题方法
9 . 在Na+浓度为0.5mol/L的某澄清溶液中,还可能含有下表中的若干种离子:
取该溶液100mL进行如下实验(气体体积在标准状况下测定):
试回答下列问题:
(1)实验I能确定一定不存在的阳离子是______________________ 。
(2)实验I中生成沉淀的离子方程式为________________________ 。
(3)通过实验I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“不能确定”)
(4)判断K+是否存在,若存在求其最小浓度(若不存在说明理由)___________________ 。
| 阳离子 | K+、Ag+、Mg2+、Ba2+ |
| 阴离子 | NO3-、CO32-、SiO32-、SO42- |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中加入足量稀HCl | 产生白色沉淀并放出0.56L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
| Ⅲ | 在Ⅱ的滤液中滴加BaC12溶液 | 无明显现象 |
(1)实验I能确定一定不存在的阳离子是
(2)实验I中生成沉淀的离子方程式为
(3)通过实验I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“不能确定”)
| 阴离子 | NO3- | CO32- | SiO32- | SO42- |
| c/mol·L-1 | | | | |
您最近一年使用:0次
2016-12-09更新
|
780次组卷
|
21卷引用:2015届山西省忻州第一中学高三上学期期中考试化学试卷
(已下线)2015届山西省忻州第一中学高三上学期期中考试化学试卷2015-2016学年山西阳泉十五中高三第一次阶段考试化学试卷2016届河南省宜阳县实验学校高三第二次月考化学试卷2015-2016学年黑龙江省大庆铁人中学高一上期末化学试卷2015-2016学年河北石家庄一中高一下学情反馈一化学卷2015-2016学年河南省南阳市宛东五校高一下第一次联考化学试卷陕西省西安中学2018届高三10月月考化学试题内蒙古巴彦淖尔市第一中学2018届高三9月月考理科综合化学试题陕西省西安中学2018届高三上学期期中考试化学试题江西省南昌市第二中学2017-2018学年高一上学期第三次月考化学试题(已下线)【中等生百日捷进提升系列-技能方法】专题18 以离子性质为基础的无机推断题2019届高三化学一轮练习卷:离子的检验与推断【全国校级联考】四川省眉山一中办学共同体2019届高三9月月考化学试题(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化 第2讲 离子反应和离子方程式【押题专练】云南省玉溪市第一中学2019届高三上学期第二次调研考试化学试题甘肃省白银市会宁二中2019届高三上学期9月月考化学试题【全国百强校】山西省山西大学附属中学2019届高三上学期9月模块诊断化学试题(已下线)2019届高考热点题型和提分秘籍 第二章 化学物质及其变化 第2讲 离子反应 (题型专练)江西省遂川中学、吉安县中2017-2018学年高一上学期联考化学试题【全国百强校】吉林省实验中学2018-2019学年高一上学期期末考试化学试题【全国百强校】山西省山西大学附属中学2018-2019学年高一下学期2月模块诊断化学试题
10 . 已知:A、B、C均是由短周期元素组成的单质,其余物质均为化合物。F在常温常压下为液态,I为具有磁性的黑色晶体。它们有下图所示的转化关系:

根据以上转换关系回答:
(1)写出反应①的化学方程式:__________________ ____;
(2)写出反应②的离子方程式:_______ _______________________;
写出H+E反应的离子方程式:____ _______________________;
(3)将I溶于足量盐酸,请分别写出反应后混合溶液中存在的阳离子、检验所需试剂及相应现象(可不填满):

根据以上转换关系回答:
(1)写出反应①的化学方程式:__________________ ____;
(2)写出反应②的离子方程式:_______ _______________________;
写出H+E反应的离子方程式:____ _______________________;
(3)将I溶于足量盐酸,请分别写出反应后混合溶液中存在的阳离子、检验所需试剂及相应现象(可不填满):
| 阳离子 | 检验试剂 |
您最近一年使用:0次



